MORTE CELLULARE
Proliferazione e morte cellulare sono eventi fisiologici
•Omeostasi tissutale (di tessuti dinamici)
•Sviluppo embrionale
•Eliminazione di strutture corporee “inutili”•Fasi di scultura/rimodellamento del corpo
Malattie connesse a difetti nel processo di morte cellulare:
- Malattie neurodegenerative
(neuroni con tendenza a morire superiore alla norma)
- Cancro
(mancata morte cellulare)
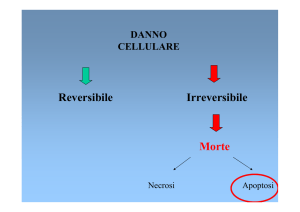
Necrosi: morte accidentale e disordinata, non fisiologica e passiva, in genere causata
da traumi: cellula si rigonfia, rompe e riversa proprio contenuto all’esterno
APOPTOSI: morte programmata e definita dall’attuazione di un programma genetico,
evento rapido e “pulito” : non restano frammenti perchè la cellula espone antigeni
riconosciuti da cellule spazzino: cellule morenti sono fagocitate
Condensazione della cromatina
Formazione vescicole superficiali
La cellula apoptotica assume aspetto caratteristico: nucleo si frammenta, citoplasma si
contrae e si formano bolle superficiali (blebbling): i “corpi apoptotici” che inducono le
cellule spazzino a fagocitare resti cellulari ed eliminarli (Hanno composiz fosfolipidica
peculiare)
Durante l’apoptosi si attivano enzimi
che degradano DNA genomico
tagliandolo con frequenza specifica:à
frammenti discreti
(taglio a livello internucleosomico)
Vari segnali inducono o reprimono l’apoptosi
Il macchinario molecolare per la morte programmata è precostituito in ogni cellula ed
è quindi normalmente frenato fino a quando lo stimolo adeguato lo scatena
•Segnali interni (da nucleo o RE) convergono verso mitocondri
•Segnali esterni: interazione con recettori di morte (NB alcuni segnali possono
indurre sia apopotsi che necrosi es virus, tossine batteriche,...)
Anche in questo caso il microambiente e il contatto con altre cellule producono segnali
importanti che controllano anche l’apoptosi
Ad es tramite recezione tramite integrine di membrana: se cell perde contatto con matrice e
cell vicineà apoptosi (fenomeno dell’ anchorage dependence)
Nobel Medicina , 2002
Identificazione di geni che
regolano apoptosi
Sistema conservato dai vermi
cilindrici (nematodi)
all’uomo!!
I segnali pro-apoptotici (sia esterni che intracellulari) attivano famiglia di caspasi
Le caspasi sono enzimi proteolitici presenti nella cellula come precursori, possono
essere attivate ed autoattivarsi mediante taglio proteolitico
Cascata delle caspasi
L’attivazione a cascata delle caspasi porta a “smantellare” strutture cellulari:
le caspasi “eseguono” il processo di morte.
I substrati delle caspasi sono varie proteine cellulari essenziali:
•Varie proteina-chinasi (tra cui chinasi dei contatti focali)à distacco della
cellula apoptotica dalle vicine
•Lamìneà scomparsa involucro nucleare
•Proteine del citoscheletroà cambia forma cellulare
•Endonucleasi CAD (caspase activated Dnase)à frammentazione del DNA
VIA ESTRINSECA
Diversi segnali extracellulari possono innescare l’apoptosi mediata da famiglia di “recettori di
morte” à caspasi regolativa 8
Ad es TNF prodotto dal SI in riposta a
radiazioni, infezioni virali, agenti
tossici come I chemioterapici,…
Legame con recettore TNFR induce
cambio conformazionale
àsul lato citosolico varie proteine
portano ad attivazione procaspasi 8
iniziatrice
àattiva caspasi effettrici
àApoptosi
àEs recettore FAS: coinvolto
nell’eliminazione/apoptosi di cell T
dopo risposta immunitaria e cellule di
risposta infiammatoria, cellule
infettate da virus o tumorali.
VIA INTRINSECA
Apotosi indotta da segnali interni come danno al
DNA (nucleo), stress ossidativo (RE), carenza di
fattori sopravvivenza (caspasi regolativa 9)
Via interna regolata da famiglia geni Bcl-2 proapoptotici e anti-apoptotici
Stress cellulare
àassociazione di Bcl-2 pro-apoptotico (es Bax) a
membrana esterna del mitocondrio
àAlterazione di permeabilità
à rilascio delle proteine mitocondriali in
particolare cyt C
àAssociazione con procaspasi nel complesso
proteico “apoptosoma”
à attivazione di procaspasi-9 e cascata delle
caspasi effettrici
Cyt C (in verde) si diffonde dai
mitocondri in tutta cellula in seguito ad
induzione di apoptosi
Il nucleo (blu) si frammenta
Le proteine BCL-2 regolano l’equilbrio tra morte e sopravvivenza
Famiglia di proteine con ruolo pro- (BAX, Noxa, Bid, Bad,..) o anti-apoptotico
(bcl2)
Le proteine Bcl-2 interagiscono sulla membrana mt per controllarne la permeabilità
L’effetto anti o proapaptotico dipende dalla combinazione di particolari domini proteici
(BH1-2-3-4)
Le Bcl-2 possono associarsi tra loro: oligomeri modulano permeabilità di membrana mt
varie Bcl-2 si associano tra loro: oligomeri modulano
permeabilità di membrana mt
Bcl-2 antiap lega e blocca proap (es BAX)
Se bax aumentaà bcl-2 inefficienteà apop
Se espressa altra bcl propapà lega bcl-2 eà apop
La funzione delle proteine Bcl-2 può essere modulata dalla presenza di fattori di crescita o
sopravvivenza (segnali esterni): queste innescano sistemi di
fosforilazione/defosforilazione che modulano/inibiscono bcl-2 pro-apoptotica
La funzione delle proteine Bcl-2 può essere
modulata anche dalla presenza di danno
genetico (segnali interni):
p53 attiva trascrizione di geni bcl2 proapoptotici NOXA e Bax
-NOXA lega fattori anti-apoptotici liberando
così BAX
-Bax oligomerizza ed aumenta la
permeabilizzazione membrana mt
à Rilascio cyt C
Ulteriore meccanismo di controllo
Caspasi normalmente bloccate da IAP
Permeabilizzazione della membrana mt
libera (oltre a cyt C) anche fattori che
sequestrano IAP
à Caspasi non più inibite
Le vie intrinseca ed
estrinseca convergono sulle
stesse caspasi effettrici
Speciali lipidi nella membrana dei
corpi apoptotici funzionano da
segnale di riconoscimento: così la
cellula apoptotica viene
selettivamente fagocitata
No rilascio materiale extracellulare
à no reazione infiammatoria
dannosa per tessuto
Eliminazione si conclude anche
entro 1 ora