Diagnostica di Laboratorio delle Inibine
e dell’Ormone Antimulleriano: ruolo e
significato clinico
Dr. Cesare Marolla Ambulatorio Sterilità Corato
3° Convegno di Immunometria del Sud Italia
in collaborazione con ELAS Italia
“Diagnostica Clinica e di Laboratorio della Ipertensione e Monitoraggio della
Funzionalità riproduttiva”
Bari - 25 marzo 2011
LA STRUMENTAZIONE
• HIGH TECH ?
• HIGH TEACH ?
oocita
Confronto misure
10 microns (0.01mm)
VIRUS
(0.05 to 0.1 microns)
BATTERI
(0.5 to 1.5 microns)
100 microns
RBC
(5 microns)
OOCITA
LINFOCITA
(5 to 8 microns)
SPERMATOZOO
(60 microns)
Oocita
Cumulo ooforo
Oocita
Cumulo ooforo
OVAIO
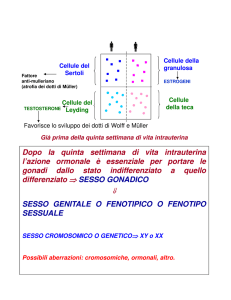
Il ruolo fisiologico dell’ovaio consiste nel
periodico rilascio di gameti (ovociti) e nella
produzione di ormoni quali estrogeni,
progesterone e androgeni. Entrambe le attività
sono tra loro integrate, in un processo continuo
e ripetitivo di maturazione follicolare,
ovulazione, formazione e regressione del corpo
luteo.
Il patrimonio follicolare della donna, come è noto va incontro ad una
fisiologica quanto inarrestabile riduzione nel corso degli anni. Ciascuna
donna riceve il proprio patrimonio di follicoli durante la vita fetale.
Al quarto mese di vita endouterina le ovaie contengono circa 6-7 milioni di
ovociti circondati da un unico strato di cellule della granulosa che
costituiscono il pool dei follicoli primordiali. A causa della repentina
perdita di follicoli primordiali che si manifesta per apoptosi nella seconda
metà della vita fetale, alla nascita rimangono solo 1-2 milioni di follicoli
primordiali . Dopo la nascita, la perdita di follicoli rallenta, tanto che al
menarca sono ancora presenti dai 300 000 ai 400 000 follicoli primordiali.
Durante il periodo riproduttivo, il continuo e graduale declino di questo
numero fa sì che alla menopausa rimangano meno di 1000 follicoli, ormai
irresponsivi .
Marolla C. Ovarian ageing. Ovarian reserve tests.
SIGiTE IX Congresso Nazionale 2008.
RISERVA OVARICA
La “riserva ovarica”, quindi, è la quantità di patrimonio
follicolare (ovocitario) residuo, presente nell’ovaio in quel
momento in cui noi lo stiamo in qualche modo valutando.
La RO è sicuramente correlata alla“risposta ovarica”,
ovvero alla reazione endocrina e follicolare dell’ovaio ad
una stimolazione esogena.
Tuttavia, non è ben chiaro se tra questi due parametri
esista una relazione lineare o se la risposta ovarica
declini improvvisamente una volta che la RO scende al di
sotto di una certa soglia.
Marolla C. Induzione della ovulazione: il ruolo della ecografia.
SIEOG XVI Congresso Nazionale 2008
RISERVA OVARICA
Sebbene la riserva ovarica diminuisca
con l’età, tuttavia essa rappresenta
una funzione biologica e non cronologica,
la cui collocazione temporale è altamente
variabile.
Pertanto appare fortemente necessario
predire la risposta ovarica.
Marolla C. Ruolo della ecografia nella sterilità:high tech or high teach?
Capire per Concepire: Mediprint 2008;1:15-19.
RISERVA OVARICA
Tenendo presente l’importanza di fattori predittivi clinici quali età,
BMI e causa di infertilità, nel corso degli anni sono stati messi a
punto ed utilizzati diversi metodi di valutazione della RO:
Valutazioni endocrine basali
FSH in terza giornata del ciclo
E2 in terza giornata del ciclo
Inibina B in terza giornata del ciclo
AMH (anti Mullerian Hormone)
Test endocrini dinamici
CCCT (Clomiphene Citrate Challenge Test)
EFORT (Exogenous FSH Ovarian Reserve Test)
GAST (GnRH Agonist Stimulation Test)
Valutazioni ecografiche
Volume ovarico
AFC (Antral Follicle Counts)
OSBF (Ovarian Stromal Blood Flow)
Valutazione della riserva ovarica : day2-4
Eco : volume > 6 ml
a.f.c. > 7-8
Ormone anti-mulleriano
F.s.h.
Inibina-B
C.C.C.T.
Valutazione
della qualita’
ovarica
Scelta del protocollo di stimolazione-Ecografia di base : DAY 3
Livelli AMH
Holte 2003 ; Marolla 2008
Scelta del protocollo di stimolazione-Ecografia di base : DAY 3
Livelli AMH
Holte 2003 ; Marolla 2008
Scelta del protocollo di stimolazione-Ecografia di base : DAY 3
Livelli AMH
Holte 2003 ; Marolla 2008
Scelta del protocollo di stimolazione-Ecografia di base : DAY 3
Livelli AMH
Holte 2003 ; Marolla 2008
Scelta del protocollo di stimolazione-Ecografia di base : DAY 3
Livelli AMH
Holte 2003 ; Marolla 2008
A.F.C. – A.M.H.
A.F.C. – A.M.H.
L’ OVAIO contiene le chiavi delle strategie di stimolazione
Il numero dei follicoli reclutabili, la loro sensibilità all’ FSH
e la bioattività dell’ FSH/hMG
Ovaio
– AFC
– Volume
- Flussi Stromali
Clinica
– Età,
riflette AF
– Lunghezza dei cicli, riflette AF
Ormoni
– FSH,
++++
riflette AF e
(Polimorfismo recettori FSH)
Peso corporeo
– BMI - Biodisponibilità
INIBINE E ACTIVINE
Negli ultimi anni nel capitolo della fisiopatologia
ovarica un ruolo importante è stato assunto da una
famiglia di ormoni glicoproteici: l’inibina e l’activina ,
appartenenti alla famiglia dei fattori di crescita del
TGF-beta.
INIBINE E ACTIVINE
L’inibina ha una struttura dimerica, formata dalla
combinazione dalla subunità α e di una delle due
subunità beta, betaA e betaB (inibina A =
alphabetaA; inibina B= alphabetaB). Le stesse
subunità beta presenti nella struttura dell’inibina
vanno a costituire l’activina, di cui si conoscono tre
forme: activina A (betaAbetaA), activina B
(betaBbetaB) e activina AB (betaAbetaB).
INIBINE ( E ACTIVINE )
Nell’ovaio sono prodotte dalle cellule della granulosa e della teca e
partecipano al controllo della secrezione delle gonadotropine: l’inibina
inibisce la secrezione di FSH, mentre l’activina ne stimola il rilascio.
Petraglia, Luisi et al.
INIBINE ( E ACTIVINE )
Nell’ovaio sono prodotte dalle cellule della granulosa e della teca e
partecipano al controllo della secrezione delle gonadotropine: l’inibina
inibisce la secrezione di FSH, mentre l’activina ne stimola il rilascio.
Petraglia, Luisi et al.
INIBINE, ACTIVINE, AMH
Petraglia, Luisi et al.
Inibine, activine, follistatina, AMH
siti di produzione e ruolo fisiologico
Filicori 2010
INIBINE
Petraglia, Luisi et al.
INIBINE
INIBINE
INIBINE
INIBINE
INIBINA B
Molte speranze aveva sollevato la determinazione sierica
dell’inibina B che, come è noto, viene prodotta dalla
coorte di follicoli reclutati in fase follicolare precoce,
per cui valori sufficientemente bassi avrebbero potuto
essere suggestivi di una riserva ovarica bassa.
Con i dati che abbiamo oggi a disposizione, possiamo
concludere dicendo che la determinazione sierica
dell’inibina B e’ più un monitoraggio (peraltro costoso)
della crescita follicolare che un test di riserva ovarica .
INIBINA B
Tuttavia, piu’ recentemente, e’ stata posta attenzione
alla capacita’ predittiva della riserva ovarica delle
variazioni dinamiche della inibina B durante la
stimolazione con FSH . In particolare un incremento
<300 pg/ml tra due determinazioni eseguite il 6° e l’8°
gg di stimolazione con FSH e’ fortemente predittivo di
cancellazione per “poor response”.
Probabilmente l’inibina B è un indicatore dell’attività
ovarica più che della riserva ovarica grazie al legame
diretto con il numero di follicoli in crescita ed è per di
più influenzata dalla diminuzione della funzione ovarica
che si verifica durante le fasi tardive dell’invecchiamento
ovarico e durante il ciclo mestruale.
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PETRAGLIA
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
PUBERTA’
Durante la pubertà femminile, i livelli di inibina B
aumentano dallo stadio I di Tanner fino allo stadio III,
suggerendo un’elevata attività follicolare prima dello
sviluppo del ciclo mestruale ovulatorio, mentre i livelli di
inibina A nel siero diventano misurabili nella pubertà
avanzata, in accordo con l’idea che l’inibina A è
principalmente prodotta dal corpo luteo.
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
VOLPE
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
Clinical usefulness of inhibin assays in gynecology
and obstetrics
Dos Reis FM, De Rezende CP.
Rev Bras Ginecol Obstet. 2009 Dec;31(12):621-5.
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
Fertility and Sterility Vol. 86, No. 2, August 2006
.
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
J. Clin. Endocrinol. Metab. 1998 83: 3110-3114, doi: 10.1210/jc.83.9.3110
.
INIBINE
NELLA MEDICINA DELLA RIPRODUZIONE
Applicazioni cliniche dell’inibina B nel maschio
assenza di differenze significative tra soggetti
normali e pazienti con oligospermia
non permette di prevedere la presenza di
spermatozoi nel corso di prelievo testicolare
(biopsia o agoaspirazione)
.
A.M.H.
L’ormone anti-mülleriano (AMH) è una glicoproteina dimerica, membro
della superfamiglia del TFG-beta,originariamente identificato a causa
del suo ruolo fondamentale nella differenziazione del sesso maschile.
Infatti, espresso nelle cellule del Sertoli dei testicoli fetali, l’AMH
induce la regressione dei dotti mülleriani. In assenza di AMH, i dotti
mülleriani evolvono in utero, salpingi e nella parte superiore della vagina.
A.M.H.
Nelle donne, l’AMH è prodotto dalle cellule della granulosa,
dai follicoli preantrali e antrali
é un prodotto dei follicoli preantrali e antrali di piccole e medie dimensioni
modula lo sviluppo dei follicoli di piccole dimensioni e l’azione dell’FSH sulle
cellule della granulosa
può essere utilizzato quale marker della riserva ovarica
A.M.H.
Livelli sierici di AMH nel corso della vita e
del ciclo mestruale
A.M.H.
AMH COME MARKER DI AGEING OVARICO
A.M.H.
AMH COME MARKER DI RISERVA OVARICA
A.M.H.
CONFRONTO MARKERS RISERVA OVARICA
(a): FSH e AFC non sono attendibili nelle pazienti che sono in trattamento con GnRH agonisti o che
assumono contraccettivi ormonali. Inoltre la conta follicolare antrale può risultare difficoltosa nelle
Donne che presentano cisti ovariche o che hanno una pregressa storia di chirurgia pelvica.
LA MARCA 2010
A.M.H.
Studi sull’AMH come marker di risposta ovarica alla stimolazione ovarica
controllata. Confronto con altri predittori.
A.M.H.
Concentrazioni sieriche di AMH nella PCOS
A.M.H.
Fisiologia dell’AMH nel maschio
prima proteina specifica ad essere espressa dalle cellule
di Sertoli (8°settimana)
induce la regressione delle strutture Mülleriane nel
Maschio
secreta ad alti livelli fino alla pubertà
la sua produzione cala nel corso della pubertà per effetto
degli androgeni
inibisce l’attività aromatasica delle cellule di Sertoli e la
produzione di testosterone dalle cellule di Leydig
nell’adulto è presente in concentrazioni più elevate nel
liquido seminale che nel siero
A.M.H.
Applicazioni cliniche dell’AMH nel maschio
assenza di differenze significative tra soggetti
normali e pazienti con oligospermia
ridotto nei pazienti con azoospermia non
ostruttiva rispetto a quelli con azoospermia
ostruttiva, ma le ampie sovrapposizioni tra i
valori dei due gruppi ne limitano l’utilità
Diagnostica
non permette di prevedere la presenza di
spermatozoi nel corso di prelievo testicolare
(biopsia o agoaspirazione)
RIASSUMENDO
Inibine, activine, follistatina, AMH
Potenziali applicazioni diagnostiche
RIASSUMENDO
Parametri clinici e bioumorali nei disturbi
riproduttivi maschili
RIASSUMENDO
Caratteristiche dei parametri utilizzati per la
valutazione prognostica della funzione riproduttiva
femminile
Conclusioni
la misurazione dell’FSH sierico è semplice e pratica ma offre
informazioni limitate sulle potenzialità riproduttive dei
pazienti con moderate alterazioni della funzione riproduttiva
nel maschio l’inibina B e l’anti-müllerian hormone (AMH)
rivestono uno scarso valore prognostico riproduttivo
l’inibina B non è un valido candidato per la valutazione della
funzionalità ovarica a causa delle sue ampie fluttuazioni nel
corso del ciclo mestruale
l’AMH assieme al conteggio dei follicoli antrali offre il
migliore indice prognostico di risposta insufficiente o
eccessiva alla stimolazione ormonale per le tecniche di PMA
un importante limite all’uso delle misurazione di inibina B e
AMH è rappresentato dalla scarsa diffusione delle tecniche
di dosaggio di questi ormoni ed il loro elevato costo
SALUTI