Università degli Studi di Bari “Aldo Moro”
Corso di Laurea Triennale in
Informatica e Tecnologie per la Produzione del Software
Tesi di Laurea in Algoritmi e Strutture Dati
PREDICTING THE ONSET OF
PAROXYSMAL ATRIAL FIBRILLATION
USING THE
SINGULAR SPECTRUM ANALYSIS
Relatore:
Prof. DONATO MALERBA
Correlatore:
Prof. MASSIMO BILANCIA
Laureando:
NICOLA LAMONACA
Matricola:
531260
Anno Accademico 2012 - 2013
— Ai miei genitori.
— Alle mie nonne.
— A zio Saverio.
v
vi
vii
Sommario
La Fibrillazione Atriale (FA) è una condizione patologica caratterizzata da un
battito accelerato e scoordinato. Essa costituisce oggi una delle maggiori cause di
morte nel mondo, dal momento che la sua presenza quintuplica la probabilità di
ictus cerebrale. La prevalenza della FA aumenta significativamente con l’avanzare
dell’età, con picchi del 31,9% nella fascia d’età 65–74 e del 34,1% nella fascia d’età
75–84 [2]. Oggigiorno, circa 2,8 milioni di persone in USA e 4,5 milioni in Europa sono affette da FA e si stima che nel 2050 gli americani che soffriranno di FA
saliranno ad almeno 5,6 milioni [2]. Il sistema sanitario statunitense sostiene attualmente una spesa di $15,7 miliardi all’anno per l’ospedalizzazione di pazienti affetti
da FA. È evidente come, in un momento economico delicato come quello attuale, lo
sviluppo di un sistema per la previsione dell’insorgenza di fenomeni di FA, oltre a
ridurre drammaticamente la mortalità legata alla malattia – incrementando cosı̀ notevolmente l’aspettativa di vita – rappresenterebbe un enorme risparmio di denaro
pubblico.
Pertanto, obiettivo del presente lavoro di tesi è quello di utilizzare la tecnica della
Singular Spectrum Analysis (SSA) per riuscire a valutare il rischio che un individuo
in condizioni di salute non necessariamente avverse possa andare incontro, in futuro,
ad un evento di Fibrillazione Atriale Parossistica (PAF), rendendo cosı̀ possibile la
semplice cura farmacologica in luogo di tecniche più invasive, quali l’ablazione mediante radiofrequenza o l’impianto di un pace-maker, e comunque evitando, quando
possibile, il ricovero ospedaliero.
Parole chiave: Heart Rate Variability (HRV), Singular Spectrum Analysis (SSA),
Fibrillazione Atriale Parossistica (PAF).
viii
ix
Abstract
Atrial Fibrillation (AF) is a pathological condition characterized by accelerated
and uncoordinated heart beats. Today, it represents one of the major causes of death
in the world, since the risk of consequent stroke is five-fold. The prevalence of AF
grows considerably with aging, with peaks of 31,9% among those in the age 65–74
and 34,1% in the range 75–84 [2]. Nowadays, about 2.8 million of people in the US
and 4.5 in Europe are suffering from AF and, according to estimates, in 2050 the
americans suffering from AF will be at least 5.6 million [2]. The american health
care system regularly meets an expense of $15.7 billion per year for the hospitalization of patients suffering from AF. In such a difficult economical context as the
one we’re experiencing, the development of a system able to predict the onset of AF
phenomena, could not only increase life expectancy, but also save great amount of
public money.
Thus, the goal of this thesis work is to estimate, by using the Singular Spectrum
Analysis (SSA) technique, the risk that a person develops an event of Paroxysmal
Atrial Fibrillation (PAF) in the future, making possible the simple drugs therapy
instead of more invasive techniques, such as radio frequency ablation or pace-maker
implant and anyway avoiding, whenever possible, hospitalization.
Keywords: Heart Rate Variability (HRV), Singular Spectrum Analysis (SSA),
Parossysmal Atrial Fibrillation (PAF).
Indice
1 Introduzione
1.1 Anatomia del cuore . . . . . . . . . . . . . . . .
1.2 Elettrofisiologia del cuore . . . . . . . . . . . .
1.2.1 Il Nodo Seno-Atriale (SA) . . . . . . . .
1.2.2 Il Nodo Atrio-Ventricolare (AV) . . . .
1.2.3 Il meccanismo di depolarizzazione . . .
1.2.4 Il Sistema Nervoso Autonomo (ANS) . .
1.3 Descrizione di un elettrocardiogramma (ECG) .
1.4 La Fibrillazione Atriale (FA) . . . . . . . . . .
1.4.1 Fisiopatologia . . . . . . . . . . . . . . .
1.4.2 Complicanze . . . . . . . . . . . . . . .
1.4.3 Classificazione . . . . . . . . . . . . . .
1.4.4 Epidemiologia . . . . . . . . . . . . . . .
1.4.5 Fattori di rischio . . . . . . . . . . . . .
1.4.6 Sintomatologia . . . . . . . . . . . . . .
1.4.7 Diagnosi . . . . . . . . . . . . . . . . . .
1.4.8 Trattamento . . . . . . . . . . . . . . .
1.4.9 Aspetti economici . . . . . . . . . . . .
1.5 Contesto e motivazioni . . . . . . . . . . . . . .
1.6 Storie di Fibrillazione Atriale . . . . . . . . . .
1.7 Conclusioni . . . . . . . . . . . . . . . . . . . .
Bibliografia
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
1
2
4
4
5
5
6
7
8
9
11
12
13
15
15
15
16
30
31
32
34
36
x
1
Introduzione
Per chi viaggia in direzione ostinata e contraria,
col suo marchio speciale di speciale disperazione
e tra il vomito dei respinti muove gli ultimi passi,
per consegnare alla morte una goccia di splendore,
di umanità,
di verità.
— Fabrizio De Andrè, Smisurata Preghiera
Q
uesto primo capitolo d’introduzione si apre con una breve descrizione
dell’anatomia del cuore; nel paragrafo 1.2 viene analizzato il sistema
di conduzione degli impulsi elettrici, che costituirà un’utile linea guida
per comprendere sia i meccanismi di generazione e propagazione degli
impulsi elettrici attraverso il muscolo cardiaco (ovvero di come nasce un battito cardiaco), sia le cause che sottostanno alla comparsa e al mantenimento dell’aritmia nella FA. Nel paragrafo 1.3 sono descritte le componenti principali di
un elettrocardiogramma (ECG), al fine di introdurre i concetti di supporto allo
sviluppo del lavoro di tesi. Il paragrafo 1.4 è dedicato ad un’ampia descrizione
della Fibrillazione Atriale (FA). Nel paragrafo 1.5 si passa in rassegna la letteratura esistente sull’argomento. Dopodiché, messo da parte l’aspetto squisitamente anatomico-fisiologico, nel paragrafo 1.6 si descrive il contesto in cui si inserisce il presente lavoro e le motivazioni tecniche che ne giustificano la trattazione.
Disclaimer — Questo capitolo è frutto dello studio di molteplici fonti: articoli
scientifici, libri e materiale multimediale, tuttavia non si intende in alcun modo sostitutivo della letteratura e soprattutto del parere di un medico specialista. L’obiettivo
è unicamente quello di creare una base su cui sviluppare il lavoro di tesi vero e proprio nei capitoli successivi, in modo che esso sia quanto più possibile self-contained.
I dettagli non direttamente collegati all’argomento, ma che pure vanno considerati
in vista di uno studio sistematico dello stesso, non sono trattati. In ragione di ciò, si
rimanda alla bibliografia per informazioni più approfondite e dettagliate sul tema.
1
2
1.1
Introduzione
Anatomia del cuore
Il cuore è un muscolo cavo, il cui compito è quello di pompare sangue ricco di
ossigeno e nutrienti a tutte le parti del corpo e richiamare a sé quello ricco di diossido
di carbonio per arricchirlo nuovamente di ossigeno, reindirizzandolo ai polmoni. Il
cuore è composto da quattro camere: atrio destro e atrio sinistro, situati nella sezione superiore, ventricolo destro e ventricolo sinistro, posti in quella inferiore. L’atrio
destro è separato dall’atrio sinistro mediante una sottile membrana, chiamata setto
interatriale, mentre il ventricolo destro è separato dal ventricolo sinistro mediante
una membrana più spessa, detta setto interventricolare. Gli atri sono connessi ai
rispettivi ventricoli mediante tessuto fibroso e non conduttivo che li isola elettricamente gli uni dagli altri. La fig. 1.1 mostra una vista schematizzata dell’anatomia
del cuore.
L’atrio destro riceve il sangue povero di ossigeno da due grosse vene: la vena cava superiore, che raccoglie il sangue proveniente dalla testa e dagli arti superiori e la vena
cava inferiore che rifornisce il cuore del sangue di ritorno dagli arti inferiori e dall’addome. Quando l’atrio destro si rilassa, si crea una depressione che richiama dai vasi
il sangue povero di ossigeno; quando invece si contrae, il sangue viene spinto a forza
nel ventricolo destro e da qui, per mezzo di 5 arterie polmonari, raggiunge i polmoni,
dove viene riossigenato. Il sangue ossigenato raggiunge nuovamente il cuore attraverso le 4 vene polmonari — chiudendo cosı̀ il circuito della piccola circolazione —
ed entra nell’atrio sinistro dal quale, dopo essere stato spinto nel ventricolo sinistro,
fuoriesce per entrare in circolo attraverso l’aorta, dalla quale raggiunge e rifornisce
di ossigeno e nutrienti tutti i tessuti dell’organismo mediante scambi molecolari a
livello dei capillari, percorrendo il circuito della cosiddetta grande circolazione.
Le pareti muscolari del ventricolo sinistro hanno tipicamente uno spessore di circa
il triplo di quello del ventricolo destro — questo perché il sangue in uscita dal ventricolo sinistro deve percorrere il circuito della grande circolazione e deve pertanto
coprire una distanza assai maggiore di quello in uscita dal ventricolo destro e ha
quindi bisogno di una spinta più consistente.
Delle valvole controllano il flusso di sangue dall’atrio sinistro al ventricolo sinistro
(valvola mitralica), dal ventricolo sinistro all’aorta (valvola aortica), dall’atrio destro
al ventricolo destro (valvola tricuspidale) e dal ventricolo destro al tronco polmonare
(valvola polmonare), assicurando che non vi sia del reflusso di liquido ematico, che
causerebbe seri problemi anatomici al cuore e meccanici alla circolazione.
La parete muscolare del cuore è composta da 3 strati: lo strato più interno, molto
sottile, è detto endocardio e riveste le cavità interne del cuore; quello intermedio,
detto miocardio, è lo strato più spesso e possiede la capacità contrattile vera e propria; infine, lo strato più esterno è detto epicardio. L’intero cuore è avvolto in una
sottile sacca, detta pericardio, che tiene l’organo fermo nella sua naturale posizione
grazie a dei legamenti che vi si dipartono e che lo fissano anteriormente allo sterno, inferiormente al centro del diaframma e posteriormente ad esofago, trachea e
bronchi.
1.1. Anatomia del cuore
3
Figura 1.1: Anatomia del cuore.
4
1.2
Introduzione
Elettrofisiologia del cuore
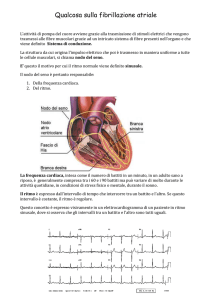
In condizioni di salute normali, il cuore è una pompa estremamente efficiente. Il
merito è del sistema di conduzione elettrica, che garantisce la coordinazione delle fasi
di sistole (contrazione) e diastole (dilatazione), facendo in modo che prima si riempiano gli atri previo rilassamento del miocardio atriale, quindi i ventricoli, mediante
contrazione del miocardio atriale e susseguente rilassamento di quello ventricolare,
in una sequenza precisa e ordinata. La fig. 1.2 mostra una vista schematica del
sistema di conduzione elettrica del cuore.
1.2.1
Il Nodo Seno-Atriale (SA)
Questo meccanismo assai delicato ha inizio in un piccolo ammasso di cellule autoeccitanti, che fissano il ritmo del battito cardiaco. Esse generano spontaneamente
impulsi elettrici regolari, che si diffondono lungo tutto il sistema di conduzione del
cuore e rendono possibile la contrazione del miocardio. Questo pace-maker naturale
prende il nome di Nodo Seno-Atriale (SA) ed è situato nella parte superiore dell’atrio destro, in prossimità della bocca della vena cava superiore. Normalmente, è qui
che nasce il battito cardiaco, grazie ad una rete di cellule pace-maker che esibiscono
il meccanismo dell’automaticità. L’automaticità è la capacità di alcune cellule di
generare periodicamente un impulso elettrico, anche in assenza di stimoli esterni.
Tale meccanismo può essere controllato mediante farmaci oppure mediante stimolazione del sistema nervoso autonomo, in particolare nelle 2 componenti del sistema
nervoso simpatico e sistema nervoso parasimpatico. La stimolazione del sistema
simpatico provoca un incremento della frequenza del battito cardiaco, laddove invece la stimolazione del sistema parasimpatico provoca un decremento della stessa.
Proprio questa variabilità della frequenza cardiaca (Heart Rate Variability, HRV )
consente al cuore di adattarsi alle richieste dell’organismo, permettendogli di battere
più velocemente quando i muscoli necessitano di un maggior apporto di ossigeno e
nutrienti e più lentamente altrimenti. Come si vedrà, l’HRV gioca un ruolo chiave
nella previsione dei casi di pazienti che potrebbero manifestare in futuro eventi di
Fibrillazione Atriale Parossistica (PAF).
Una volta generato, l’impulso elettrico si diffonde attraverso il miocardio dell’atrio destro, stimolandone la contrazione. Quasi simultaneamente, l’impulso viaggia,
attraverso il Fascio di Bachmann, in direzione dell’atrio sinistro, provocandone la
contrazione del miocardio, cosicché l’atrio sinistro si contrae qualche millisecondo
dopo il destro. In aggiunta a ciò, tre fasci nervosi (le vie internodali) conducono
l’impulso al Nodo Atrio-Ventricolare (AV), che a sua volta distribuisce l’impulso ai
due ventricoli.
1.2. Elettrofisiologia del cuore
1.2.2
5
Il Nodo Atrio-Ventricolare (AV)
Il Nodo Atrio-Ventricolare (AV) giace in parte nel settore destro del setto interatriale e in parte nel setto interventricolare. Dal momento che atri e ventricoli sono
separati da tessuto non conduttivo, l’unica via libera attraverso la quale gli impulsi
possono raggiungere i ventricoli è attraverso questo snodo. Gli impulsi viaggiano
dal nodo AV ad una velocità relativamente bassa (˜0,05m/s), generando un piccolo
ritardo. Ciò dà modo alle camere ventricolari di riempirsi, prima che queste si contraggano e il sangue venga espulso.
Il nodo AV è connesso al Fascio di His, che a sua volta si dirama in due fasci: la
branca destra e la branca sinistra. La branca destra percorre il lato destro del setto
interventricolare, diramandosi più e più volte fino a formare le Fibre del Purkinje,
parte terminale del sistema di conduzione del cuore. In maniera del tutto analoga,
la branca sinistra si suddivide nel fascicolo sinistro posteriore e nel fascicolo sinistro
anteriore, che percorrono il lato sinistro del setto interventricolare e si suddividono
ripetutamente fino a formare anch’essi le Fibre del Purkinje.
1.2.3
Il meccanismo di depolarizzazione
La propagazione degli impulsi elettrici attraverso il tessuto conduttivo del cuore è resa possibile grazie a un processo detto di depolarizzazione. In condizioni di
riposo, esiste una differenza di potenziale tra l’interno della cellula e l’esterno, dal
momento che la membrana cellulare tiene separati gli ioni sodio (Na), calcio (Ca)
e potassio (K) di ambo gli ambienti. In tale stato, la cellula si considera come polarizzata. Quando la cellula viene percorsa da un impulso elettrico il cui voltaggio
oltrepassa una certa soglia, la membrana cellulare diventa improvvisamente permeabile e lascia fluire liberamente gli ioni, generando cosı̀ un flusso di corrente ionica
e dando vita alla fase di depolarizzazione cellulare. Ciò causa la contrazione, della
durata di qualche decina di millisecondi e corrisponde alla fase di sistole (atriale o
ventricolare). Al termine della fase di depolarizzazione, la membrana cellulare torna
ad essere nuovamente impermeabile. La ripolarizzazione ha inizio allorché i canali
ionici che attraversano la membrana cellulare pompano all’esterno della cellula gli
ioni in eccesso, ristabilizzando il bilancio di ioni della cellula nuovamente alla sua
condizione di riposo. La fase di ripolarizzazione corrisponde alla diastole .
Le cellule del miocardio che formano il muscolo cardiaco sono interconnesse attraverso membrane specializzate, note come dischi intercalari. Questi dischi contengono
delle aree a bassa resistenza elettrica, chiamate gap junction, che permettono la propagazione dell’impulso elettrico da una cellula a quelle vicine. Data l’elevata massa
muscolare del cuore, la sua depolarizzazione produce nel complesso una forte corrente ionica. Tale corrente fluisce attraverso i tessuti resistivi del corpo, generando una
caduta di voltaggio. L’entità della caduta di voltaggio è sufficientemente elevata da
poter essere rilevata da degli elettrodi fissati all’epidermide. Quindi, gli elettrocardiogrammi (ECG) non sono altro che registrazioni delle cadute di voltaggio causate
dal flusso di corrente ionica generato dalla depolarizzazione del miocardio.
6
Introduzione
1.2.4
Il Sistema Nervoso Autonomo (ANS)
La frequenza con cui il cuore si contrae non è costante nel tempo ma, anzi, è
soggetta a numerosi fattori, che ne determinano un incremento o un decremento.
Alcuni di tali fattori sono il ritmo respiratorio, lo sforzo fisico e gli stati emozionali,
quali rabbia, stress, ansia, rilassamento. Un soggetto in condizioni di salute ottimali espone un’ottima risposta a tali fattori, ovvero una marcata escursione nella
frequenza cardiaca a seconda delle emozioni o dei gradi di sforzo cui è di volta in
volta sottoposto. Responsabile di questa variabilità della frequenza cardiaca (Heart
Rate Variability, HRV) è il Sistema Nervoso Autonomo (ANS).
L’ANS è costituito da porzioni anatomicamente e funzionalmente distinte, ma sinergiche:
• Il Sistema Nervoso Simpatico (SNS);
• Il Sistema Nervoso Parasimpatico (PSNS);
• Il Sistema Nervoso Enterico (ENS).
Di particolare interesse nella modulazione della frequenza cardiaca sono il SNS e il
PSNS. In particolare, il SNS si attiva in risposta a stimoli di allarme e pericolo e
produce, tra le altre cose: la dilatazione dei bronchi, un aumento della pressione
arteriosa, la dilatazione delle pupille, vasocostrizione periferica, un aumento della sudorazione e, soprattutto, della frequenza cardiaca. Sono sintomi, questi, che
fanno capo al cosiddetto istinto fight-or-flight, durante il quale il corpo si prepara
ad affrontare una situazione di forte stress psico-fisico: il cuore pompa sangue più
velocemente e i bronchi si dilatano in modo da ossigenare maggiormente i muscoli
scheletrici in vista del combattimento o della fuga; la digestione rallenta fino anche
a bloccarsi del tutto, poiché la maggior parte del sangue dello stomaco e dell’intestino viene convogliato ai muscoli; viene rilasciato glicogeno e vengono bruciati lipidi
per sostenere lo sforzo muscolare; aumenta la perspirazione attraverso i pori della
pelle per evitare il surriscaldamento dato dal ritmo metabolico aumentato; viene
risvegliata la funzione di coagulazione del sangue, in modo da prevenire un’eccessiva perdita di sangue in caso di ferite e cosı̀ via. Si tratta di una risposta istintiva
che ha avuto origine milioni e milioni di anni fa, quando oltre ad esser cacciatore,
l’uomo era soprattutto preda e la fuga o il combattimento erano questioni di vita o
di morte. I mediatori chimici che sottostanno a tali processi sono le Catecolamine,
come l’Adrenalina e la Noradrenalina. Per contro, il PSNS interviene nei processi di riposo, come: digestione, lacrimazione, salivazione e attività fisiologiche ed è
responsabile della dilatazione dei vasi sanguigni, del rilassamento muscolare, della
diminuizione della pressione e del rallentamento della respirazione e della frequenza
cardiaca. Il mediatore responsabile di tutte queste risposte è l’Acetilcolina.
L’analisi dell’HRV permette di valutare il grado di bilanciamento delle attività dell’SNS e del PSNS, in modo da prevedere il rischio di insorgenza di aritmie cardiache.
Infatti, essendo strettamente legata all’attività del SNS, l’analisi dell’HRV fornisce
informazioni circa un eventuale substrato latente di cardiopatia.
1.3. Descrizione di un elettrocardiogramma (ECG)
7
Figura 1.2: Sistema di conduzione elettrica del cuore.
1.3
Descrizione di un elettrocardiogramma (ECG)
Ora che si è analizzata la struttura del cuore, descritto il funzionamento del sistema di conduzione elettrica, spiegato come nasce un battito cardiaco e descritti
i fattori che agiscono sulla frequenza cardiaca, si è pronti per la descrizione della
struttura di un ECG. Si è detto che l’ECG è una registrazione grafica delle cadute
di voltaggio generate dalla depolarizzazione del miocardio. La fig. 1.3 mostra il
tracciato di tali cadute di voltaggio in una persona sana. L’ECG rivela molte informazioni riguardanti il cuore: la sua frequenza, se le vie di conduzione elettrica sono
intatte, se qualcuna delle camere cardiache è allargata e perfino la posizione approssimativa di un’ischemia in corrispondenza di un infarto miocardico e si compone di
onde, segmenti e intervalli:
• Le onde sono etichettate con le lettere P, QRS, T e U. Tipicamente, l’ECG
di una persona sana non mostra la presenza di un’onda U.
• I segmenti sono archi di tempo tra onde. Ad esempio, il segmento PR
rappresenta la durata dell’ intervallo di tempo tra le onde P ed R.
• Gli intervalli sono archi di tempo che includono onde e segmenti. Ad esempio,
l’intervallo PR è composto dall’onda P e dal segmento PR.
L’informazione più importante veicolata da un tracciato dell’attività cardiaca è
quella associata alle varie onde presenti nell’ECG:
• L’onda P corrisponde alla fase di depolarizzazione del miocardio atriale e
indica l’inizio della contrazione che spingerà il sangue nei ventricoli.
8
Introduzione
• Le onde Q, R ed S sono solitamente trattate come un’unica onda composita,
nota come complesso QRS. Il complesso QRS riflette la fase di depolarizzazione del miocardio ventricolare e denota l’inizio della contrazione ventricolare,
che pomperà il sangue verso i polmoni e in tutto il corpo.
• L’onda T corrisponde alla ripolarizzazione del miocardio ventricolare, step
necessario affinché questo possa contrarsi nuovamente. La coda dell’onda T
coincide con la fine del processo di ripolarizzazione, ovvero quando questo
è completo. Si noti che la fase di ripolarizzazione atriale non è osservabile
all’interno del tracciato dell’ECG, poiché inglobata nel complesso QRS.
• Infine, l’onda U rappresenta, secondo alcune teorie, la ripolarizzazione delle strutture dell’endocardio oppure la depolarizzazione tardiva del miocardio
ventricolare. È quasi certo che si tratti di un campanello d’allarme, poiché in
ECG normali il suo picchio massimo ha un’altezza inferiore al 10% dell’altezza
del complesso QRS, mentre diventa più prominente in casi di intossicazione
farmacologica o di squilibrio elettrolitico [1].
Proseguendo nella descrizione della struttura di un ECG, risulta utile porre il
tracciato cardiaco in relazione al tempo e al voltaggio delle correnti ioniche. Infatti,
senza un sistema di riferimento, è impossibile dare un’interpretazione alle varie onde. A tal proposito, il tracciato è posto su una griglia in un riferimento cartesiano
le cui ascisse rappresentano il tempo e le cui ordinate rappresentano una differenza
di potenziale elettrico (dpe). Ogni quadratino copre, lungo le due dimensioni, un
intervallo, rispettivamente, di 0,2s e 0,5mV e ciascuno è suddiviso, sia orizzontalmente che verticalmente, in cinque sotto-intervalli di ampiezza 0,04s nella direzione
delle ascisse e 0,1mV lungo le ordinate. A questo punto, avendo introdotto un’unità
di misura appropriata, si potranno fissare intervalli di ampiezze temporali e di dpe
entro i quali le diverse onde si considereranno nella norma. Ciò è particolarmente
importante nella diagnosi di aritmie e cardiomiopatie mediante ispezione del tracciato elettrocardiografico. La sindrome del QT lungo, una rara cardiomiopatia mortale
associata ad una ritardata ripolarizzazione delle cellule miocardiche, è solo uno dei
molteplici esempi di cardiomiopatie diagnosticabili analizzando la morfologia e le
estensioni temporali dei vari complessi d’onda.
1.4
La Fibrillazione Atriale (FA)
In condizioni di riposo e di buona salute, la frequenza cardiaca si attesta su una
media di 70 battiti al minuto (bpm) nell’uomo e 75 nella donna. Quando essa è
irregolare e raggiunge i 400–600 bpm, si è in presenza di Fibrillazione Atriale (FA).
La FA è una tachiaritmia sopraventricolare, caratterizzata da un’attività elettrica
atriale caotica che porta alla perdita della funzione di contrazione atriale ed è la
forma più diffusa di aritmia cardiaca.
1.4. La Fibrillazione Atriale (FA)
9
Figura 1.3: ECG di una persona sana. [1], pag. 2
1.4.1
Fisiopatologia
Nella sezione 1.2 si è descritto il meccanismo di propagazione degli impulsi cardiaci in un cuore sano. In un cuore affetto da FA, gli impulsi elettrici generati dal
nodo Seno-Atriale (da cui dipende un battito cardiaco normale, anche detto ritmo
sinusale) sono sopraffatti da impulsi elettrici caotici, prevalentemente ectopici (cioè
non originati nel nodo SA), che portano ad una propagazione irregolare dell’impulso,
che si frammenta in innumerevoli fronti d’onda. La FA presuppone sia l’esistenza
di eventi che causino l’insorgenza dell’aritmia, sia di un substrato che ne consenta
il mantenimento. Una delle teorie più accreditate per la spiegazione dei meccanismi
di mantenimento dell’aritmia è quella dei rientri multipli, proposta da Moe et al.
[22], validata anche da altri autori e avvalorata da studi elettrofisiologici effettuati
con registrazioni simultanee in punti diversi del tessuto atriale [28]. Secondo questa
teoria, numerosi fronti d’onda vengono condotti nella parete atriale in modo caotico,
andando incontro a fenomeni di fusione e interazione reciproca. Tali eventi portano
al continuo annullamento di fronti d’onda e alla generazione di nuovi fronti, in modo
altrettanto caotico.
Per comprendere bene questa teoria è necessario prima comprendere il fenomeno del
rientro (reentry): in un tessuto normale, se una singola fibra nervosa si dirama in 2
branch (1 e 2 nell’immagine a sinistra in figura 1.4), il potenziale d’azione li attraversa entrambi. Un elettrodo (∗), posizionato lateralmente allo sbocco del branch
1, rileverebbe potenziali d’azione ben distinti ogniqualvolta nuovi impulsi dovessero
raggiungerlo. Se i branch 1 e 2 comunicano tra loro per mezzo di un terzo branch (3),
i potenziali d’azione che viaggiano all’interno del branch 3 si annullano a vicenda.
L’immagine a destra in figura 1.4 mostra, invece, cosa accade in presenza di rientro:
10
Introduzione
il branch 2 ha un blocco unidirezionale anterogrado (area grigia). Ciò significa che
gli impulsi non attraverseranno quest’area in senso anterogrado, ma solo in senso
retrogrado (dal branch 3 al branch 2, freccia blu). Nell’area grigia, il potenziale
d’azione viene rallentato a causa della depolarizzazione e, quando ne esce, se trova il
tessuto in stato eccitabile, continua a viaggiare percorrendo nuovamente il branch 1,
ovvero vi rientra. Se, invece, in uscita dall’area grigia, il tessuto non è attualmente
eccitabile, il ché avviene quando è in pieno periodo di refrattarietà, il potenziale
d’azione semplicemente muore. Se il potenziale d’azione ha modo di rieccitare il
tessuto miocardico, si genera un ciclo (in tal caso in senso antiorario) di impulsi ad
alta frequenza, che diviene la fonte dei potenziali d’azione che si trasmettono a tutto
il cuore (rientro globale) o a una sua parte (rientro locale) lungo i percorsi nervosi.
Nel caso della FA, i rientri (multipli) sono locali agli atri. Perché si verifichi un
fenomeno di rientro è necessaria la compresenza di alcuni fattori:
• eventuali blocchi anterogradi lungo le varie vie nervose;
• il giusto timing, ovvero un’alta probabilità che il tessuto sia eccitabile quando l’impulso che viaggia in senso retrogrado abbandona un’area di blocco
anterogrado;
• la lunghezza del periodo di refrattarietà del tessuto miocardico.
Dal momento che sia il timing sia lo stato di refrattarietà del tessuto sono fattori
importanti nell’insorgenza del rientro, alterazioni nell’uno e/o nell’altro possono sia
amplificarlo che abolirlo del tutto. Per questa ragione, cambiamenti nel sistema nervoso autonomo si riflettono direttamente sui meccanismi di rientro. Molti farmaci
antiaritmici, come si vedrà nel paragrafo 1.4.8, agiscono sulle proprietà elettriche
del cuore, rallentando la velocità di conduzione degli impulsi oppure allungando il
periodo di refrattarietà – prima che sia trascorso il quale il tessuto miocardico non è
ancora completamente eccitabile per una nuova, vigorosa contrazione – in modo che
il potenziale d’azione da rientro trovi del tessuto non eccitabile e muoia, con effetti
benefici sull’evoluzione dell’aritmia, mentre altri farmaci agiscono direttamente sul
sistema nervoso autonomo, in particolare sul nervo vago, stimolando la sua capacità
di rallentamento della frequenza cardiaca.
Nel paragrafo 1.4.8 si approfondiranno i meccanismi d’azione dei vari farmaci antiaritmici (che agiscono sui canali ionici), utili nella strategia terapeutica di controllo
del ritmo e depressori del nodo AV (che stimolano l’attività del nervo vago), di particolare interesse nella strategia di controllo della frequenza.
Anticipando quanto si esporrà nel paragrafo 1.4.7, dovrebbe essere chiaro perché
l’ECG di un paziente affetto da FA non mostri la presenza di onde P, ma solo di innumerevoli e lievi flessioni della linea isoelettrica, le onde F: queste sarebbero niente
meno che la conseguenza dei rientri multipli che, in luogo di un’unica contrazione
atriale ben definita, ne generano innumerevoli di entità appena percettibile.
Entrambi i meccanismi di insorgenza e mantenimento sono, inoltre, facilitati da alterazioni strutturali della parete atriale, come fibrosi endomiocardica, necrosi, apoptosi
1.4. La Fibrillazione Atriale (FA)
11
Figura 1.4: Propagazione regolare dell’impulso cardiaco (a sinistra) e meccanismo
di rientro (a destra) in una fibra nervosa cardiaca.
e ipertrofia, che tipicamente si riscontrano nella dilatazione dell’atrio sinistro e che
sono comunque poi causati dal prolungato perpetuarsi della FA stessa. In tal senso,
la FA persistente di lunga durata costituisce a sua volta una causa del suo stesso
mantenimento. Esiste, comunque, anche una predisposizione genetica, che è più importante nei casi di FA primitiva (o isolata).
Nel paragrafo 1.4.3 si studieranno dettagliatamente le varie classi di FA.
1.4.2
Complicanze
La contrazione scoordinata di atri e ventricoli determina delle modificazioni elettriche, meccaniche e anatomiche [13, 14, 15] degli atri: dal punto di vista elettrico,
si registra un accorciamento del periodo refrattario, una dispersione del potenziale
d’azione e un rallentamento della velocità di propagazione degli impulsi (rimodellamento elettrico). Tali alterazioni aumentano la facilità con cui la FA si innesca e
rendono difficoltoso ogni tentativo di ripristino del ritmo sinusale. Le alterazioni a
livello meccanico (rimodellamento meccanico) provocano una compromissione della
funzione contrattile atriale (stunning) con conseguente perdita di efficienza nella
funzione di pompaggio del sangue. Le modificazioni a carico della struttura atriale
sono definite rimodellamento anatomico: le camere cardiache si allargano e le pareti
muscolari vanno incontro a fibrosi e perdono massa (quindi capacità contrattile).
Ne deriva che l’output cardiaco può risultare ridotto fino al 25% della sua capacità
originale; alla lunga, ciò può portare ad insufficienza cardiaca, una condizione
nella quale il cuore non è più in grado di rifornire gli organi della giusta quantità di
sangue.
Ma la contrazione scoordinata fa anche sı̀ che il sangue non fluisca via velocemente
verso i ventricoli e cosı̀ ristagni nelle camere superiori del cuore, formando dei trombi, che occasionalmente possono staccarsi dalla sede dove sono depositati e viaggiare
12
Introduzione
attraverso l’intero apparato cardiovascolare, diventando emboli. Quando uno di tali
emboli raggiunge il cervello, ostruendo il normale afflusso di sangue all’interno di
un vaso cerebrale, si ha un ictus cerebrale. La FA ha, quindi, tra i suoi effetti
collaterali più importanti, l’aumento considerevole dei rischi di ictus cerebrale, che
sono tanto più elevati quanti più e più accentuati sono i fattori di rischio addizionali.
Circa il 15% di tutti gli ictus registrati in USA può essere attribuito alla FA [2, 8].
1.4.3
Classificazione
Esistono diverse classificazioni della FA, differenziate dal particolare aspetto clinico o elettrocardiografico/elettrofisiologico di cui si tiene conto. Di seguito si propone la classificazione effettuata dall’AIAC in [7]. La classificazione prevede le seguenti
forme di FA:
• FA di nuova insorgenza: insorge per la prima volta nella storia clinica di un
dato paziente, a prescindere dalla presenza o assenza di sintomi, dalla durata
dell’episodio e da precedenti episodi non documentati;
• FA primitiva o isolata: colpisce prevalentemente individui di età inferiore ai 60
anni che non mostrano i segni di una concomitante patologia cardiopolmonare,
ipertensione arteriosa o altri fattori noti e identificabili di FA;
• FA secondaria: è possibile individuare la/le causa/e dell’aritmia o comunque
delle condizioni cliniche favorevoli alla sua insorgenza;
• FA parossistica (PAF): termina spontaneamente entro 48h oppure è interrotta
manualmente mediante cardioversione elettrica o farmacologica entro tale lasso
di tempo. La PAF è il focus del presente lavoro di tesi. Il motivo per cui tanta
attenzione è riservata a questa classe di FA è che essa rappresenta lo stadio
iniziale di questa patologia, durante il quale è ancora possibile intervenire per
bloccarne la cronicizzazione in condizioni più serie e debilitanti, descritte di
seguito;
• FA ricorrente: qualsiasi forma di recidiva di FA;
• FA persistente: dura più di 48h (fino a 1 anno) e/o è interrotta mediante
cardioversione elettrica o farmacologica dopo tale periodo. Nell’aggiornamento 2013 delle proprie linee guida, l’AIAC ha ritenuto opportuno rimuovere il
limite di 7 giorni che nella versione 2010 delle stesse discriminava la FA parossistica e quella persistente, in quanto rivelatosi infondato dal punto di vista
clinico. Si è quindi introdotto un cut-off di 48h per meglio rispecchiare le implicazioni terapeutiche che lo stesso comporta. Infatti, superate le 48h, diventa
obbligatorio intervenire mediante anticoagulanti, prima di poter eseguire una
cardioversione elettrica o farmacologica;
1.4. La Fibrillazione Atriale (FA)
13
• FA persistente di lunga durata: si manifesta in episodi che si protraggono ininterrottamente da più di un anno. Il limite di 1 anno è rilevante perché dalla durata dell’aritmia dipende il successo delle procedure di ablazione transcatetere
o chirurgica, mediante le quali si è soliti intervenire in questi casi;
• FA permanente: non è stato ancora effettuato alcun trattamento mediante
cardioversione o, se effettuato, si è rivelato inefficace, o per mancato ripristino
del ritmo sinusale oppure per recidive precoci che sconsigliano ulteriori interventi di cardioversione. A questo punto, si può solo imparare a convivere con
questa condizione;
• FA silente o asintomatica: comprende le forme di FA la cui diagnosi avviene
casualmente, senza particolari sintomi diretti che ne giustifichino la presenza,
oppure in seguito a complicanze correlate, come ictus cerebrale o cardiomiopatia. Questa forma di FA può comprendere una qualunque delle tipologie
temporali precedentemente elencate.
È bene precisare che le forme di FA descritte non sono mutuamente esclusive in
uno stesso paziente e quindi è possibile avere una forma di FA che sia contemporaneamente persistente e silente; inoltre, nel corso della storia clinica di un paziente,
è possibile osservare delle mutazioni della classe di FA avvertita in un determinato
momento e, anzi, a meno di intervento chirurgico o farmacologico, ciò costituisce la
regola, più che l’eccezione.
1.4.4
Epidemiologia
La prevalenza nella popolazione mondiale è stata riportata da diversi studi attestarsi attorno all’1% [24, 25, 26].
Da uno studio, della durata di 18 mesi, condotto da Go et al. [2] nel luglio 1996 su
quasi 18.000 pazienti affetti da FA e pubblicato nel 2001 sul Journal of American
Medical Association, è emerso che solo il 10% dei pazienti in esame aveva un’età
inferiore ai 55 anni, mentre la fascia d’età 55–64 anni era popolata dal 13,6% della
coorte, il 31,9% ricadeva nella fascia d’età 65–74 anni, il 34,1% nella fascia d’età
75–84 anni, mentre il 10,5% dei pazienti aveva 85 anni o più. Si è notato che la
FA prevale maggiormente tra il sesso maschile; infatti, tra gli uomini, la prevalenza
oscillava tra lo 0,2% per gli under-55 e circa l’11% per gli over-85. Nelle donne,
invece, tra lo 0,1% e il 9,1% del medesimo gruppo d’età. Altro fattore di prevalenza
si è mostrato essere la carnagione chiara e la discendenza europea: si è scoperto che,
fino ai 59 anni d’età, la prevalenza era identica tra i pazienti con carnagione chiara
e quelli con carnagione scura (0,5%), mentre tra i 60 e i 69 anni la prevalenza era,
rispettivamente, dell’1,8% e dell’1,3%, laddove tra i 70 e i 79 anni era del 5,2% e del
4,4%; infine; tra gli over-80, essa era del 9,9% per i pazienti con carnagione chiara e
del 7,7% per i pazienti con carnagione scura, con un rapporto percentuale pressoché
costante: tra 1,18 e 1,38. Il fattore carnagione, quindi, è solo leggermente influenzato
dal fattore età e può pertanto essere inteso in senso assoluto: a prescindere dall’età,
14
Introduzione
pazienti con carnagione scura hanno circa il 78% di probabilità in meno di andare
incontro ad episodi di FA rispetto a pazienti con carnagione chiara.
Da uno studio del 2006 condotto da Heeringa et al. [9], effettuato come parte dello studio Rotterdam su una coorte di 6808 pazienti affetti da FA, è emerso che in
Europa la prevalenza è dello 0,7% per la fascia d’età 55–59 anni e del 17,8% tra gli
over-85. Come si vede, l’elevata percentuale di prevalenza tra gli over-85 trovata da
Heeringa et al. conferma il dato della carnagione chiara e discendenza europea come
fattore rilevante nell’insorgenza della FA anticipato da Go et al. 10 anni prima.
Un recente studio prospettico realizzato in Veneto su una popolazione di pazienti
con più di 65 anni ha rivelato che la prevalenza in Italia è del 4.2% per la fascia
d’età 65–74 anni, del 9,4% per la fascia d’età 75–84 anni e 17% tra gli over-85. Proiettando il dato mondiale di prevalenza dell’1% sulla popolazione italiana (circa 60
milioni di persone) si calcola facilmente che almeno 600.000 italiani soffrono oggi di
FA. Fino al 2001, 5 studi si sono posti come obiettivo l’analisi della prevalenza della
FA [16, 17, 18, 19, 20]. I risultati ottenuti da Go et al. sono consistenti con ciascuno
di essi, pur avendo potuto contare su una numerosità del campione più elevata (il
ché implica una maggiore affidabilità della stima ottenuta) e di una diversità etnica
assai più ricca.
Altro elemento di novità presente in [2] è la proiezione delle percentuali di prevalenza della FA nel periodo 1995–2050. Essi stimano che, attualmente, in USA vi siano
all’incirca 2,8 milioni di persone con problemi di FA e che tale numero raddoppierà
fino al 2050. Questo andamento riflette l’invecchiamento della popolazione mondiale dopo l’esplosione delle nascite avvenuto nell’immediato secondo dopoguerra,
la crescita costante della popolazione mondiale e l’aumento della sopravvivenza dei
soggetti affetti da condizioni cliniche strettamente legate alla FA, come coronaropatie, ipertensione arteriosa e scompenso cardiaco.
La FA è parossistica nel 36% dei soggetti, persistente nel 28% e permanente nel
rimanente 36% dei casi. In termini assoluti, la FA colpisce all’incirca 6 milioni di
persone in Europa, 8 milioni in Cina e 2,8 milioni negli Stati Uniti.
Wolf et al. hanno calcolato che l’incidenza della FA risulta essere di circa lo 0,2%.
Anch’essa, come la prevalenza, tende sia ad aumentare col progredire dell’età — con
una variabilità che va dallo 0,02% per pazienti di età inferiore ai 40 anni, al 3,9% per
pazienti con più di 80 anni d’età [16] — sia ad aumentare col passare del tempo [26].
Assumendo un’incidenza dello 0,2%, è lecito ritenere che ogni anno circa 120.000
persone in Italia vadano incontro a fenomeni di FA di nuova insorgenza. Concludendo, possiamo affermare che la FA è una patologia che si manifesta principalmente
tra persone d’età avanzata, di sesso maschile e discendenza europea.
1.4. La Fibrillazione Atriale (FA)
1.4.5
15
Fattori di rischio
Come si è appena visto, il fattore di rischio principale è senza dubbio l’età. Tuttavia, a favore dell’insorgenza della FA, giocano anche altri fattori, quali l’obesità,
la presenza di coronaropatie, il sesso (gli uomini hanno un rischio di sviluppare la
FA 1,5 volte maggiore rispetto alle donne), la presenza di diabete, ipertensione, valvulopatie, insufficienza cardiaca [6], ipertiroidismo e abuso di alcool, droghe e fumo.
Due circostanze speciali che sembrano facilitare l’insorgenza di FA sono costituite
dalla predisposizione genetica e dagli interventi chirurgici a cuore aperto.
1.4.6
Sintomatologia
I primi sintomi avvertiti in presenza di FA sono le palpitazioni. Infatti, in concomitanza con l’insorgenza della fibrillazione, il paziente stesso avverte una sensazione
di battito irregolare, spesso descritta come il battito d’ali di una farfalla nel petto.
In secondo luogo, si avverte un senso di spossatezza, associata a giramenti di testa,
fiato corto, angina pectoris, vertigini e sincope.
1.4.7
Diagnosi
Il mezzo principale mediante il quale viene diagnosticata la FA è l’ECG. Infatti, mentre nel tracciato elettrocardiografico di un’attività cardiaca regolare si
distinguono chiaramente complessi P-QRS-T che si ripetono ad intervalli regolari,
in quello di un’attività sottoposta a FA si nota un’eccessiva attenuazione delle onde
di depolarizzazione atriale (onde P), al punto da renderne pressoché impossibile l’individuazione; ciò che si nota, in luogo delle onde P, sono tante piccole fluttuazioni
della linea isoelettrica dell’ECG (corrispondente ad una dpe di 0mV) che si susseguono disordinatamente, dette onde F. Le onde F sono caratterizzate da continue
variazioni di forma, di voltaggio, di frequenza (anche 400-600/min) e di ampiezza
degli intervalli FF tra un’onda e la successiva. In tal modo, l’ECG assume il tipico
aspetto frastagliato che caratterizza un’attività cardiaca sotto FA. Come anticipato
nel paragrafo 1.4.2, una possibile spiegazione della presenza di onde F in luogo di
onde P ci viene fornita dalla teoria dei rientri multipli. Altro elemento di differenza rispetto ad un ECG regolare sono le distanze tra i picchi R, che non rispettano
apparentemente alcun pattern, dando luogo ad un cosiddetto ritmo irregolarmente
irregolare, un ritmo, cioè, caratterizzato da onde di forma anomala e che non si
ripetono con cadenza regolare. Il motivo dell’irregolarità degli intervalli RR risiede
nel fatto che degli innumerevoli impulsi di origine atriale, solo una piccola parte
raggiunge i ventricoli e ciò può dipendere da numerosi fattori, come la presenza o
assenza di vie accessorie a quella principale, l’azione di farmaci o il tono del sistema
nervoso autonomo. La figura 1.5 mostra l’ECG di una persona affetta da FA.
16
Introduzione
Figura 1.5: ECG di un paziente affetto da FA. Si notino l’assenza di onde P distinte
e l’irregolarità degli intervalli RR.
1.4.8
Trattamento
A partire dalla fine degli anni ’80, è nato un vivace dibattito su quale fosse la
miglior strategia per far fronte alla FA: limitarsi a rallentare il ritmo di contrazione dei ventricoli, causa principale dei sintomi collegati alla FA, mediante farmaci
depressori del nodo AV oppure tentare a tutti i costi di ripristinare e mantenere
il ritmo sinusale? Oggi si è soliti riferirsi a queste due strategie, rispettivamente,
con i nomi controllo della frequenza e controllo del ritmo. Per cercare di rispondere
alla domanda, tra il 2000 e il 2009 sono stati effettuati 7 studi randomizzati. Se ne
riportano sinteticamente i risultati:
• PIAF (Pharmacological Intervention in Atrial Fibrillation) [36, 37]: (1) miglior tolleranza all’esercizio fisico senza un generale miglioramento della qualità della vita e (2) maggior numero di ospedalizzazioni nel gruppo relativo al
controllo del ritmo.
• STAF (Strategies of Treatment of Atrial Fibrillation) [38]: nessuna differenza
statisticamente rilevante tra le due strategie, a parte: (1) lieve incremento di
mortalità totale (4,9% vs. 2,5% p.a.) nel gruppo relativo al controllo della frequenza; (2) maggior numero di ospedalizzazioni nel gruppo relativo al
controllo del ritmo.
• RACE (Rate Control versus Electrical Cardioversion for Persistent Atrial
Fibrillation) [39]: nessuna superiorità di una strategia sull’altra ad un followup medio di 2,3 anni, a parte: (1) tendenza verso una minore incidenza di
eventi nel gruppo relativo al controllo della frequenza (17,2% vs. 22,6%); (2)
maggior numero di eventi tromboembolici nel gruppo relativo al controllo del
ritmo.
• AFFIRM (Atrial Fibrillation Follow-up Investigation of Rhythm Management) [40]: (1) tendenza all’incremento di mortalità totale nel gruppo relativo
al controllo del ritmo (26,7% vs. 25,9%) ad un follow-up medio di 3,5 anni e
1.4. La Fibrillazione Atriale (FA)
17
periodo massimo di osservazione di 6 anni; (2) un’analisi post-hoc ha mostrato
un aumento di sopravvivenza quando la persistenza del ritmo sinusale è ottenuta senza l’impiego di antiaritmici et vice versa [53]; (3) maggior numero di
eventi tromboembolici nel gruppo relativo al controllo del ritmo; (4) maggior
numero di ospedalizzazioni nel gruppo relativo al controllo del ritmo.
• HOT CAFÈ (How to Treat Chronic Atrial Fibrillation) [41]: nessuna differenza statisticamente rilevante tra le due strategie ad un follow-up medio di
1,7 anni, a parte: (1) minore percentuale di ospedalizzazioni nel gruppo relativo al controllo della frequenza; (2) miglior tolleranza all’esercizio nel gruppo
relativo al controllo del ritmo.
• AF-CHF (Rhythm Control versus Rate Control for Atrial Fibrillation and
Heart Failure) [42]: (1) in pazienti con scompenso ventricolare sinistro, la
strategia di controllo del ritmo non riduce la mortalità per cause cardiovascolari
rispetto alla strategia di controllo della frequenza (27% vs. 25%); (2) maggior
numero di ospedalizzazioni per FA (4% vs. 9%) e bradiaritmie (6% vs. 3%)
nel gruppo relativo al controllo del ritmo.
• J-RHYTHM (Japanese Rhythm Management Trial for Atrial Fibrillation)
[43]: (1) in pazienti affetti da PAF, nessuna differenza statisticamente rilevante
tra le due strategie ad un follow-up medio di 1,6 anni per quanto riguarda
l’incidenza di ictus, di emorragie, scompenso cardiaco e morte.
Tali studi hanno mostrato chiaramente che le due strategie sono sostanzialmente
simili nella capacità di prevenzione dei fenomeni trombo-embolici cerebrali e che
oggigiorno molti pazienti affetti da FA permanente possono essere trattati opportunamente mediante la strategia di controllo della frequenza, senza che ciò comporti necessariamente un aumento della mortalità o dell’incidenza di eventi trombo-embolici;
tuttavia, sarebbe un errore considerare tale possibilità in maniera assoluta, cioè slegata da fattori quali: la durata dell’aritmia, la loro natura, frequenza e intensità,
l’esistenza di eventuali cardiomiopatie associate, il pattern della FA, le dimensioni
dell’atrio sinistro, la tolleranza ai farmaci da parte dei pazienti, nonché la loro età e
la volontà ad essere sottoposti a cure farmacologiche.
Allora, un possibile flow-chart ad alto livello, che consenta di decidere il trattamento
più opportuno per un paziente affetto da FA consiste, anzitutto, nella valutazione
della situazione clinica del paziente e della storia dell’aritmia. Solo a questo punto si
può considerare l’opportunità o meno di un tentativo di ripristino e mantenimento
del ritmo sinusale mediante una procedura detta di cardioversione. Al primo episodio — anche asintomatico — di FA è consigliato eseguire almeno un tentativo di
ripristino del ritmo sinusale, purché l’età del paziente e la presenza di copatologie
ne rendano opportuna l’esecuzione. Qualora l’aritmia fosse di insorgenza inferiore
alle 48h ed esclusa la presenza di cardiopatie rilevanti, la prima scelta per il ripristino del ritmo sinusale deve ricadere sulla cardioversione farmacologica mediante
18
Introduzione
farmaci antiaritmici. Nei casi complementari o in presenza di emodinamica instabile, tale ripristino andrebbe effettuato mediante cardioversione elettrica (CVE).
Indipendentemente dalla scelta effettuata, è necessario scongiurare opportunamente
i rischi di eventi trombo-embolici mediante somministrazione di anticoagulanti orali
o antiaggreganti piastrinici. Dopo aver eseguito la procedura di ripristino del ritmo sinusale, talora non è necessaria alcuna profilassi delle recidive ma, qualora lo
fosse (accessi molto frequenti, >1/mese), il primo step terapeutico è costituito dai
farmaci antiaritmici, mentre in caso di inefficacia o intolleranza, va presa in considerazione l’ablazione transcatetere oppure lasciare che la patologia cronicizzi e
il paziente impari a conviverci. Anche in questo caso, sia in caso di ablazione che
di cronicizzazione, è opportuno prestare particolare attenzione al rischio di eventi
trombo-embolici ed agire di conseguenza.
I dati di letteratura non sono in grado di suggerire quale comportamento tenere dopo il primo accesso di FA, non essendovi mai stati studi prospettici che indagassero
il decorso della tachiaritmia a partire dal primo episodio. L’esperienza clinica insegna che, in alcuni pazienti, le recidive tachiaritmiche si osservano in tempi brevi; in
altri, invece, tali recidive compaiono dopo anni o addirittura il primo episodio può
rimanere isolato. Un consiglio utile al riguardo potrebbe essere quello di iniziare la
profilassi antiaritmica farmacologica dopo il primo episodio di FA solo nei casi in cui
l’aritmia è associata ad una grave compromissione emodinamica e in quelli in cui il
rischio di recidive con conseguente rimodellamento atriale sfavorevole è considerato
elevato.
Il ripristino del ritmo sinusale non è sempre indicato. Infatti, i pazienti che entrano ed escono frequentemente dall’aritmia, hanno un rischio trombo-embolico più
elevato che non in fibrillazione atriale permanente, perché durante la fibrillazione
è come se gli atri fossero paralizzati e, quindi, una eventuale presenza di coaguli
all’interno dell’auricola sinistra non costituirebbe un rischio particolare. Ripristinare il ritmo sinusale, invece, significherebbe smuovere tali coaguli formatisi, con un
evidente pericolo di ictus cerebrale. In questo caso, allora, si preferirà mantenere
il paziente in fibrillazione e lasciare che essa cronicizzi. Qualora ripetuti tentativi
di cardioversione non sortiscano gli effetti desiderati è opportuno intraprendere la
via del controllo della frequenza. La prima scelta è indubbiamente quella farmacologica, mediante somministrazione di farmaci depressori del nodo AV mentre,
nei casi in cui non sia possibile ottenere un’adeguata risposta ventricolare mediante
impiego di farmaci, dovrebbero essere considerati l’ablazione transcatetere della
giunzione atrioventricolare e l’impianto di pace-maker.
Controllo del ritmo
Tale strategia ha come obiettivo il ripristino del ritmo sinusale. All’interno di
tale categoria ricadono trattamenti quali:
• Cardioversione: può essere farmacologica, mediante somministrazione di farmaci antiaritmici, che costituiscono la prima scelta qualora si decida di percor-
1.4. La Fibrillazione Atriale (FA)
19
rere la strada del controllo del ritmo, oppure elettrica, attraverso la procedura
di defibrillazione. La cardioversione mira a resettare il ritmo del cuore, perché
questo riprenda a battere regolarmente immediatamente dopo la procedura;
Cardioversione farmacologica: comporta una relativa latenza di effetto,
cioè prevede che tra la somministrazione del farmaco e la scomparsa dell’aritmia intercorra un certo periodo di tempo. Pertanto, essa viene riservata
alle aritmie ben tollerate, o per la benignità dell’aritmia stessa, o per le buone
condizioni fisiche del paziente e prevede l’impiego di farmaci antiaritmici quali:
Flecainide: somministrata per via orale o endovenosa, ha una percentuale di cardioversione di una FA di recente insorgenza del 57-78% se somministrata per via endovenosa; è considerata un farmaco di prima scelta nel
trattamento di FA di insorgenza inferiore alle 48h in pazienti senza cardiopatia o con cardiopatia di lieve entità; non viene somministrata a pazienti con
sindrome di Brugada, sindrome del QT lungo, cardiopatia strutturale, disfunzione sinusale o blocco AV e blocchi di branca in quanto ha effetto inotropo
negativo;
Propafenone: somministrato per via orale o endovenosa, è in grado di
ripristinare il ritmo sinusale, rispettivamente, entro 2-6h e 1h. La percentuale
di successo varia, rispettivamente, dal 56% al 83% e dal 41% al 91%. Al
pari della Flecainide, ha effetto inotropo negativo e pertanto è controindicato
nei pazienti con cardiopatia strutturale, mentre è, invece, indicato per quei
pazienti senza cardiopatia rilevante e nei casi di FA insorta da meno di 48h;
Ibutilide: somministrato solo per via endovenosa, mostra percentuali
di successo nel confronto col placebo del 34-47%. Può anche essere utilizzato
nei pazienti per i quali il Propafenone non si è rivelato efficace o per i quali
sono insorte delle recidive aritmiche durante il trattamento con Propafenone e
Flecainide. È indicato nei casi di FA insorta di recente o comunque da meno
di 90 giorni. A differenza dei due farmaci precedenti, può essere utilizzato sui
pazienti con cardiopatia strutturale, ma non se ne consiglia la somministrazione
a pazienti con tratto QT allungato o con scompenso cardiaco;
Amiodarone: può essere somministrato sia oralmente che per via endovenosa e confrontato con altri farmaci antiaritmici non è più efficace e, anzi,
il suo effetto è ritardato. Tuttavia, a causa del suo scarso o nullo effetto isotropo negativo, ha il vantaggio di poter essere somministrato anche a pazienti
con cardiopatia strutturale, compresi i casi di insufficienza cardiaca. La somministrazione orale dell’Amiodarone riporta percentuali di successo basse e
riconversione tardiva [29], pertanto non è proponibile in casi di recente insorgenza (<48h), ma lo è nei casi di FA parossistica o persistente in pazienti
per i quali non è richiesta una rapida riconversione a ritmo sinusale, in luogo
del ricovero ospedaliero; la somministrazione per via endovenosa è considerata
terapia di seconda linea per il ripristino del ritmo sinusale in pazienti non car-
20
Introduzione
diopatici e FA di recente insorgenza, a causa della sua azione lenta a comparire
ed efficacia simile — se non inferiore — ad altri farmaci antiaritmici;
Vernakalant: è un nuovo farmaco relativamente atrio-selettivo che blocca molteplici correnti del sodio e del potassio, causando un prolungamento
del periodo refrattario effettivo atriale. Tre studi randomizzati (con confronto
verso placebo, con confronto con l’Amiodarone e in uno aperto di fase IV)
hanno rivelato che la percentuale di ripristino è stata di poco superiore al
50% entro 90 minuti dall’infusione in pazienti con eventi della durata al più
uguale a 7 giorni, con un tempo medio di conversione di 8–11 minuti. Si è
mostrato efficace nella conversione di pazienti con cardiopatia ischemica e solo
relativamente efficace in pazienti con insufficienza cardiaca. È controindicato
in pazienti con ipotensione arteriosa — in quanto nel 5–7% dei casi ha mostrato una transitoria riduzione della pressione arteriosa — e in pazienti con
QT lungo, mentre è indicato per i casi di cardiopatia strutturale. Rispetto
all’Amiodarone, si è dimostrato significativamente più efficace nel ripristinare
il ritmo sinusale entro 90 minuti. A differenza di altri agenti antiaritmici di
classe III (Amiodarone, Sotalolo, Ibutilide, Dronedarone e altri), il Vernakalant si rivela tanto più efficace quanto più il ritmo è accelerato, circostanza cui
gli altri agenti non sanno far fronte in maniera efficace;
Cardioversione elettrica: viene eseguita con l’ausilio di un dispositivo chiamato defibrillatore (si noti l’attinenza del nome con la patologia) che emette
una scarica elettrica di 3200W verso due piastre metalliche che vengono posizionate entrambe sul torace, oppure una sul torace e una lungo la schiena.
La scarica elettrica provoca la contrazione simultanea di tutte le cellule del
miocardio, con la speranza che le cellule del nodo SA siano le prime a ripolarizzarsi. Se ciò accade, il ritmo sinusale è ristabilito. Circa la metà dei pazienti
trattati sperimenta la recidiva entro un anno dal trattamento. In caso di insorgenza di recidiva, è necessario approntare un trattamento di profilassi della
stessa.
• Profilassi delle recidive: avviene anch’essa per via farmacologica, mediante somministrazione di farmaci antiaritmici o non antiaritmici (il cosiddetto trattamento up-stream), oppure per via non farmacologica, attraverso una
procedura detta di ablazione:
Farmaci antiaritmici: sono in grado di aumentare la percentuale di persistenza del ritmo sinusale a lungo termine, tuttavia le recidive aritmiche ad un
anno dal trattamento si osservano in circa il 30–60% dei pazienti trattati. Gli
antiaritmici agiscono modificando le proprietà elettriche del cuore, impedendo
cosı̀ le recidive aritmiche; in particolare, essi agiscono a livello delle membrane
cellulari, bloccando i canali ionici del calcio e/o del potassio e/o del sodio. In
questo modo, si rallenta la velocità di conduzione dell’impulso elettrico e si
allunga il tempo durante il quale le cellule non sono eccitabili, il periodo di refrattarietà, prima che sia trascorso il quale le cellule del miocardio atriale non
1.4. La Fibrillazione Atriale (FA)
21
possono subire una completa depolarizzazione, ma solo, eventualmente, una
parziale, che comunque non è sufficiente ad innescare una nuova contrazione.
I farmaci oggi più utilizzati sono:
– Flecainide: possiede un effetto vagolitico. Poiché ha indotto un aumento
di casi di morte improvvisa in pazienti con pregresso infarto acuto del
miocardio [30] e dati i suoi effetti isotropi e dromotropi negativi, se ne
sconsiglia la somministrazione in pazienti con cardiopatia ischemica, con
gravi turbe dell’eccitoconduzione e con disfunzione ventricolare sinistra,
mentre la si consiglia nei soggetti con nessuna o lieve cardiopatia nei quali
essa non appare responsabile di eventi proaritmici rilevanti.
– Sotalolo: possiede una doppia azione, antiaritmica e β-bloccante. È indicato in pazienti con cardiopatia ischemica. Presenta il vantaggio di
rallentare la frequenza ventricolare in caso di recidiva di FA e prolunga
l’intervallo QT, particolarmente in pazienti con cardiopatia grave o con
disfunzione sistolica.
– Propafenone: ha un’efficacia simile a quella del Sotalolo, essendo efficace nel 30-50% dei pazienti ad un anno dal trattamento. Al pari della
Flecainide, non è indicato in pazienti con cardiopatia ischemica, disfunzione ventricolare sinistra e gravi turbe dell’eccitoconduzione, mentre è
di prima scelta in soggetti con cardiopatia non significativa.
– Amiodarone: si è dimostrato superiore rispetto alla cura con placebo, al
Sotalolo e al Propafenone e pertanto è considerato il farmaco più efficace;
infatti, la sua percentuale di prevenzione delle recidive ad un anno dal
trattamento è del 70% [31, 29]. Il suo impiego pratico è fortemente limitato dall’insorgenza di effetti collaterali extracardiaci, che talora possono
vanificare i benefici ottenuti, pertanto esso è considerato come farmaco
di seconda linea in molte situazioni cliniche, a parte i casi di scompenso
cardiaco o grave cardiopatia e di infarto miocardico pregresso, per i quali
è, invece, farmaco di prima linea.
– Dronedarone: è un derivato dell’Amiodarone e, come questo, ha effetto
su molteplici canali ionici. In 2 trial gemelli, EURIDIS e ADONIS [32], il
Dronedarone ha mostrato una riduzione, rispetto al placebo, del 25% del
tempo di prima ricorrenza e della frequenza ventricolare media durante
gli episodi, risultato, quest’ultimo, confermato anche dallo studio ERATO
[33]. Dallo studio ATHENA [34] è emerso che il Dronedarone è associato
ad una riduzione del 24% del tasso di ospedalizzazione e mortalità cardiovascolare rispetto al placebo e ad una riduzione statisticamente rilevante
della mortalità aritmica. Un’analisi post-hoc dello stesso studio ha evidenziato una riduzione del 34% del rischio di ictus, nonostante il 90% dei
pazienti fosse già sotto cura antitrombotica. Il Dronedarone è controindicato in casi di scompenso cardiaco di recente insorgenza o peggioramento,
in quanto risultato associato ad un eccesso di mortalità rispetto alla cura
22
Introduzione
con placebo [35] tuttavia, un’analisi pos-hoc di ATHENA ha rivelato che
esso non è pericoloso in pazienti con scompenso cardiaco stabile e frazione
di eiezione ventricolare sinistra inferiore al 40%.
– Trattamento up-stream: negli ultimi anni sono stati presi in considerazione farmaci non antiaritmici, con l’intento di correggere il substrato alla
base della FA e prevenirne cosı̀ l’insorgenza e le recidive. Essi includono
gli inibitori dell’enzima di conversione dell’Angiotensina (ACE-inibitori)
e gli antagonisti recettoriali dell’Angiotensina II (ARB) o sartani, statine
e acidi grassi omega-3:
ACE-inibitori e ARB: è stato dimostrato come il rimodellamento
atriale e l’infiammazione aumentino i livelli di Angiotensina II nel cuore,
che a sua volta determina il sovraccarico di calcio e fibrosi atriale, due
condizioni che favoriscono i cambiamenti elettrofisiologici alla base della
FA. Sia gli ACE-inibitori che gli ARB agiscono direttamente sul sistema
renina-angiotensina (RAS). Il blocco del RAS da parte di questi farmaci
ha i presupposti per fermare la comparsa e la progressione della FA. Alcuni studi sperimentali hanno dimostrato che sia gli ACE-inibitori che gli
ARB sono in grado di prevenire il rimodellamento elettrico e meccanico
che si osserva nella FA, anche se i dati non sono univoci. Secondo varie
metanalisi di alcuni grandi trial randomizzati (TRACE, SOLVD e ValHeFT in pazienti con scompenso cardiaco e/o disfunzione ventricolare
sinistra; LIFE, HOPE e TRASCEND in pazienti con ipertensione arteriosa), ACE-inibitori e ARB hanno un effetto positivo nei pazienti con
scompenso cardiaco, mentre c’è del disaccordo circa i benefici apportati
ai pazienti con ipertensione arteriosa. Almeno nei pazienti con scompenso
cardiaco, quindi, i dati pubblicati sembrano avvalorare il ruolo di ACEinibitori e ARB nella prevenzione primaria della FA. Per quanto riguarda
la prevenzione delle recidive in pazienti con precedenti episodi dell’aritmia (prevenzione secondaria), invece, inizialmente alcuni studi prospettici
di piccole dimensioni basati sul trattamento con il solo ACE-inibitore o
sull’associazione di questo o dell’ARB con un trattamento antiaritmico
cronico con Amiodarone hanno mostrato una riduzione statisticamente
rilevante delle recidive di FA ma, successivamente, tre ampi studi prospettici randomizzati con ARB vs. placebo hanno invece mostrato la totale
inefficacia di questi farmaci nella prevenzione delle recidive di FA. Alla
luce di ciò, si può dire che ACE-inibitori e ARB possono modificare la
cardiopatia sottostante e ridurre l’incidenza di episodi di FA di nuova insorgenza (prevenzione primaria) quantomeno nei pazienti con scompenso
cardiaco e/o disfunzione ventricolare sinistra. Il loro uso appare, invece, poco giustificato nella prevenzione secondaria delle recidive aritmiche.
Resta tutta da approfondire la possibile efficacia clinica nella prevenzione della FA da parte degli antagonisti dell’Aldosterone, che hanno un
importante effetto antifibrotico.
1.4. La Fibrillazione Atriale (FA)
23
statine: oltre a ridurre la colesterolemia, hanno degli effetti pleiotropici che agiscono direttamente sul substrato della FA, quali un’azione
antiossidante e antinfiammatoria. In alcuni studi sperimentali, le statine
si sono dimostrate in grado di ridurre i processi infiammatori e fibrogenetici a livello atriale e di prevenire l’accorciamento dei periodi di refrattarietà e il rallentamento della velocità di conduzione degli impulsi elettrici
[59, 60], tuttavia, al momento, non vi sono dati a sufficienza che ne giustifichino l’impiego nella prevenzione secondaria della FA.
Durante il periodo post-operatorio, lo stress ossidativo e l’infiammazione
potrebbero giocare un ruolo-chiave nell’insorgenza della FA. Nei pazienti
che hanno subı̀to un’operazione chirurgica, le statine possono prevenire
la FA, perché modulano la risposta infiammatoria e lo stress ossidativo.
Le statine, come la Simvastatina e la Atorvastatina attenuano i processi
infiammatori e di formazione del tessuto fibroso e, cosa ancora più importante, prevengono l’accorciamento dei periodi refrattari e il rallentamento
della conduzione. Diversi studi retrospettivi e prospettici sull’efficacia clinica delle statine nella prevenzione primaria e secondaria [44, 45, 46] della
FA hanno mostrato una significativa riduzione dell’incidenza di episodi
post-operatori di FA in 200 pazienti con somministrazione di Atorvastatina vs. placebo. Anche Chen et al. [47] hanno evidenziato un beneficio
statisticamente rilevante delle statine nella prevenzione della FA in cardiochirurgia, mentre negli studi di Suleiman et al. e Rahimi et al. le
statine non si sono mostrate di particolare beneficio in situazioni cliniche
di ablazione atriale [48, 49]. Alle luce di tali studi, possiamo affermare che
certamente le statine apportano benefici in termini di risposta antinfiammatoria, pur tuttavia, al momento, non sembrano esserci dati sufficienti
che ne giustifichino l’impiego in ambito clinico.
acidi grassi omega-3 (n-3 PUFA): al pari delle statine, hanno un’azione antinfiammatoria e antiossidante. In alcuni studi sperimentali, gli
n-3 PUFA hanno mostrato di ridurre la formazione di collagene a livello
atriale, la vulnerabilità atriale e la durata degli episodi di FA [61, 62],
mentre un recente studio sperimentale sui cani non ha mostrato alcun
legame tra gli n-3 PUFA e la riduzione della vulnerabilità alla FA dopo l’instaurazione del danno miocardico [63]. Numerosi studi sono stati
effettuati per valutare l’efficacia degli acidi grassi omega-3 nella prevenzione della FA, tuttavia i risultati di ciascuno studio non sono poi stati
confermati in studi successivi. Pertanto, gli n-3 PUFA hanno una classe
di raccomandazione IIb (utilità ed efficacia meno ben stabilite) e livello
di evidenza B (dati derivati da un singolo studio clinico randomizzato o
da studi non randomizzati di grandi dimensioni) per quanto riguarda la
prevenzione primaria e classe di raccomandazione IIb e livello di evidenza
A per la prevenzione secondaria [7].
Ablazione: è una procedura che consiste nella distruzione delle zone del
24
Introduzione
cuore dove nasce e si sostiene l’aritmia, cosicché il formando tessuto cicatriziale (non conduttivo) agisca da isolante tra la zona in cui gli impulsi ectopici
hanno origine e il resto del cuore. L’ablazione non è solitamente la prima
opzione terapeutica, dati i molteplici rischi associati, pertanto è eseguita solo
su pazienti refrattari alle cure farmacologicheL’ablazione può essere di 2 tipi:
transcatetere o chirurgica:
Ablazione RF transcatetere: diverse sonde vengono inserite dall’accesso
femorale all’altezza dell’inguine e diretti, attraverso la vena cava inferiore, fino
al cuore; i cateteri arrivano nell’atrio destro e poi, dopo una puntura attraverso il setto interatriale (puntura transettale), due di questi vengono sospinti
nell’atrio sinistro, fino ad arrivare in prossimità delle vene polmonari. A questo punto, il primo catetere viene fatto aderire alla bocca di ciascuna delle
vene polmonari in modo che intercetti gli impulsi elettrici, isolando la parte
restante del cuore, mentre il secondo va a bruciare, mediante radiofrequenza
(RF), l’area attorno allo sbocco delle vene. In questo modo, l’atrio sinistro
viene isolato elettricamente dalle vene polmonari, area di nascita degli impulsi
che generano la fibrillazione. In alcuni casi, specie quando la fibrillazione è
particolarmente sostenuta, è necessario intervenire anche in altri punti degli
atri. Ciò rende l’intervento particolarmente lungo e delicato, sebbene la percentuale di successo di tale procedura sia abbastanza elevata (80%, [23]); in
ogni caso, le più comuni complicanze riportate sono relative alla stenosi delle
vene polmonari, al tamponamento cardiaco e alla paralisi del nervo frenico.
Tale procedura è solitamente eseguita nel caso di pazienti con età inferiore ai
60 anni, che accusano sintomi e nei casi in cui il trattamento farmacologico
non abbia sortito effetti positivi;
Ablazione chirurgica: nel 1987, presso il St. Louis’ Barnes Hospital (oggi
Barnes-Jewish Hospital) di St. Louis, Missouri, il Dr. James L. Cox eseguiva
un intervento in sternotomia a cuore fermo e bypass cardio-polmonare (CPB)
con isolamento delle 4 vene polmonari, amputazione dell’appendice atriale sinistra e creazione di un complesso percorso di incisioni nel tessuto cardiaco
con immediata suturazione. Ad avvenuta cicatrizzazione delle ferite, il tessuto
cicatriziale formatosi, non conduttivo, guidava gli impulsi attraverso l’intero
muscolo cardiaco, come in un labirinto. Proprio per tale caratteristica, tale
procedura prese il nome di (cut-and-sew) Cox-Maze procedure [51], con riferimento anche al suo inventore. Tale procedura si rivelò però molto complessa
da mettere in pratica nella sua formulazione originaria, a causa delle numerose
cicatrici da dover effettuare con molta precisione e rimase cosı̀ appannaggio di
pochissimi centri specializzati che fino ai giorni nostri l’hanno eseguita effettivamente, nonostante una percentuale di successo superiore al 90%. Da allora,
numerosi team in tutto il mondo si sono attivati per semplificare la procedura
nel numero e tipo di lesioni. Oggigiorno, dopo 2 aggiornamenti della procedura
cui ha preso parte anche il suo eponimo (Cox-Maze III [52]) e una evoluzione
ad opera del Dr. Ralph J. Damiano Jr. (Cox-Maze IV [50]), le incisioni col
1.4. La Fibrillazione Atriale (FA)
25
bisturi sono state sostituite da linee di ablazione effettuate con varie sorgenti di energia: radiofrequenza, criotermia, microonde e laser (successivamente
escluse dalla pratica) e ultrasuoni HF; inoltre, in luogo di un catetere unipolare, viene usato un catetere bipolare che ha i non trascurabili vantaggi di
creare lesioni completamente transmurali, che si traducono in un isolamento
più efficace, e di ridurre drasticamente — fino a 8 secondi, contro i 180 di un
device unipolare — il tempo per ciascuna singola ablazione. Sfortunatamente,
gli strumenti che utilizzavano molte delle nuove fonti di energia non si sono
mostrati in grado di riprodurre delle lesioni transmurali affidabili e facilmente
riproducibili da altri. L’unico strumento che negli studi di laboratorio effettuati dal Dr. Ralph J. Damiano Jr. alla Washington University School of
Medicine ha mostrato queste caratteristiche è stata la pinza da ablazione a
radiofrequenza bipolare, che possiede degli elettrodi integrati nelle morse ed è
oggi lo strumento di riferimento per tale procedura.
Pur con i suoi inevitabili effetti collaterali, la Cox-Maze IV elimina la dipendenza da anticoagulanti, riduce i tempi di intervento da una media di 91 minuti
richiesti dall’intervento a cuore aperto ad una di 41 quando eseguita in minitoracotomia, mantiene una percentuale di efficacia superiore al 90% come nella
Cox-Maze originale e riduce di molto i tempi di conversione del ritmo sinusale,
poiché non bisogna attendere la cicatrizzazione dei tessuti. Purtroppo, richiede
comunque un bypass cardio-polmonare e, nonostante le lesioni relative all’atrio
destro possano essere eseguite con il cuore ancora in funzione, per le lesioni
sull’atrio sinistro è richiesta una cardioplegia (arresto cardiaco indotto) [57].
Poiché per molti pazienti non ha senso l’intervento a cuore aperto, come nel
caso dei pazienti affetti da PAF o FA isolata e nessuna cardiopatia associata,
sono state sviluppate diverse tecniche nel corso degli anni, anche con l’intento
di rendere la procedura meno invasiva. La Wolf Mini-Maze — altra evoluzione
della Cox-Maze III — introdotta dal Dr. Randall K. Wolf e altri [56], utilizza
la radiofrequenza come fonte di energia per l’ablazione e non richiede più né un
CPB, poiché le linee di ablazione vengono eseguite sull’epicardio piuttosto che
sull’endocardio come avveniva precedentemente, né una cardioplegia, né una
sternotomia, sostituita da una toracotomia mininvasiva via endoscopica con
accesso talora bilaterale, con una incisione da 5cm e due da 1cm per ciascun
lato, talora unilaterale. Oggigiorno, l’intervento a cuore aperto, data la sua
invasività, viene considerato solo in presenza di altre cardiopatie associate per
cui è richiesto un intervento chirurgico — ad esempio, sostituzione valvolare
o bypass aorto-coronarico — in misura cautelativa in quanto, si è detto, gli
interventi chirurgici costituiscono un fattore di rischio indipendente per lo sviluppo di FA con prima insorgenza post-operatoria. Purtroppo, la Wolf-Maze
non tratta l’atrio sinistro, il ché riduce l’applicabilità della procedura anche
a pazienti con un’aritmia atriale sostenuta e prevede ancora un significativo
numero di incisioni, come si evince dalla figura 1.6 (linee tratteggiate nell’immagine a destra). Attualmente, alla Ohio State University viene eseguita dal
26
Introduzione
Figura 1.6: A sinistra: la Maze procedure originale.
procedure.
A destra: la Wolf Maze
Dr. John H. Sirak la Five-Box Thoracoscopic Maze [58], che non richiede né
una sternotomia né una cardioplegia e può essere considerata una procedura
davvero minimamente invasiva: vengono eseguite 4 incisioni da 1cm da ciascun
lato del torace e (1) viene eseguito l’isolamento delle vene polmonari con la
pinza da ablazione bipolare, (2) vengono identificate le fibre nervose dell’ANS
sulla superficie epicardica del cuore che causano un accorciamento del periodo di refrattarietà, dopodiché si procede alla loro ablazione, (3) si eseguono
lesioni sul tetto e alla base dell’atrio sinistro con una connessione separata ,
(4) si effettua l’isolamento della vena cava superiore e del seno coronarico con
la pinza da ablazione bipolare e, infine, (5) viene chiusa l’auricola sinistra la
sinistra con una graffettatrice endoscopica.
È bene precisare che tutte queste procedure hanno in comune risultati molto
promettenti, che tuttavia non sono supportati da dati a lungo termine poiché,
data la loro relativa giovane età, non sono ancora stati effettuati degli studi
randomizzati che certifichino il successo a lungo termine rispetto alla terapia
farmacologica. Nel frattempo che ciò accada, si tenga presente che nessuna delle terapie descritte costituisce una cura a lungo termine efficace al 100% e che
tutte hanno rischi ed effetti collaterali annessi (infezioni, danneggiamento del
cuore e/o delle strutture anatomiche adiacenti) che possono portare, in taluni
casi, perfino alla morte del paziente. Indubbiamente, fare in modo che questo
non arrivi al punto di necessitare di un intervento chirurgico, individuando
tempestivamente l’insorgenza della malattia, costituirebbe un importante step
nella lotta alla FA.
1.4. La Fibrillazione Atriale (FA)
27
Crioablazione: sia nel caso dell’ablazione transcatetere che di quella chirurgica è possibile ricorrere ad una tecnica relativamente recente eseguita per
la prima volta nel 2004 da Krebs e colleghi presso il Miami Valley Hospital di
Dayton, Ohio, USA, nota come crioablazione. Essa consiste nella distruzione o temporanea inattivazione delle cellule mediante il freddo, piuttosto che
mediante il calore generato dalla radiofrequenza. La crioablazione è eseguita
mediante un palloncino (cryoballoon) di 20–27mm di diametro in cui scorre un
liquido refrigerante (solitamente ossido di diazoto, N2 O), che viene immesso
nell’atrio sinistro con la procedura usuale di accesso femorale. Il palloncino
viene gonfiato all’interno dell’atrio e viene fatto aderire allo sbocco delle vene
polmonari ad una temperatura tra i -40 e i -70°C per qualche minuto ciascuna.
Il liquido refrigerante all’interno del palloncino sottrae calore alle cellule causandone la cristallizzazione ed esse smettono di rispondere agli impulsi ectopici
a livello delle vene polmonari. Si crea, cosı̀, una lesione circonferenziale che
blocca la propagazione degli impulsi. Tale procedura consente di ripristinare
il ritmo sinusale e annovera tra i vantaggi quello di essere reversibile fintantoché la temperatura è mantenuta al di sopra dei -73°C, nel senso che, fino
al raggiungimento di tale soglia, le cellule possono essere “ridestate” fornendo
loro nuovamente del calore; ciò è particolarmente utile nel caso si dovesse constatare che in un dato paziente la crioablazione non stia portando ai risultati
desiderati o nei casi di lesioni iatrogene, potendo cosı̀ contare sulla possibilità di roll-back dell’operazione; in caso di successo, invece, essa può essere
resa definitiva. Un altro vantaggio è che tale procedura si è dimostrata molto
più efficace nella prevenzione della stenosi delle vene polmonari rispetto alla
radiofrequenza. Inoltre, non essendo una procedura dolorosa, non richiede di
sottoporre il paziente a potenti sedativi, come nel caso della radiofrequenza, dimezza i tempi di intervento e consente un più rapido recupero post-operatorio,
rendendosi particolarmente indicata per pazienti anziani. Se effettuata precocemente, ovvero agli esordi della FA, la crioablazione è in grado di prevenire i
danni che frequenti episodi di fibrillazione provocano col tempo ai tessuti del
cuore, rendendo più difficile il recupero del paziente. Essa ha maggiore probabilità di successo se il meccanismo elettrofisiologico della fibrillazione è legato
essenzialmente a foci localizzati nelle vene polmonari (tipico della PAF). Al
contrario, le probabilità si riducono se esso è legato a foci francamente antrali,
per cui il semplice isolamento delle vene polmonari può non essere sufficiente.
Per tali ragioni, traggono particolare beneficio dalla procedura di crioablazione i pazienti affetti da PAF, ancor più se anziani. Anche in questo caso,
comunque, non mancano i risvolti negativi. Tra i più comuni si annoverano:
la lesione o paralisi del nervo frenico destro nell’ambito dell’isolamento della
vena polmonare superiore destra (complicanza che può essere agevolmente evitata stimolando il nervo frenico, controllando manualmente la contrazione del
diaframma durante l’erogazione) e una maggior incidenza di recidive a 1 anno
dal trattamento rispetto alla stessa procedura eseguita con RF.
28
Introduzione
Controllo della frequenza
La risposta ventricolare sotto FA è affetta dal tono neurovegetativo e dalle caratteristiche elettrofisiologiche del sistema di conduzione elettrica del cuore. Le
procedure di controllo della frequenza puntano a rallentare la frequenza cardiaca,
sebbene le cause sottostanti la FA permangano. La comunità scientifica si è a lungo
interrogata su quale fosse la frequenza ottimale dei ventricoli e attualmente essa è ritenuta essere di 60–80bpm a riposo e 110–130bpm durante esercizio fisico moderato.
Il controllo del raggiungimento della frequenza target va monitorato periodicamente
mediante registrazioni Holter di 24h e test della camminata della durata di 6 minuti.
Le strategie di controllo della frequenza prevedono:
• Farmaci depressori del nodo AV : nel paragrafo 1.4.1 si è accennato all’azione di alcuni farmaci direttamente sul nervo vago. A livello toracico, il nervo
vago si dirama nel nervo vago destro e nel nervo vago sinistro. Il nervo vago
destro innerva il nodo SA, mentre il nervo vago sinistro innerva il nodo AV.
Essendo parte del sistema nervoso parasimpatico, la sua stimolazione provoca
una diminuzione del battito cardiaco. Alcuni composti che stimolano il nervo
vago e che provocano tale effetto parasimpaticomimetico sono, ad esempio,
l’Acetilcolina — rilasciata direttamente dal nervo vago — e la Digossina, che
hanno effetto cronotropo negativo, ovvero rallentano il ritmo cardiaco.
In condizioni di riposo, il nodo SA esibisce un’automaticità intrinseca di 100110 potenziali d’azione (battiti) al minuto. Questo ritmo intrinseco è influenzato dai nervi del sistema nervoso autonomo, con una predominanza dell’influenza vagale (parasimpatica) su quella simpatica. Il tono vagale riduce il ritmo di
contrazione a riposo agli usuali 60-80bpm. Se si denervasse sperimentalmente il nodo SA dalle fibre terminali del nervo vago, si noterebbe un notevole
incremento del ritmo di attivazione del nodo stesso, qualora il ritmo a riposo
fosse al di sotto dei 100bpm. Lo stesso effetto si ottiene mediante somministrazione di farmaci come l’Atropina, che inibisce l’attività di attenuazione del
ritmo cardiaco operata dal nervo vagale sul nodo del seno, incrementandone
la frequenza di attivazione. Altri composti con effetto cronotropo negativo
(cioè sulla frequenza, rallentandola) ed effetto inotropo positivo (cioè sulla
forza di contrazione, aumentandola) sono alcuni alcaloidi, come la Chinidina,
e i digitalici, come la Digossina, questi ultimi veri e propri veleni che, come
tali, necessitano di una particolare attenzione nelle dosi di somministrazione,
specie in soggetti con scompenso cardiaco preesistente. Tali sostanze, sebbene
teoricamente efficaci nell’abbattimento del ritmo di contrazione ventricolare
— poiché rallentano la velocità di conduzione degli impulsi diretti al nodo AV
ed aumentano il periodo di refrattarietà — mostrano una mortalità molto più
elevata dei β-bloccanti e dei calcio-antagonisti, che attualmente costituiscono
la terapia di prima linea, pertanto non sono impiegati in ambito clinico.
I β-bloccanti (come il Sotalolo, il Carvedilolo, il Bisoprololo e altri), fino
agli anni novanta erano considerati causa di peggioramento nelle condizioni di
1.4. La Fibrillazione Atriale (FA)
29
salute di pazienti affetti da insufficienza cardiaca ma poi, in seguito a nuovi
studi [10, 11], hanno subı̀to un processo di riabilitazione, poiché si sono mostrati in grado di rallentare il ritmo cardiaco e perciò ridurre la pressione del
sangue in uscita dai ventricoli, esponendo il cuore ad un carico di lavoro assai inferiore e portando particolare beneficio ai pazienti affetti da scompenso
cardiaco. Un’altra categoria di depressori è costituita dai calcio-antagonisti
non-diidropiridinici, ad esempio quelli della classe delle fenilalchilamine, come il Verapamil o delle Benzotiazepine, come il Diltiazem, che agiscono sulle
resistenze periferiche a concentrazioni che provocano il blocco dei canali lenti
del calcio di tipo L (ovvero voltaggio dipendenti), con riduzione del ritmo, velocità di conduzione AV e inotropismo. Lo stretto legame tra gli ioni calcio e
la contrazione del cuore è noto sin dal 1880, quando il fisiologo Sidney Ringer
notò che un cuore di rana isolato, immesso in una soluzione acquosa e privato degli ioni calcio, smetteva immediatamente di battere. In effetti, gli ioni
calcio sono indispensabili nel meccanismo di contrazione muscolare in quanto
si legano alla Troponina, il complesso Troponina-Tropomiosina si modifica e
permette alle proteine di Actina di legarsi alle teste di Miosina, mediante un’azione di scorrimento. Inibendo il passaggio degli ioni calcio all’interno della
cellula
Tutte queste categorie di farmaci mostrano un’efficacia solo parziale, poiché la
FA si manifesta nuovamente in circa la metà dei pazienti entro un anno dal
trattamento. Inoltre, possono avere effetti collaterali rilevanti e in alcuni casi
rivelarsi più nocivi che utili, portando ad aritmie ben più gravi della fibrillazione atriale, come la fibrillazione ventricolare, oppure rallentare troppo il cuore.
Quest’eventualità costituisce un serio problema nel caso di PAF: il paziente
potrebbe riscontrare in un dato momento un attacco di FA, per controllare il
quale vengono somministrati degli farmaci depressori, ma prima che l’effetto
dei farmaci svanisca, l’evento di FA termina spontaneamente; tuttavia, il ritmo
cardiaco continua a diminuire sotto l’effetto dei medicinali. Si possono, cioè,
avere casi di sindrome bradi-tachicardica, una affezione che causa una marcata
oscillazione del ritmo cardiaco, che diventa difficile da controllare. Proprio per
scongiurare tale evenienza, in combinazione con la somministrazione di farmaci
depressori, si è soliti ricorrere al pace-maker, un piccolo dispositivo elettronico
impiantato nel torace del paziente che invia al cuore un leggero shock elettrico
ogniqualvolta il ritmo cardiaco dovesse scendere al di sotto di una certa soglia.
In tal modo, il ritmo cardiaco si trova ad essere limitato, dall’alto dall’azione
dei farmaci (che scongiurano la tachicardia) e dal basso dal pace-maker (che
previene la bradicardia).
• Ablazione transcatetere della giunzione atrioventricolare e impianto di pacemaker: l’ablazione distrugge il nodo AV, impedendo cosı̀ il passaggio degli
impulsi dagli atri ai ventricoli; il pace-maker impiantato diventa la fonte alternativa di energia che fornisce elettricità ai ventricoli, permettendo di farli
funzionare anche in assenza degli impulsi naturali.
30
Introduzione
Qualunque sia il trattamento scelto, è necessario che questo sia supportato da una
terapia antritrombotica. Come si è visto nel paragrafo 1.4.2, infatti, la FA aumenta
a dismisura la probabilità che si formino dei trombi nelle camere superiori del cuore
e che dei frammenti vi si stacchino, finendo per occludere qualche vaso cerebrale
con conseguente ictus ischemico. Per evitare tutto ciò, è necessario assumere dei
farmaci antiaggreganti piastrinici (Aspirina) o anticoagulanti orali (Varfarin e, di
più recente introduzione e maggior impiego, Apixaban, Dabigatran, Rivaroxaban ed
Endoxaban). I primi sono prescritti a pazienti con rischio trombo-embolico basso,
i secondi a pazienti con rischio trombo-embolico medio-alto. Uno studio autoptico
condotto da Di Biase et al. [4] su 932 pazienti candidati all’ablazione transcatetere
con FA refrattaria ai farmaci ha mostrato come il 90% dei trombi che causano
ictus nei pazienti con FA risieda all’interno di una piccola appendice che si protrude
dall’atrio sinistro, l’auricola sinistra. Per pazienti con FA permanente refrattaria al
trattamento farmacologico o controindicazione all’anticoagulante e rischio tromboembolico medio-alto, esiste la possibilità di chiusura percutanea dell’auricola sinistra.
1.4.9
Aspetti economici
Le statistiche di seguito riportate fanno tutte riferimento all’anno 2008.
In uno studio rilasciato dalla multinazionale PricewaterhouseCoopers è emerso che,
tra il 2008 e il 2009, il sistema sanitario australiano ha sostenuto una spesa di $874
milioni per la cura di pazienti affetti da FA, $439 milioni dei quali per la cura delle
complicanze (ictus e scompenso cardiaco) e la restante parte per la FA di per sé.
Della spesa complessiva, $74,5 milioni sono legati ai medicinali (antiaritmici, anticoagulanti, etc.), con un’incidenza sul totale dell’8,5%, mentre circa $380 milioni
sono direttamente legati all’ospedalizzazione dei pazienti, con un’incidenza di oltre
il 43% sul totale.
In Europa, lo studio Euro Heart Survey ha rivelato che il costo medio per paziente
in Grecia, Italia, Polonia, Spagna e Olanda è stato, rispettivamente, di 1.363, 5.252,
2.322, 6.360 e 6.445 euro. La fetta più importante della spesa complessiva si è rivelata, ancora una volta, l’ospedalizzazione dei pazienti, con un’incidenza media di
circa il 70%. In Italia, la spesa è stata di 3 miliardi e 286 milioni di euro, contro
1 miliardo e 545 milioni per la Spagna, 554 milioni per l’Olanda, 526 milioni per
la Polonia e 272 milioni per la Grecia. Tale differenza è riconducibile alla maggior
durata media della degenza ospedaliera in Italia rispetto agli altri paesi (4 giorni)
[27].
Per quanto riguarda gli Stati Uniti, Lee et al. [21] hanno stimato che il sistema
sanitario nazionale abbia sostenuto una spesa di $15,7 miliardi per la sola ospedalizzazione di pazienti affetti da FA.
In conclusione, tenendo conto che:
a) tali stime fanno riferimento unicamente a casi noti, ovvero casi di pazienti con
FA sintomatica, che costituiscono la stragrande minoranza dei casi di FA,
1.5. Contesto e motivazioni
31
b) pazienti con una storia clinica di FA sintomatica non hanno la garanzia che futuri
episodi saranno sintomatici,
c) tali stime fanno riferimento ormai a qualche anno fa,
d) la FA è una malattia tipica dell’età avanzata
e) e che l’aspettativa di vita è in continuo aumento, grazie ai progressi in campo
medico–scientifico,
non viene difficile immaginare come tali cifre siano destinate inevitabilmente a salire. I pazienti affetti da FA, dunque, richiedono un utilizzo massiccio delle risorse sanitarie: accessi al Pronto Soccorso, ricoveri ospedalieri, esami di laboratorio,
somministrazione di farmaci e procedure interventistiche. A tali costi vanno, poi,
aggiunti i costi derivanti dalla gestione delle complicanze di tipo cerebro-vascolare.
Nel difficile contesto economico attuale, la previsione dell’insorgenza della FA è
una strada che non solo non ci si può più permettere di ignorare — dati gli indiscutibili vantaggi sull’aumento della qualità della vita e sull’ingente risparmio di denaro
pubblico che ne conseguirebbero — ma, anzi, è categorico farlo, perché disponiamo
di mezzi economici ed efficaci che consentono il cambiamento già nell’ambito dell’attuale situazione organizzativa. Non va dimenticato, infatti, che la disponibilità
di farmaci equivalenti, con costi molto contenuti, rende estremamente favorevole
il rapporto costo/efficacia degli interventi preventivi rispetto agli interventi postinsorgenza; nell’ottica della medicina generale, poi, le molecole a brevetto scaduto
rappresentano già la gran parte dei farmaci necessari e, col passare del tempo, ne
costituiranno la quasi totalità.
1.5
Contesto e motivazioni
L’avvento delle tecniche di ripristino del ritmo sinusale introdotte nel paragrafo
1.4.8 spinge, parallelamente, verso lo sviluppo di predittori accurati per tali aritmie,
con particolare enfasi sulla Fibrillazione Atriale Parossistica (PAF); il motivo per cui
tanta attenzione è riservata a tale classe di FA è che è noto che la percentuale di ripristino del ritmo sinusale è in stretto rapporto con la durata dell’aritmia e, pertanto,
l’efficacia dei farmaci è molto elevata se essi sono impiegati entro 48h dall’insorgenza
dei primi sintomi, mentre già dopo 48h la loro efficacia diminuisce progressivamente. Si rende pertanto necessario un intervento tempestivo per scongiurare episodi
ripetuti nel tempo e, nella peggiore delle ipotesi, la cronicizzazione della patologia.
Infatti, uno studio giapponese [54] ha mostrato come su 234 pazienti affetti da FA,
94 pazienti (40%) erano precedentemente affetti da PAF e che l’avvento della FA in
maniera sostenuta è avvenuto nel giro di un anno in circa 1/4 dei pazienti. Pertanto,
il legame tra tempo e peggioramento della condizione clinica dei pazienti affetti da
PAF appare innegabile. Allora, lo sviluppo di predittori accurati per l’insorgenza
di forme acute di PAF aprono la strada ai trattamenti di stabilizzazione elettrica
precedentemente descritti
32
Introduzione
Nel presente lavoro ci si pone 2 obiettivi: analizzare gli elettrocardiogrammi di pazienti che all’atto dello screening non mostrano i tratti tipici della PAF per (1)
separare i soggetti a rischio insorgenza di PAF da quelli non a rischio e (2) predire
l’insorgenza a breve termine di episodi di PAF nei soggetti a rischio.
Il problema è ben noto in letteratura e, a tal proposito, varie tecniche sono state
sperimentate in passato, senza però riscuotere molto successo: ECG a 12 derivazioni, analisi della morfologia delle onde P, dinamica degli intervalli RR, atrial ectopy
(?). Gli approcci più efficaci si basano sull’analisi dell’incidenza dei complessi atriali
prematuri (PACs) e sulla variabilità delle onde P. Nel 2001, ad esempio, il gruppo
guidato da Schreier ha ottenuto una percentuale di successo dell’82% nell’obiettivo
(1) e una del 79% nell’obiettivo (2). Tuttavia, dei predittori non invasivi con elevata
sensitività e specificità non sono stati ancora determinati o indipendentemente validati. Dati i recenti sviluppi nel campo dell’elettrofisiologia clinica, uno strumento di
previsione che permetta l’individuazione di eventi imminenti di FA potrebbe avere
importanti ramificazioni terapeutiche.
Nel presente lavoro, si vuole approcciare il problema sperimentando la tecnica della
Singular Spectrum Analysis (SSA). Tale tecnica è relativamente nuova: essa
combina elementi della statistica e della geometria multivariata, della teoria dei segnali, dei sistemi dinamici e della analisi classica di serie storiche ed è già stata
applicata con successo in ambiti quali la climatologia, l’econometria, le scienze marine, la geofisica, l’ingegneria e, appunto, la medicina. Tuttavia, l’utilizzo di tale
tecnica per la previsione dei casi di insorgenza di PAF appare come un elemento di
novità assoluta in letteratura. L’obiettivo è di migliorare i risultati precedentemente
ottenuti con altre tecniche di previsione.
1.6
Storie di Fibrillazione Atriale
Si riportano, di seguito, alcune testimonianze1 di pazienti affetti da FA, dalle
quali si evincono le speranze e le paure che nutre chi e affetto da FA e il profondo
cambiamento dello stile di vita cui si viene sottoposti:
I am 63, from the UK and temporarily living in Johannesburg. In
Feb. 2012, my GP noticed my irregular heartbeat during a check-up and
advised I see a cardiologist. I was put on a lot of meds but still get AF on
a weekly basis. After getting further advice I am now on anticoagulation,
so feel a lot safer. Hoping to try ablation procedure. I feel very lucky as
my story could have been very different. More information should be out
there about AF. I had no idea I had it and had been told palpitations
were nothing to worry about.
— Trish, Johannesburg, Sudafrica, 06/12/2012.
1
Fonte: http://www.signagainststroke.com/it/voices
1.6. Storie di Fibrillazione Atriale
33
I was diagnosed with AF 6 years ago. Every time I stood up my heart
would start beating really fast, it doesn’t last very long, sometimes just
30 seconds, but my daughter said see your GP2 and so I did. I want
to encourage you to do the same: if you feel your heart beating really
fast ask your GP for an ECG, don’t take no for an answer. My dad had
several strokes and became severally disabled.
— Christine, York, Regno Unito, 31/10/2012.
I am a 41 year old athlete. I was diagnosed with paroxysmal vagal AF 15 months ago. It has been pure hell, my AF comes and goes
from once every two months to every night. I have tried three different
types treatment. Nothing. I have scheduled a radiofrequency catheter
ablation. I hope this will get my life back to me.
— Tommy, < N/A >, Stati Uniti, 24/09/2012.
June, 2007 I had just sat down in the kitchen and got very dizzy,
almost passed out. It felt like a dream in slow motion, I could not hear
voices, I slid to the floor and my son held me. The ambulance was there
in 4 minutes, luckily. I lost my ability to speak, so I had speech lessons
for a year and with the help of my family I learned to speak again. I’ve
had AF for 7 years before my stroke, but I forgot my meds during a
small vacation, hence the stroke. I am lucky to be alive. Eight months
ago, I was fitted with a Pacemaker. I continued to run, lost 40 pounds,
feel so much better and my goal is lose 30 pounds more and run a half
marathon. I feel great and I thank my family, friends and all the medical
staff involved in my care.
— Dan, Hamilton, Canada, 31/10/2012.
I am now in my 70’s, hard to believe. I have been a rehab nurse
and geriatric case manager and occasionally work. In the last 3 years
I have had several bouts of AF. I do feel it when I am in AF. I feel
like I have butterflies in my chest. I have no pain. I have had to be
cardioverted twice and the other times I have converted on my own. I
am now scheduled for Ablation the first of August. I have met several
people who have had the procedure and it has been successful. I too,
am hoping and praying mine will go as well. It is amazing how many
younger people also have this problem.
— Marge, Port Ludlow, Stati Uniti, 15/07/2013.
2
GP: General Practitioner (Medico di base)
34
Introduzione
I am so thankful for the advancement of medicine and the knowledge
of our doctors. My grandmother and father were not as fortunate as I.
They both lost their (young) lives as a result of AF and stroke. Thankfully, I have doctors who are making strides to find ways to live with
and tolerate AF. My prayer is that this condition can be cured and corrected for our future generations. In one week I shall have a pacemaker
implanted to help my heart rate, due to the AF. For over eight years I
have worked closely with my cardiologist to keep anticoagulation levels
therapeutic. And even with that, I did suffer a stroke. I was very blessed
to receive the best of care, and really don’t have any deficits. However,
this has affected my lifestyle. Anxiety and forgetfulness are just a few of
the issues. Praying for happier times with a pacemaker.
— Renee, Bowling Green, Stati Uniti, 04/02/2013.
1.7
Conclusioni
Questo primo capitolo si è aperto con la descrizione dell’anatomia (paragrafo
1.1) e dell’elettrofisiologia (1.2) del muscolo cardiaco. Nel paragrafo 1.3 si è descritta la struttura di un elettrocardiogramma, dopodiché si è parlato ampiamente
della FA. Ciò ha gettato le basi per una trattazione coerente e pragmatica dell’argomento nel prosieguo dei capitoli. Nel paragrafo 1.5 si sono analizzati il contesto
– inquadrando il problema che ci si propone di affrontare ed, auspicabilmente, risolvere – e le motivazioni che giustificano la trattazione del presente lavoro, ovvero
di quali pecche soffrono le soluzioni attualmente esistenti in merito alla predizione
dell’insorgenza di Fibrillazione Atriale Parossistica (PAF). Nel paragrafo 1.6 si è
passata in rassegna la letteratura esistente sull’argomento. Infine, nel paragrafo 1.7
sono state presentate alcune testimonianze di pazienti affetti da FA, con l’intento
di mostrare il lato umano della patologia: è bene ricordare, infatti, che, come per
tutte le patologie, il focus deve essere prima di tutto il paziente e la sua vita, con
tutte le paure, le speranze, le battaglie, le sconfitte e a volte anche le vittorie che
la caratterizzano. È dovere della scienza medica donare sempre una speranza al
paziente, che non sia però una vana illusione, cioè abbia un reale fondamento nelle pratiche e negli strumenti di supporto alla terapia. Obiettivo del presente lavoro
è immettere anche solo una goccia nell’oceano della speranza di chi è affetto da PAF.
1.7. Conclusioni
35
Bibliografia
[1] Rajendra Acharya U, Jasjit S. Suri, Jos A.E. Spaan and S.M. Krishnan,
Advances in Cardiac Signal Processing. Springer, 2007. ISBN:10 3-540-36674-1.
[2] Go AS, Hylek EM, Philiphs KA, Chang Y, Henault LE, Selby JV, Singer DE;
(2001). Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and
Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 285(18):2370-2375.
[3] GB Moody, AL Goldberger, S McClennen, SP Swiryn; (2001). Predicting
the Onset of Paroxysmal Atrial Fibrillation: The Computers in Cardiology
Challenge 2001. Computers in Cardiology 2001; 28:113-116.
[4] Di Biase L, Santangeli P, Anselmino M, et al; (2012). Does the left atrial appendage morphology correlate with the risk of stroke in patients with atrial
fibrillation? JACC 60:531-538. DOI:10.1016/j.jacc.2012.04.032.
[5] Jay Chen, Ravi Mandapati, Omer Berenfeld, Allan C Skanes, Richard A Gray,
José Jalife; (2000). Dynamics of wavelets and their role in atrial fibrillation in
the isolated sheep heart. Cardiovasc. Res. 48(2):220-232. DOI:10.1016/S00086363(00)00177-2.
[6] Benjamin EJ, Levy D, Vaziri SM, D’Agostino RB, Belanger AJ, Wolf PA;
(1994). Independent Risk Factors for Atrial Fibrillation in a PopulationBased Cohort: The Framingham Heart Study. JAMA 271(11):840-844.
DOI:10.1001/jama.
[7] Raviele A, Disertori M, Alboni P, Bertaglia E, Botto G, Brignole M, Cappato
R, Capucci A, Del Greco M, De Ponti R, Di Biase M, Di Pasquale G, Gulizia
M, Lombardi F, Themistoclakis S, Tritto M; (2013). Linee guida AIAC per
la gestione e il trattamento della fibrillazione atriale. Aggiornamento 2013. G.
Ital. Cardiol. 14(3):215-240.
[8] Prof Stanley Nattel MD, Prof Lionel H Opie FRCP; (2006). Controversies in atrial fibrillation. The Lancet 367 9506:262-272. DOI:10.1016/S01406736(06)68037-9.
36
BIBLIOGRAFIA
37
[9] Heeringa J, van der Kuip DA, Hofman A, Kors JA, van Herpen G, Stricker BH,
Stijnen T, Lip GY, Witteman JC; (2006). Prevalence, incidence and lifetime
risk of atrial fibrillation: the Rotterdam study. Eur. Heart J. 27(8):949-953.
DOI:10.1093/eurheartj/ehq278.
[10] Pritchett AM, Redfield MM; (2002). Beta-blockers: new standard therapy for
heart failure. Mayo Clin. Proc. 77(8):839-846. DOI:10.4065/77.8.839.
[11] Packer M, Fowler MB, Roecker EB et al; (2002). Effect of carvedilol on the
morbidity of patients with severe chronic heart failure: results of the carvedilol
prospective randomized cumulative survival (COPERNICUS) study. Circulation
106 (17):2194-2199. DOI:10.1161/01.
[12] Leizorovicz A, Lechat P, Cucherat M, Bugnard F; (2002). Bisoprolol for the
treatment of chronic heart failure: a meta-analysis on individual data of two
placebo-controlled studies–CIBIS and CIBIS II. Cardiac Insufficiency Bisoprolol Study. Am. Heart J. 143 (2):301-307. DOI:10.1067/mhj.2002.120768.
DOI:10.1067/mhj.2002.120768.
[13] Allessie M, Ausma J, Schotten U; (2002). Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc. Res. 2002;54: 230-246.
DOI:10.1016/S0008-6363(02)00258-4.
[14] Daoud EG, Marcovitz P, Knight BP et al; (1999). Short-term effect of atrial
fibrillation on atrial contractile function in humans. Circulation 99:3024-3027.
DOI:10.1161/?01.CIR.99.23.3024.
[15] Nattel S, Li D; (2000). Ionic remodeling in the heart: pathophysiological significance and new therapeutic opportunities for atrial fibrillation. Circ. Res.
87:440-447. DOI:10.1161/?01.RES.87.6.440.
[16] Wolf PA, Abbott RD, Kannel WB; (1991). Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 22:983-988.
DOI:10.1161/?01.STR.22.8.983.
[17] Lake FR, Cullen KJ, de Klerk NH, McCall MG, Rosman DL; (1989). Atrial
fibrillation and mortality in an elderly population. Aust. N.Z. J. Med. 19:321326. DOI:10.1111/j.1445-5994.1989.tb00271.x.
[18] Phillips SJ, Whisnant JP, WM OF, Frye RL; (1990). Prevalence of cardiovascular disease and diabetes mellitus in residents of Rochester, Minnesota. Mayo
Clin. Proc. 65:344-359. DOI:10.1016/S0025-6196(12)62535-X.
[19] Furberg CD, Psaty BM, Manolio TA, Gardin JM, Smith VE, Rautaharju PM;
(1994). Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular
Health Study). Am. J. Cardiol. 74:236-241. DOI:10.1016/0002-9149(94)90363-8.
38
BIBLIOGRAFIA
[20] Langenberg M, Hellemons BS, van Ree JW et al; (1996). Atrial fibrillation in elderly patients: prevalence and comorbidity in general practice. BMJ
313(7071):1534. DOI:10.1136/bmj.313.7071.1534.
[21] Lee W, Lamas G, Balu S et al; (2008). Direct treatment cost of atrial fibrillation in the elderly American population: a Medicare perspective. J. Med. Econ.
11(2):281-298. DOI:10.3111/13696990802063425.
[22] Moe GK, Rheinboldt WC, Abildskov JA; (1964). A computer model of atrial
fibrillation. Am. Heart J. 67:200-220. DOI:10.1016/0002-8703(64)90371-0.
[23] Cappato R, Calkins H, Chen SA, Davies W, Iesaka Y, Kalman J, Kim YH,
Klein G, Natale A, Packer D, Skanes A, Ambrogi F, Biganzoli E; (2010). Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ. Arrhythm. Electrophysiol. 3(1):32-38.
DOI:10.1161/CIRCEP.109.859116.
[24] Murphy NF, Simpson CR, Jhund PS et al; (2007). A national survey of the
prevalence, incidence, primary care burden and treatment of atrial fibrillation
in Scotland. Heart 93:606-612. DOI:10.1136/hrt.2006.107573.
[25] Naccarelli GV, Varker H, Lin J, Schulman KL;(2009). Increasing prevalence of
atrial fibrillation and flutter in the United States. Am. J. Cardiol. 104:1534-1539.
DOI:10.1016/j.amjcard.2009.07.022.
[26] Miyasaka Y, Barnes ME, Gersh BJ et al; (2006). Secular trends in incidence of atrial fib rillation in Olmsted County, Minnesota, 1980 to 2000, and
implications on the projections for future prevalence. Circulation 114:119-125.
DOI:10.1161/?CIRCULATIONAHA.105.595140.
[27] Ringborg A, Nieuwlaat R, Lindgren P et al; (2008). Costs of atrial fibrillation in five European countries: results from the Euro Heart Survey on atrial
fibrillation. Europace 10:403-411.
[28] Cox JL, Canavan TE, Schuessler RB et al; (1991). The surgical treatment of
atrial fibrillation. II. Intraoperative electrophysiologic mapping and description
of the electro-physiologic basis of atrial flutter and atrial fibrillation. J. Thorac.
Cardiovasc. Surg. 101:406-426.
[29] Singh BN, Singh SN, Reda DJ et al; (2005). Sotalol Amiodarone Atrial Fibrillation Efficacy Trial (SAFE-T) Investigators. Amiodarone versus sotalol for atrial
fibrillation. N. Engl. J. Med. 352:1861-1872. DOI:10.1056/NEJMoa041705.
[30] (1989). Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Effect
of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N. Engl. J. Med. 321(6):406-412.
DOI:10.1056/NEJM198908103210629.
BIBLIOGRAFIA
39
[31] Roy D, Talajic M, Dorian P et al; (2000). Amiodarone to prevent recurrences of
atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N. Engl.
J. Med. 342(13):913-920. DOI:10.1056/NEJM200003303421302.
[32] Singh BN, Connolly SJ, Crijns HJ et al; (2007). EURIDIS and ADONIS Investigators. Dronedarone for maintenance of sinus rhythm in atrial fibrillation or
flutter. N. Engl. J. Med. 357:987-999. DOI:10.1056/NEJMoa054686.
[33] Davy JM, Herold H, Hoglund C et al; (2008). ERATO Study Investigators.
Dronedarone for the control of ventricular rate in permanent atrial fibrillation: the Efficacy and safety of dRonedArone for the cOntrol of ventricular
rate during atrial fibrillation (ERATO) study. Am. Heart J. 156(3):527.E1-E9.
DOI:10.1016/j.ahj.2008.06.010.
[34] Hohnloser SH, Crijns HJ, van Eickels M et al; (2009). ATHENA Investigators.
Effect of dronedarone on cardiovascular events in atrial fibrillation. N. Engl. J.
Med. 360: 668-678. DOI:10.1056/NEJMoa0803778.
[35] Kober L, Torp-Pedersen C, McMurray JJ et al; (2008). Dronedarone Study
Group. Increased mortality after dronedarone therapy for severe heart failure.
N. Engl. J. Med. 358(25):2678-2687. DOI:10.1056/NEJMoa0800456.
[36] Hohnloser S, Kuck KH, Lilienthal J; (2000). Rhythm or rate control in atrial
fibrillation. Pharmacological Intervention in Atrial Fibrillation (PIAF): a randomised trial. Lancet 356(9244):1789-1794. DOI:10.1016/S0140-6736(00)03230X.
[37] Gronefeld GC, Lilienthal J, Kuck KH, Hohnloser SH; (2003). Pharmacological Intervention in Atrial Fibrillation (PIAF) Study Investigators. Impact
of rate versus rhythm control on quality of life in patients with persistent
atrial fibrillation. Results from a prospective randomized study. Eur. Heart J.
24(15):1430-1436. DOI:10.1016/S0195-668X(03)00261-6.
[38] Carlsson J, Miketic S, Windeler J et al; (2003). STAF Investigators. Randomized trial of rate-control and rhythm-control in persistent atrial fibrillation:
the Strategies of Treatment of Atrial Fibrillation (STAF) study. J. Am. Coll.
Cardiol. 41(10):1690-1696. DOI:10.1016/S0735-1097(03)00332-2.
[39] Van Gelder IC, Hagens VE, Bosker HA et al; (2002). Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group. A comparison of rate control and rhythm control in patients with recurrent persistent atrial
fibrillation. N. Engl. J. Med. 347(23):1834-1840. DOI:10.1056/NEJMoa021375.
[40] Wyse DG, Waldo AL, DiMarco JP et al; (2002). Atrial Fibrillation Follow-up
Investigation of Rhythm Management (AFFIRM) Investigators. A comparison
of rate control and rhythm control in patients with atrial fibrillation. N. Engl.
J. Med. 347(23):1825-1833. DOI:10.1056/NEJMoa021328.
40
BIBLIOGRAFIA
[41] Opolski G, Torbicki A, Kosior DA et al; (2004). Investigators of the Polish
How to Treat Chronic Atrial Fibrillation Study. Rate control vs rhythm control in patients with nonvalvular persistent atrial fibrillation: the results of the
Polish How to Treat Chronic Atrial Fibrillation (HOT CAFE) Study. Chest
126(2):476-486. DOI:10.1378/chest.126.2.476.
[42] Roy D, Talajic M, Nattel S et al; (2008). Atrial Fibrillation and Congestive Heart Failure Investigators. Rhythm control versus rate control for
atrial fibrillation and heart failure. N. Engl. J. Med. 358(25):2667-2677.
DOI:10.1056/NEJMoa0708789.
[43] Ogawa S, Yamashita T, Yamakazi T et al; (2009). J-RHYTHM Investigators.
Optimal treatment strategy for patients with paroxysmal atrial fibrillation: JRHYTHM Study. Circ. J. 73(2):242-248. DOI:10.1253/circj.CJ-08-0608.
[44] Young-Xu Y, Jabbour S, Goldberg R et al; (2003). Usefulness of statin drugs
in protecting against atrial fibrillation in patients with coronary artery disease.
Am. J. Cardiol. 92(12):1379-1383. DOI:10.1016/j.amjcard.2003.08.040.
[45] Tveit A, Grundtvig M, Gundersen T et al; (2004). Analysis of pravastatin to
prevent recurrence of atrial fibrillation after electrical cardioversion. Am. J.
Cardiol. 93(6):780-782. DOI:10.1016/j.amjcard.2003.12.009.
[46] Maggioni AP, Fabbri G, Lucci D et al; (2009). GISSI-HF Investigators. Effects
of rosuvastatin on atrial fibrillation occurrence: ancillary results of the GISSIHF trial. Eur. Heart J. 30(19):2327-2336. DOI:10.1093/eurheartj/ehp357.
[47] Chen WT, Krishnan GM, Sood N, Kluger J, Coleman CI; (2010). Effects of statins on atrial fibrillation after cardiac surgery: a duration-and
dose-response meta-analysis. J. Thorac. Cardiovasc. Surg. 140(2):364-372.
DOI:10.1016/j.jtcvs.2010.02.042.
[48] Suleiman M, Hoestler C, Lerman A et al; (2012). Atorvastatin for prevention of atrial fibrillation recurrence following pulmonary vein isolation: a
double-blind, placebo-controlled, randomized trial. Heart Rhythm 9(2):172-178.
DOI:10.1016/j.hrthm.2011.09.016.
[49] Rahimi K, Emberson J, McGale P et al; (2011). PROSPER Executive. Effect of statins on atrial fibrillation: collaborative meta-analysis of published
and unpublished evidence from randomised controlled trials. BMJ 342:d1250.
DOI:10.1136/bmj.d1250.
[50] Damiano RJ Jr; (2003). Alternative energy sources for atrial ablation: judging the new technology Annals Thorac. Surg. 75:329:330. DOI:10.1016/S00034975(02)04844-0.
BIBLIOGRAFIA
41
[51] Cox J, Schuessler R, D’Agostino H, Stone C, Chang B, Cain M, Corr P, Boineau
J; (1991). The surgical treatment of atrial fibrillation. III. Development of a
definitive surgical procedure. J. Thorac. Cardiovasc. Surg. 101(4):569-583.
[52] Prasad S, Maniar H, Camillo C, Schuessler R, Boineau J, Sundt T, Cox J, Damiano RJ Jr; (2003). The cox maze III procedure for atrial fibrillation:long-term
efficacy in patients undergoing lone versus concomitant procedures. J. Thorac.
Cardiovasc. Surg. 126(6):1822-1828. DOI:10.1016/S0022-5223(03)01287-X.
[53] Corley SD, Epstein AE, DiMarco JP et al; (2004). AFFIRM Investigators.
Relationships between sinus rhythm, treatment, and survival in the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) Study.
Circulation 109:1509-1513. DOI:10.1161/?01.CIR0000121736.16643.11.
[54] Takahashi N, Seki A, Imataka K, Fujii J; (1981). Clinical features of paroxysmal
atrial fibrillation: an observation of 94 patients. Jpn. Heart J. 22(2):143-149.
[55] Saltman A, Rosenthal L, Francalancia N, Lahey S; (2003). A completely endoscopic approach to microwave ablation for atrial fibrillation. Heart Surg. Forum
6(3):E38-E41.
[56] Wolf R, Schneeberger E, Osterday R, Miller D, Merrill W, Flege J, Gillinov A;
(2005). Video-assisted bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation. J. Thorac. Cardiovasc. Surg. 130(3):797-802.
DOI:10.1016/j.jtcvs.2005.03.041.
[57] Damiano RJ Jr, Marci Bailey; (2007). The Cox-Maze IV procedure for lone atrial fibrillation.
MMCTS
mmcts.2007.002758.
DOI:10.1510/mmcts.2007.002758.
[58] Sirak J, Jones D, Schwartzman D; (2010). The Five-Box Thoracoscopic Maze Procedure. Annals Thorac. Surg. 90(3):986-989. DOI:
10.1016/j.athoracsur.2010.05.022.
[59] Kumagai K, Nakashima H, Saku K; (2004). The HMG-CoA reductase inhibitor atorvastatin prevents atrial fibrillation by inhibiting inflammation in a canine sterile pericarditis model. Cardiovasc. Res. 62(1):105-111.
DOI:10.1016/j.cardiores.2004.01.018.
[60] Shiroshita-Takeshita A, Brundel BJ, Burstein B et al; (2007). Effects of simvastatin on the development of the atrial fibrillation substrate in dogs with congestive heart failure. Cardiovasc. Res. 74(1):75-84.
DOI:10.1016/j.cardiores.2007.01.002.
[61] Ninio DM, Murphy KJ, Howe PR, Saint DA; (2005). Dietary fish oil protects against stretch-induced vulnerability to atrial fibrillation in a rabbit
model. J. Cardiovasc. Electrophysiol. 16(11):1189-1194. DOI:10.1111/j.15408167.2005.50007.x.
42
BIBLIOGRAFIA
[62] Sakabe M, Shiroshita-Takeshita A, Maguy A et al; (2007). Omega3 polyunsaturated fatty acids prevent atrial fibrillation with heart failure but not atrial tachycardia remodeling. Circulation 116(19):2101-2109.
DOI:10.1161/CIRCULATIONAHA.107.704759.
[63] Ramadeen A, Connelly KA, Leong-Poi H et al; (2012). N-3 polyunsaturated fatty acid supplementation does not reduce vulnerability to
atrial fibrillation in remodeling atria. Heart Rhythm 9(7):1115-1122.e4.
DOI:10.1016/j.hrthm.2012.02.013.