Esperienza 2: SINTESI DEL PERBORATO DI SODIO ESAIDRATO
Alcune nozioni di base
PEROSSIDI
Presentano un atomo di ossigeno in più rispetto agli ossidi, contengono infatti il gruppo
-O-O-. In questi composti l'ossigeno ha numero di ossidazione -1.
Nomenclatura: Perossido di non-metallo/metallo
ESEMPI
a) Na2O2 perossido di sodio
b) H2O2 perossido di idrogeno (acqua ossigenata)(H-O-O-H)
c) BaO2 perossido di bario
REAZIONI DI PRECIPITAZIONE
In una reazione di precipitazione due composti ionici solubili reagiscono per dare un
prodotto insolubile, chiamato precipitato.
Il precipitato si forma attraverso la rimozione netta degli ioni dalla soluzione.
E’ possibile che in una reazione di precipitazione si formi più di un precipitato.
Esperienza 2: SINTESI DEL PERBORATO DI SODIO ESAIDRATO
Alcune nozioni di base
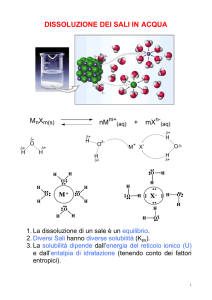
Una soluzione in equilibrio un eccesso di soluto indisciolto (corpo di fondo o
precipitato) si dice satura. La concentrazione della soluzione satura, ad una certa
temperatura, è la solubilità, S.
Se si raggiunge la saturazione comincia la PRECIPITAZIONE
La soluzione, però prima di giungere a saturazione può trovarsi in uno stato di sovrasaturazione, nel
quale presenta una concentrazione del soluto superiore a quella della soluzione satura alla
medesima temperatura,
Una soluzione sovrasatura si trova in uno stato metastabile, reso possibile solo dalla lentezza della
reazione, che evolve poi spontaneamente a bifasico (solido + soluzione satura, PRECIPITAZIONE).
È necessario del tempo per lo sviluppo dei cosiddetti germi di cristallizzazione, cristalli
microscopici in grado di promuovere (per successivo accrescimento) la precipitazione vera e
propria. Questa viene quindi agevolata, favorendo la formazione dei germi con ultrasuoni o,
più semplicemente, sfregando con la bacchetta di vetro le pareti del recipiente.
Esperienza 2: SINTESI DEL PERBORATO DI SODIO ESAIDRATO
Alcune nozioni di base
Una reazione di
precipitazione e i tre
tipi di equazione che la
descrivono.
Esperienza 2: SINTESI DEL PERBORATO DI SODIO ESAIDRATO
Alcune nozioni di base
La precipitazione
del fluoruro di
calcio
DIGESTIONE
I precipitati cristallini sono più facilmente filtrabili se:
• Si lasciano a contatto con le A.M. (acque madri).
• Aumentando o diminuendo la temperatura.
2NaF (aq) + CaCl2 (aq) → CaF2 (s) + 2NaCl (aq)
2 Na+ (aq) + 2 F- (aq) + Ca2+ (aq) + 2 Cl- (aq)
2 F-(aq) + Ca2+ (aq)
→
→ CaF2(s) + 2 Na+ (aq) + 2 Cl- (aq)
CaF2(s)
Esperienza 3: SINTESI DEL PERBORATO DI SODIO ESAIDRATO
Scopo di questa esperienza è la sintesi del diperossoborato di sodio esaidrato
(perborato di sodio) Na2[B2(O2)2(OH)4]•6 H2O a partire da tetraborato di sodio
decaidrato Na2B4O7 •10 H2O in soluzione acquosa.
Il tetraborato reagisce con l’acqua ossigenata, H2O2, in ambiente basico secondo la reazione:
Na2B4O7 (aq) + 4 H2O2 (aq) + 2 NaOH (aq) + 11 H2O(l) →
→ 2 Na2[B2(O2)2(OH)4]•6 H2O (s)
La struttura dello ione perossoborato è la seguente:
HO
O-O
B
HO
OH
2-
B
O-O
OH
Lo stato di ossidazione dell’ossigeno nel gruppo perossido -(O-O)2- è -1
Esperienza 2: SINTESI DEL PERBORATO DI SODIO ESAIDRATO
il perborato può, quindi, agire sia come ossidante (l’ossigeno del gruppo perossido si riduce
allo stato di ossidazione -2) sia come riducente (l’ossigeno si ossida e si forma ossigeno
molecolare O2 con numero di ossidazione 0). Il perborato è in grado, ad esempio, di essere
ridotto da KI (che si ossida ad I2 di colore colore scuro) o di essere ossidato da KMnO4 (che si
riduce a Mn2+).
È un composto irritante. Trova utilizzo come
additivo nei detergenti sbiancanti
A temperatura di circa 60°C il perborato si decompone in soluzione
acquosa liberando perossido di idrogeno H2O2, instabile rispetto
alla reazione di disproporzione:
2 H2O2(aq)
=
2 H2O(l)
+
O2(g)
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
Alcune nozioni di base
SOLUBILITA’
• Soluzione satura = soluzione contenente la massima quantità di soluto che il solvente è in
grado di sciogliere a quella data temperatura.
• Solubilità di un soluto in un solvente = concentrazione della soluzione satura (viene di
solito espressa in moli/l, ma si può trovare anche espressa in g/l o nelle altre forme in cui
viene espressa la concentrazione).
REAZIONI DI PRECIPITAZIONE
In una reazione di precipitazione due composti ionici solubili reagiscono per dare un
prodotto insolubile, chiamato precipitato.
Il precipitato si forma attraverso la rimozione netta degli ioni dalla soluzione.
E’ possibile che in una reazione di precipitazione si formi più di un precipitato.
7
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
La Mér Diagram
• Growth regime: kinetic vs. thermodynamic control (pH, T)
Final size & shape of
crystals
• Crystal phase of the nucleation seeds
• Surfactants
• Surface energy of the crystal facets and capping molecules
Cheon et al. Angew. Chem. Int. Ed. 2006, 45, 3414
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
Alcune nozioni di base : CRISTALLIZZAZIONE e PRECIPITAZIONE
Il cristallo iniziale «seleziona i germi cristallini giusti» dalla soluzione
9
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
Alcune nozioni di base
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
Alcune nozioni di base: parametri per una buona CRISTALLIZZAZIONE
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
To sum up
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
Alcune nozioni di base
ACIDI E BASI
Un acido è una sostanza che produce ioni H+ quando viene disciolta in H2O
H2O
HX →
H+ (aq) + X- (aq)
Una base è una sostanza che produce ioni OH- quando viene disciolta in H2O
H2O
MOH → M+ (aq) + OH- (aq)
INTRODUZIONE AL CONCETTO DI pH DI UNA SOLUZIONE ACQUOSA
La concentrazione degli ioni H+ in soluzione viene spesso espressa come pH, dove:
pH = - log [H+]
dove [H+] = concentrazione (mol/L) di ioni H+ in soluzione
In acqua pura → pH = 7
soluzioni acide → [H+] > 10–7 ⇒ pH < 7
soluzioni neutre → [H+] = 10–7 ⇒ pH = 7
soluzioni basiche → [H+] < 10–7 ⇒ pH > 7
La scala di pH va da 0 a 14
Esperienza 3: SINTESI DELL’ALLUME POTASSICO
Alcune nozioni di base
Per misurare il pH di una soluzione acquosa in modo indicativo (non con
elevata precisione) è possibile utilizzare una cartina tornasole che assume
colorazioni differenti a seconda del pH della soluzione.
pH acido (inferiore a 7): la cartina si colora e diviene di colore
rosso intenso per valori di pH ≈ 1
pH neutro (circa 7): la cartina rimane di colore giallo
pH basico (superiore a 7): la cartina si colora e diviene di
colore blu per valori di pH ≈ 13-14
Uso della cartina: con l’estremità della bacchetta, bagnata di soluzione,
si tocca un piccolo pezzo di cartina e si confronta il colore ottenuto con
l’indicazione della confezione. Non immergere MAI la cartina
direttamente nella soluzione.
Esperienza 4: SINTESI DELL’ALLUME POTASSICO
Alcune nozioni di base
IDROSSIDI
Sono ottenuti per reazione fra ossidi dei metalli con acqua. Contengono ossigeno e idrogeno come
gruppo “OH” “idrossile” (che in realtà è OH- “ione idrossido”).
Na2O + H2O →2 NaOH
ESEMPI
a)NaOH
b)Fe(OH)2
c)Fe(OH)3
Idrossido di sodio
idrossido ferroso o idrossido di Fe(II)
idrossido ferrico o idrossido di Fe(III)
Le loro soluzioni acquose sono
caratterizzate dalla presenza
dello ione OH- e pertanto
hanno carattere basico
La precipitazione degli idrossidi si effettua aggiungendo alla soluzione contenente un catione
metallico una base o una soluzione acquosa basica:
Mn+ + OH- → M(OH)n(s)
Nel caso di alcuni particolari idrossidi, un eccesso di OH- (reattivo precipitante) provoca
la dissoluzione dell’idrossido e la formazione di un composto solubile
Esperienza 4: SINTESI DELL’ALLUME POTASSICO
Alcune nozioni di base
Queste particolari idrossidi sono chiamati IDROSSIDI ANFOTERI
Si dice “anfotera” una specie chimica che può comportarsi sia da acido sia da base
Solo alcuni metalli che occupano la posizione centrale della tavola periodica (Zn , Cr,
Sn, Pb e Al) formano idrossidi “anfoteri”.
Solido gelatinoso bianco
Ad esempio:
Al3+ (aq) + 3OH- ↔ Al(OH)3(s) +OH- ↔ Al(OH)4-(aq) in ambiente basico ed in eccesso di base
Al(OH)4- (aq) + H+ ↔ Al(OH)3(s) + 3H+ ↔ Al3+ (aq) in ambiente acido ed in eccesso di acido
Complesso in soluzione
Esperienza 4: SINTESI DELL’ALLUME POTASSICO
Scopo di questa esperienza è la sintesi di un allume, KAl(SO4)2•12H2O, sale doppio di K ed Al idrato a partire da
carta d’alluminio per uso alimentare
Prima si scioglie l’Al in una soluzione di KOH e si forma di tetraidrossoalluminato di potassio K[Al(OH)4] solubile:
2Al(s) + 2KOH(aq) + 6H2O(l) → 2 K[Al(OH)4] (aq) + 3H2(g)
Durante la reazione si libera idrogeno gassoso, per effetto della riduzione dell’acqua da parte dell’alluminio
metallico, che gorgoglia nella miscela. Si ha una precipitazione di scorie nere: sono gli additivi del materiale
d’alluminio che non passano in soluzione e devono essere eliminati per filtrazione.
In un secondo tempo si ha la formazione dell’allume per reazione con acido solforico. Nella prima fase della
reazione, dopo l'aggiunta di H2SO4, non si riesce ad evitare la formazione di idrossido di alluminio Al(OH)3 bianco
che può essere disciolto scaldando la soluzione:
2 KAl(OH)4(aq) + H2SO4(aq) → 2 Al(OH)3(s) + K2SO4(aq) + 2 H2O(l)
2 Al(OH)3(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 6 H2O(l)
a caldo
Solo quando la dissoluzione di Al(OH)3 è completa ed in soluzione sono presenti gli ioni Al3+ e K+ derivanti dalla
dissociazione dei relativi solfati, si ha la formazione dell'allume:
K2SO4(aq) + Al2(SO4) 3(aq) + 24 H2O(l) → 2 KAl(SO4)2 •12 H2O(s)
ALLUME POTASSICO: un modo per riciclare ALLUMINIO
•
•
•
•
•
•
•
~ 1,5 billion of aluminum beverage cans are
produced each day in the U.S.
Aluminum is one of the most indestructible
materials used in metal containers.
The average “life” of an aluminum can is
about one hundred years.
Although aluminum is the third most
abundant element in the earth’s crust, the
expense of extracting it from common soils
is too expensive and the major source is
the ore bauxite, the hydrated form of
aluminum oxide, Al2O3⋅2H2O.
Concern regarding the depletion of
aluminum ores,
major concern: the amount of electrical
energy needed to extract the aluminum
from its ores.
To produce a single can, the energy needed
is about the same as that required to keep
a 100-watt bulb lit for 6 hours. That energy
can be reduced by up to 95 percent by
recycling used aluminum cans.
Sostanze Anfotere
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Alcune nozioni di base
ANALISI VOLUMETRICA E TITOLAZIONI
Nell'analisi volumetrica la concentrazione incognita di un composto (analita) viene
determinata mediante titolazione, cioè mediante aggiunta di un volume noto di una
soluzione di reattivo a concentrazione nota, il titolante, che reagisce quantitativamente
con l'analita in esame.
Il punto FINALE della titolazione al quale vengono interrotte le aggiunte di titolante, è
caratterizzato da un cambiamento improvviso di una proprietà fisica o chimica della
soluzione e deve essere il più possibile vicino al punto di EQUIVALENZA, cioè al punto al
quale si sarebbe pervenuti dopo aver aggiunto la quantità esattamente stechiometrica di
titolante (il titolante ha reagito COMPLETAMENTE con l’analita).
La differenza tra punto finale e punto di equivalenza determina l’errore di titolazione; in
generale si cerca di ridurre tale errore scegliendo una proprietà il cui cambiamento sia
facilmente osservabile e permetta una lettura del punto finale il più possibile prossima al
punto di equivalenza.
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Alcune nozioni di base
Per effettuare correttamente una determinazione volumetrica, è necessario conoscere con
precisione la concentrazione della soluzione titolante (titolo), che può essere uno standard
primario o secondario.
Uno standard primario deve:
essere stabile e reagire rapidamente completamente e selettivamente con l’analita
poter essere reperito facilmente e deve essere essiccabile (preferibilmente a 110120°C) e conservabile allo stato puro;
rimanere inalterato durante le operazioni di pesata (non deve essere igroscopico,
ossidabile all'aria o assorbire anidride carbonica);
poter essere analizzato con metodi idonei al fine della determinazione della
purezza (maggiore del 99,98%);
avere preferibilmente un alto peso equivalente in modo da minimizzare l'errore di
pesata;
essere facilmente solubile in acqua.
Se il titolante non è uno standard primario, deve essere standardizzato titolando una
soluzione di concentrazione circa uguale a quella desiderata, con una quantità nota di uno
standard primario opportuno (standard secondario).
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Alcune nozioni di base
I CALCOLI NELLE TITOLAZIONI
Supponiamo di avere la generica reazione:
tT + aA
prodotti
Allora sono necessarie t moli di titolante (T) per reagire con a moli di analita (A). Le moli di
titolante impiegate sono:
Moli di T = VTMT
Dove VT è il volume di titolante e MT la molarità di T. Le moli di A che devono essere state
presenti per reagire completamente con le moli di T sono, secondo la stechiometria della
reazione:
Moli di A= a/t moli di T
Poiché a moli di A reagiscono con t moli di T
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Alcune nozioni di base
TITOLAZIONI ACIDO-BASE
La concentrazione di un acido o di una base in soluzione acquosa viene determinata per via
volumetrica attraverso una reazione di neutralizzazione con, rispettivamente, una base o un
acido a titolo noto (titolante). Qualunque siano l’acido o la base la reazione è data da:
H3O+ + OH- ⇔ 2 H2O
CURVE DI TITOLAZIONE
Sono dei grafici in cui viene riportato il pH in funzione del volume aggiunto di titolante.
Dalla particolare forma della curva si può ricavare il volume al punto di equivalenza.
La curva di titolazione può essere ricavata dalla
misura del pH della soluzione durante le aggiunte
di acido o di base oppure calcolata, in via
semplificata, utilizzando le equazioni chimiche
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Alcune nozioni di base
Il volume di titolante al punto di equivalenza consente di calcolare le moli di titolante
che hanno reagito con la sostanza a titolo incognito in accordo con i rapporti
stechiometrici e quindi di ricavarne il titolo.
Un esempio classico è quello della
titolazione di un acido forte con una
base forte. Nel caso della titolazione di
HCl 0,1 M con NaOH 0,1 M si ha la
curva di titolazione riportata in figura.
Le caratteristiche della curva del
sistema in esame
sono importanti per scegliere
correttamente l’indicatore
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Alcune nozioni di base
Determinazione del punto di EQUIVALENZA in una titolazione
Si può utilizzare un indicatore, un composto il cui colore cambia in prossimità del punto di
equivalenza per la scomparsa dell’analita o la presenza dell’eccesso di titolante.
Gli indicatori usati nelle titolazioni acido-base sono sostanze organiche che in soluzione
danno luogo ad un equilibrio tra una forma acida ed una basica diversamente colorate.
Se HIn è la forma acida di un generico indicatore ed In- la base coniugata corrispondente, in
soluzione si instaura l’equilibrio:
HIn + H2O ⇔ In- + H3O+
caratterizzato da una costante:
H O ][ In ]
[
=
+
K HIn
−
3
[ HIn]
Il rapporto [In-]/[HIn] dipende dal valore del pH della soluzione. Un aumento di [H3O+]
(diminuzione del pH) riduce il rapporto e, viceversa, una riduzione lo aumenta. A pH acido
prevale Hin, a pH basico In-
Un indicatore si dice al punto di viraggio quando la forma acida e la forma basica sono presenti
in eguale concentrazione e la soluzione acquista un colore intermedio .
Poichè al punto di viraggio
[In-] = [HIn]
si ha che
[H3O+] = KHIn
oppure
pH = pKHin
Ogni indicatore è, quindi, caratterizzato da un pH di viraggio identico al pK dell’indicatore.
In realtà l’occhio umano distingue chiaramente la transizione da un colore all’altro quando una
delle due forme è presente in rapporto di circa 10 : 1 rispetto all’altra. Per questo motivo il
viraggio di un indicatore non viene osservato sperimentalmente ad un preciso valore di pH ma in
una zona di ± 1 unità pH rispetto al pH di viraggio.
L'indicatore deve essere
aggiunto
nella
quantità
minima
necessaria
per
poter osservare il viraggio.
In caso contrario potrebbe
consumare una frazione non
indifferente di titolante.
Dopo il punto di equivalenza, il pH
è determinato dall’eccesso di ioni
OH- nella soluzione
Al punto di equivalenza, OHaggiunto è esattamente sufficiente
per reagire con tutto H+. Il pH è
quello di H2O
Prima di raggiungere il punto di equivalenza,
il pH è determinato dall’eccesso di ioni H+
nella soluzione rispetto alla base aggiunta
Curva di titolazione base debole-acido forte
Il pH diminuisce
gradualmente nella
regione tampone. In
soluzione sono
presenti la base debole
e il suo acido
coniugato.
Al punto di equivalenza,
pH< 7,00 a causa della
reazione dell’acido
coniugato con H2O.
Esperienza 4:
TITOLAZIONI ACIDO-BASE
La buretta è un tubo di vetro graduato munito di rubinetto, di solito di
teflon, utilizzato per erogare un volume qualsiasi di liquido entro i limiti
della sua capacità massima.
Prima di riempire una buretta è necessario pulirla ed asciugarla
accuratamente per evitare che tracce di acqua o di altre sostanze diluiscano
o inquinino la soluzione titolante. Se la buretta non è asciutta si può
utilizzare la tecnica dell’avvinamento, che in realtà si può applicare a
qualsiasi recipiente tarato. Si introduce nella buretta una piccola quantità
(5-10 ml) della soluzione titolante e si muove la buretta in modo da bagnare
completamente le pareti con il liquido, che alla fine viene eliminato. Si
ripete tale operazione due o tre volte. E’ evidente che le tracce di liquido da
asportare devono essere miscibili con la soluzione
La presenza di bolle d’aria può alterare la misura del volume. Le bolle d’aria
sulle pareti si possono eliminare picchiettando leggermente sulla superficie
del vetro. Se la bolla si forma all’imboccatura del rubinetto si elimina
facendo fluire il liquido per qualche secondo a rubinetto completamente
aperto.
BURETTA
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Bisogna considerare, inoltre, che un liquido, a causa della tensione superficiale, aderisce
alla parete del recipiente che lo contiene. Per questo motivo la sua superficie non è piana
ma curva, concava nel caso dell’acqua e delle soluzioni acquose. Si forma il cosiddetto
menisco che rende più difficile la lettura del livello del liquido rispetto alla tacca.
Nella pratica si considera di aver riempito con il volume di liquido indicato quando il fondo
del menisco è tangente alla tacca di calibrazione.
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Alcune nozioni di base
pH-metro
Nel caso delle titolazioni acido-base, un altro metodo per seguire la titolazione e per
determinare il punto di equivalenza è l’utilizzo di un pH-metro.
Il componente principale di un pH-metro è l’ elettrodo di vetro che come tutti gli elettrodi, è un
dispositivo per la misura del potenziale della soluzione (o forza elettromotrice, f.e.m.)
L’elemento sensibile è costituito da un bulbo di vetro sottile (se fosse spesso, non permetterebbe la
conduzione elettrica tra i due lati, condizione necessaria affinché si possa misurare un potenziale).
La superficie esterna del bulbo è in contatto con la soluzione della quale si vuol misurare il pH, mentre
all’interno il bulbo contiene una soluzione tampone (di solito a pH = 7) ed un sale di cloruro (di solito NaCl)
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Alcune nozioni di base
La figura sotto riporta un ingrandimento del bulbo di vetro sottile; vengono indicati anche i gruppi
idrossilici (silicati) superficiali del vetro. Tali gruppi, essendo acidi deboli, possono dare reazione
acido-base se la superficie del vetro è a contatto con l’acqua:
Dopo immersione
Poiché tale concentrazione di H3O+ è diversa nella soluzione interna ed in quella esterna, sarà diverso il
numero di gruppi silicati che deprotona nelle due soluzioni, per cui sarà diversa anche la carica elettrica
complessiva che si crea sulle due superfici del bulbo. Tale sbilanciamento di carica genera un potenziale
elettrico, Eelettr,tra i due lati del bulbo stesso. Eelettr dipende dalla concentrazione di ioni idrogeno presenti nella
soluzione esterna, [H3O+]est, e dalla concentrazione di ioni idrogeno in quel-la interna, [H3O+]int.
Essendo quest’ultima sempre costante:
Dipende dal pH
Esperienza 4:
TITOLAZIONI ACIDO-BASE
Inoltre, tra il filo di argento e la soluzione interna si genera a sua volta un potenziale elettrico:
(dove [Cl–]int è la concentrazione di ioni cloruro nella soluzione interna del bulbo). Questo è
infatti il potenziale per un elettrodo di seconda specie: tali elettrodi si generano quando un filo
di metallo M viene immerso in una soluzione contenente il precipitato di un sale poco solubile
del catione Mn+ (MX(s)) e un eccesso dello stesso anione precipitante Xn–
La differenza di potenziale che si genera tra il filo d’argento e la soluzione esterna sarà data
dalla somma dei due potenziali, e quindi assume la forma seguente
Il potenziale dell’elettrodo di seconda specie è costante durante una titolazione, perciò:
(con D = costante = EAg/AgCl/Cl–)
Sostituendo il pH a –log[H3O+], e conglobando
le due costanti C e D, si ottiene:
elettrodo di vetro al quale viene unito, in un unico
corpo, un elettrodo di riferimento
Elettrodo combinato
Il pH-metro converte i valori di E sperimentali in unità di pH,
riportando sul display direttamente questi ultimi.
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
Alcune nozioni di base
In appropriate condizioni, tutte le reazioni sono reversibili e
raggiungono uno stato di equilibrio.
All’equilibrio, le concentrazioni dei reagenti e dei prodotti non
variano più nel tempo.
L’equilibrio chimico è un equilibrio dinamico: le reazioni
continuano ad avvenire ma non si osserva una trasformazione
netta perché le trasformazioni in un senso sono bilanciate da
quelle nel verso opposto.
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
Alcune nozioni di base
Per una generica reazione
Il quoziente di reazione è: Q =
[C]c[D]d
[A]a[B]b
Q dà il rapporto tra le concentrazioni dei prodotti e dei
reagenti in qualsiasi momento della reazione.
All’equilibrio: Q = K
Il valore di Q indica se il sistema ha raggiunto l’equilibrio, quanto
dista da esso se non l’ha raggiunto, e in quale verso sta variando
per raggiungere l’equilibrio.
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
Alcune nozioni di base
Il valore di Q indica la direzione in cui una reazione deve
procedere per raggiungere l’equilibrio.
Se Q < K, i reagenti devono aumentare e i prodotti diminuire: la
reazione avanza verso destra, reagenti → prodotti fino al
raggiungimento dell’equilibrio.
Se Q > K, i reagenti devono diminuire e i prodotti aumentare: la
reazione avanza verso sinistra, prodotti → reagenti fino al
raggiungimento dell’equilibrio.
Se Q = K, il sistema è all’equilibrio e non si osserva nessuna
trasformazione netta.
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
Alcune nozioni di base
SOLUZIONE SATURA: soluzione contenente la massima quantità di soluto che il solvente
è in grado di sciogliere a quella data temperatura
Tutti i composti cosiddetti “insolubili” sono in realtà leggermente solubili in soluzione acquosa.
Assumiamo che la piccola quantità di composto disciolta sia completamente dissociata.
Per un composto poco solubile esiste un equilibrio tra il soluto solido e gli ioni acquosi.
PbF2(s)
Kc =
[Pb2+][F-]2
[PbF2]
Pb2+(aq) + 2F-(aq)
Qps = Kc[PbF2] = [Pb2+][F-]2
Solido, la cui concentrazione nella fase solida è costante
dove Qps è il prodotto ionico per un composto ionico poco solubile.
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
Alcune nozioni di base
PRODOTTO DI SOLUBILITA’ Kps
Per ogni composto ionico poco solubile MpXq, costituito dagli ioni Mn+ e Xz-,
Qps = [Mn+]p[Xz-]q
Quando la soluzione è satura,
il sistema è in equilibrio e Qps = Kps, la costante prodotto di solubilità.
Il prodotto di solubilità di un generico sale è dato quindi dal prodotto delle concentrazioni
molari (mol L-1) delle specie ioniche in cui si dissocia, ciascuna elevata al coefficiente
stechiometrico con cui compare nell’equazione di dissociazione
Il valore di Kps di un sale indica quanto la dissoluzione procede verso l’equilibrio
(saturazione della soluzione).
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
Alcune nozioni di base
Kps per alcuni composti ionici a 25 °C
Più basso è Kps più il composto è poco solubile
Kps DIPENDE DALLA TEMPERATURA
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
Alcune nozioni di base
In altre parole, il Kps esprime i limiti delle concentrazioni ioniche oltre le quali esso
precipita e al di sotto delle quali esso resta in soluzione
Per una soluzione satura di un omposto ionico poco solubile, Qps = Kps.
Qps = Kps
la soluzione è satura e non avvengono variazioni.
Qps > Kps
si forma un precipitato fino a quando la soluzione è satura.
Qps < Kps
la soluzione è insatura e non si forma precipitato.
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
In questa esperienza l’obiettivo è determinare il prodotto di solubilità di un
idrossido poco solubile, l’idrossido di calcio Ca(OH)2
In una soluzione satura di Ca(OH)2 si ha l’equilibrio:
Ca(OH)2(s) ⇔ Ca++(aq) + 2OH-(aq)
La costante di equilibrio di questa reazione può essere scritta in modo semplificato
in quanto la concentrazione di Ca(OH)2(s) è costante:
Kps = [Ca++] [OH-]2
PRODOTTO DI SOLUBILITA’
Esperienza 5: DETERMINAZIONE della Kps dell’Idrossido di Calcio
Alcune nozioni di base
B
A
PbCrO4(s)
Pb2+(aq) + CrO42-(aq)
A. Il cromato di piombo(II), un sale poco solubile, forma una soluzione acquosa satura.
B. Quando si aggiunge una soluzione di Na2CrO4, la quantità di PbCrO4(s) aumenta,
indicando una minore solubilità in presenza dello ione a comune, CrO42.
Esperienza 6: PREPARAZIONE DI COMPOSTI LUMINESCENTI
Alcune nozioni di base
Le onde elettromagnetiche sono caratterizzate sia da una lunghezza d’onda λ che da una frequenza ν
che sono tra loro in relazione tramite la legge λ ν = c = velocità della luce nel vuoto = 300.000 km/s
Inoltre i fotoni sono portatori di una energia E = h ν
I fotoni interagiscono con gli elettroni in
tre modi:
Assorbimento: un fotone viene assorbito
da un elettrone che va dal livello
energetico iniziale E1 al livello eccitato E2,
con: E2 =E1+hν .
Emissione spontanea: l’elettrone che si
trova in uno stato eccitato decade dal
livello E2 al livello E1, con E1 = E2 - hν .
Emissione stimolata: un elettrone che si
trova in uno stato eccitato, che viene
colpito da un fotone può diseccitarsi
emettendo un altro fotone.
Esperienza 6: PREPARAZIONE DI COMPOSTI LUMINESCENTI
Alcune nozioni di base
Light Emitting Diode (LED)
• A light emitting diode (LED) is a device which converts electrical energy to
light
• LEDs are preferred light sources for short distance (local area) optical fiber
network because they:
are inexpensive,
robust and have long life (the long life of an LED is primarily due to
its being a cold device, i.e. its operating temperature being much
lower than that of, say, an incandescent lamp),
can be modulated (i.e. switched on and off) at high speeds (this
property of an LED is also due to its being a cold device as it does
not have to overcome thermal inertia)
They are mainly semiconductors (i.e. GaAs, GaAlAs, etc…)
Esperienza 6: PREPARAZIONE DI COMPOSTI LUMINESCENTI
Light Emitting Diode (LED): COME FUNZIONANO
1
2
Il meccanismo di funzionamento è
abbastanza semplice: si applica una
tensione giunzione p-n che genera così
coppie elettrone-lacuna; queste coppie si
ricombinano emettendo i fotoni visibili.
LUCE
Esperienza 6: PREPARAZIONE DI COMPOSTI LUMINESCENTI
Organic Light Emitting Diode (OLED)
An OLED is an electronic device made by placing a series of organic thin films
between two conductors. When electrical current is applied, a bright light is emitted.
A device that is 100 to 500 nanometers thick or about 200 times smaller than a
human hair.
Both OLED and LED use the same principle of electroluminescence.
OLED advantages
• Lighter weight
• Perform at lower efficiencies
• Less power consumption
• Organic/organimetallic based chemicals
Molecules commonly used in OLEDs include organometallic
compounds
Tris(8-hydroxyquinolinato)aluminium
Tris(dibenzoylmethane) mono(1,10-phenanthroline)europium(lll)
Alq3 has been used as a green emitter, while
Eu(dbm)3(phen) as a red emitter
Esperienza 6: PREPARAZIONE DI COMPOSTI LUMINESCENTI
Commercial Uses of OLED
Esperienza 6: PREPARAZIONE DI COMPOSTI LUMINESCENTI
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
Alcune nozioni di base
L’analisi chimica qualitativa ha come obiettivo l’individuazione della natura di una sostanza o
di una miscela di sostanze
1) Reazioni specifiche
Reazioni che possono essere utilizzate anche in PRESENZA di altri ioni
INTERFERISCANO nel risultato
senza che
NH4+ + OH- → NH3↑ + H2O
Es.:
NB: la maggior parte delle reazioni diventa SPECIFICA in opportune condizioni sperimentali
(per esempio, dopo l’eliminazione di alcuni ioni interferenti)
2) Procedimento sistematico
Quando è sconveniente utilizzare reazioni specifiche, la ricerca si esegue
dopo aver ricercato/eliminato tutti i possibili IONI INTERFERENTI
L’analisi viene eseguita secondo un ordine preciso
(ANALISI SISTEMATICA)
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
Alcune nozioni di base
Gli ioni vengono separati NON singolarmente ma in GRUPPI, utilizzando proprietà
caratteristiche di un certo numero di ioni rispetto a determinati reattivi,
che vengono denominati REATTIVI DI GRUPPO
Es.:
As, Sb, Sn, Hg, Pb, Bi, Cu, Cd presenti in un’unica soluzione di HCl
H2S
PRECIPITANO COME SOLFURI POCO SOLUBILI
(separazione)
54
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
In questa esperienza si dovrà separare una miscela costituita da un certo numero di cationi
compresi tra i seguenti: NH4+, Ag+, Cu2+, Mn2+, Fe3+ (e Fe2+), Ni2+, Al3+, Zn2+
Analisi sistematica tradizionale (Bunsen, Fresenius)
Se si esclude lo ione NH4+ che viene identificato con una reazione specifica effettuata
direttamente nella soluzione della miscela di sali, gli altri cationi vengono suddivisi in quattro
gruppi e successivamente identificati mediante reazioni selettive
I° gruppo
Cationi che formano CLORURI poco solubili e che precipitano da soluzioni neutre o acide
(HNO3) per trattamento con HCl
Ag+, Hg+, Pb2+, (Tl+)
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
II° gruppo
Cationi che, dopo ELIMINAZIONE del I° gruppo,
reagiscono con H2S formando SOLFURI talmente INSOLUBILI
da precipitare in soluzione molto acida (pH ≤≤ 0.5)
Hg2+, Pb2+, Cu2+, Bi3+, Cd2+, As3+, As5+, Sb5+, Sn2+, Sn4+ (Au, Pt)
III° gruppo
Cationi che, dopo ELIMINAZIONE del I° e del II° gruppo, reagiscono con NH4OH formando
IDROSSIDI poco solubili (in presenza di NH4Cl , cioè in soluzione tamponata a pH 9)
Fe3+, Al3+, Cr3+, (Ti4+), Mn2+ (parzialmente)
(in particolari condizioni anche Co2+, Zn2+)
56
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
IV° gruppo
Cationi che, esclusi quelli del I°, del II° gruppo e del III° gruppo,
non vengono precipitati da H2S a pH < 0.5,
nè da NH4OH/NH4Cl a pH 9,
ma come SOLFURI da H2S a pH > 0.5 (→ pH ≈ 9)
Zn2+, Fe2+, Ni2+,Mn2+
57
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
PROCEDURA SPERIMENTALE DA ESEGUIRE RIGOROSAMENTE IN SEQUENZA
[1] Identificazione dello ione ammonio NH4+
Lo ione NH4+ è stabile in soluzione acida; in soluzione basica si sviluppa ammoniaca gassosa:
NH4+ (aq) + OH-
(aq)
→ NH3
(g)
+ H2O (l)
[2] Precipitazione dei cloruri insolubili
Lo ione Ag+ precipita da una soluzione contenente ioni Cl- come AgCl, sale insolubile bianco:
Ag+(aq) + Cl-(aq) → AgCl (s)
Non si deve operare con un largo eccesso di ioni Cl- per evitare la formazione dello ione
complesso solubile AgCl2-:
AgCl (s) + Cl-(aq) ⇔ AgCl2-
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[3] Identificazione del catione Ag+
Il sale insolubile AgCl si scioglie in soluzione ammoniacale con formazione dello ione
complesso solubile diamminoargento [Ag(NH3)2]+ (trasparente):
AgCl (s) + 2 NH3 (aq) → [Ag(NH3)2]+(aq) + Cl-(aq)
Lo ione [Ag(NH3)2]+ è instabile in soluzione acida; aggiungendo HNO3 alla soluzione
ammoniacale contenente lo ione complesso e gli ioni Cl- si ha la reazione:
[Ag(NH3)2]+(aq) + Cl-(aq) + 2 H3O+(aq) → AgCl (s) + 2 NH4+ (aq) + 2 H2O
AgI è un sale insolubile giallo. A differenza di AgCl, è praticamente insolubile in NH3; per
questo motivo è possibile precipitarlo direttamente dalla soluzione ammoniacale per aggiunta
di ioni I- senza aggiunta di acido:
[Ag(NH3)2]+(aq) + I-(aq) → AgI (s) + 2 NH3 (aq)
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[4] Precipitazione dei solfuri insolubili a pH ≤ 0.5 (CuS)
Il solfuro di Cu2+ è insolubile in soluzioni acide di concentrazione almeno 3 M, pH = 0.5. A pH
≥ 0.5, precipitano i solfuri degli altri cationi. Il controllo del pH è estremamente importante
perché determina la quantità di ione solfuro S2- presente in soluzione. Per la precipitazione
del CuS si utilizza una soluzione acquosa di acido solfidrico H2S, preparata per degradazione
termica in H2O di tioacetammide CH3CSNH2, secondo la reazione:
CH3CSNH2 (s) + 2 H2O(l) ∆ (A ebollizione)→ CH3COO-(aq) + NH4+ (aq) + H2S (aq)
H2S è un gas maleodorante e tossico. Per questo motivo si preferisce generarlo direttamente in
situ per ridurne al minimo la quantità utilizzata (SOTTO CAPPA)
Lo ione solfuro S2- è prodotto dalla dissociazione in acqua di H2S, acido debole diprotico:
H2S (aq) + H2O(l) ⇔ H3O+(aq) + HS- (aq)
K1 = 1.1 x 10-7
HS- (aq) + H2O(l) ⇔ H3O+(aq) + S2- (aq)
K2 = 1.1 x 10-14
PINZA DI LEGNO
Ad alte concentrazioni di H3O+ (basso valore di pH) gli equilibri sono spostati verso sinistra ed in
soluzione vi è una concentrazione di S2- molto bassa. Diminuendo la concentrazione di H3O+ gli
equilibri si spostano verso destra e la concentrazione di S2- in soluzione aumenta.
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
Il solfuro di rame CuS (NERO) precipita già in soluzioni a pH ≤ 0.5 perché è particolarmente
insolubile, e necessita della presenza di una quantità molto piccola di ioni S2- per precipitare.
L’aumento di pH con conseguente aumento di ioni S2- induce la precipitazione dei solfuri degli
altri cationi che sono relativamente più solubili.
[5] Identificazione del catione Cu2+
CuS viene dissolto in HNO3 che ossida lo ione S2- a zolfo elementare S riducendosi ad NO:
3 CuS(s) + 8 HNO3 (aq) → 3 Cu(NO3)2 (aq) + 3 S(s) + 2 NO(g) + 4 H2O(l)
Il catione Cu2+ in soluzione viene complessato da NH3:
Cu2+(aq) + 4 NH3(aq) → [Cu(NH3)4]2+(aq)
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[6] Precipitazione di solfuri insolubili a pH > 0.5
I cationi Mn2+, Ni2+, Zn2+, Fe2+, in soluzione basica contenente ioni S2- danno solfuri insolubili:
Mn2+(aq) + S2- (aq) → MnS (s)
Ni2+ (aq) + S2- (aq) → NiS (s)
Zn2+ (aq) + S2- (aq) → ZnS (s)
Fe2+ (aq) + S2- (aq) → FeS (s)
Il valore del pH della soluzione è determinato dalla coppia NH4+/NH3 (tampone ammoniacale,
pH ≈ 9). A questo pH il catione Al3+ non forma il solfuro ma precipita come idrossido insolubile
Al(OH)3:
Al3+(aq) + 3 OH-(aq) → Al(OH)3 (s)
Il pH deve essere tamponato a questo valore perché a pH più basici Al(OH)3, composto
anfotero, si ridiscioglie come [Al(OH)4]-
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[7] Dissoluzione del precipitato di MnS, NiS, FeS, ZnS e Al(OH)3
I solfuri MnS, FeS, ZnS e l’idrossido Al(OH)3 si sciolgono in acidi forti:
MnS(s) + 2 H+(aq) → Mn2+(aq) + H2S(aq)
FeS(s) + 2 H+(aq) →
Fe2+(aq) + H2S(aq)
ZnS(s) + 2 H+(aq) → Zn2+(aq) + H2S(aq)
Al(OH)3(s) + 3 H+(aq) → Al3+(aq) + 3 H2O(l)
Per sciogliere NiS è necessario un acido ossidante come HNO3:
3 NiS(s) + 8 HNO3(aq) → 3 Ni(NO3)2(aq) + 3 S(s) + 2 NO(g) + 4 H2O(l)
HNO3 ossida anche Fe2+ a Fe3+:
3 Fe2+(aq) + NO3-(aq) + 4 H+(aq) → 3 Fe3+(aq) + NO(g) + 2 H2O(l)
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[8] Separazione dei cationi Mn2+, Ni2+, Fe3+ dai cationi Zn2+ e Al3+
L’addizione della base forte NaOH alla soluzione di dssoluzione dei solfuri (punto [7])
induce la precipitazione degli idrossidi insolubili di Mn2+, Ni2+, Fe2+:
Mn2+(aq) + 2 OH-(aq) → Mn(OH)2 (s)
Ni2+(aq) + 2 OH-(aq) → Ni(OH)2 (s)
Fe3+(aq) + 3 OH-(aq) → Fe(OH)3 (s)
CROGIOLO DI PORCELLANA
Gli idrossidi di Zn2+ e Al3+ non precipitano ma, essendo anfoteri, in presenza di una base
forte formano idrossoalluminati ed idrossozincati solubili:
Al3+(aq) + 3 OH-(aq) → Al(OH)3 (s)
Al(OH)3 (s) + OH-(aq) → [Al(OH)4]- (aq)
Zn2+(aq) + 2 OH-(aq) → Zn(OH)2 (s)
Zn(OH)2 (s) + 2 OH-(aq) → [Zn(OH)4]2- (aq)
PINZA DI FERRO
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[9] Dissoluzione del precipitato di Mn(OH)2, Ni(OH)2, Fe(OH)3
In acido nitrico gli idrossidi si sciolgono secondo le reazioni:
Mn(OH)2(s) + 2 H+(aq) → Mn2+(aq) + 2 H2O(l)
Ni(OH)2(s) + 2 H+(aq) → Ni2+(aq) + 2 H2O(l)
Fe(OH)3(s) + 3 H+(aq) → Fe3+(aq) + 3 H2O(l)
[10] Identificazione del catione Mn2+
Il bismutato di sodio NaBiO3 è un forte ossidante, in grado di ossidare lo ione Mn2+ a
MnO4- secondo la reazione:
2 Mn2+(aq) + 5 BiO3-(aq) + 14 H+(aq) → 2 MnO4-(aq) + 5 Bi3+(aq) + 7 H2O(l)
La scomparsa del colore viola dopo la formazione è dovuta alla presenza di ioni cloruro
Cl- che vengono ossidati dal permanganato.
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[11] Separazione dei cationi Ni2+ e Fe3+
In una soluzione basica precipita Fe(OH)3. In presenza di un eccesso di NH3 il catione
Ni2+ forma il catione esammino complesso solubile:
Ni2+(aq) + 6 NH3(aq) → [Ni(NH3)6]2+(aq) blu
[12] Identificazione del catione Fe3+
Fe(OH)3 si scioglie in acidi. L’aggiunta di ione tiocianato SCN- porta alla formazione del
complesso [Fe(SCN)6]-:
Fe3+(aq) + 6 SCN-(aq) → [Fe(NCS)6]3-(aq) rosso sangue
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[13] Identificazione del catione Ni2+
La dimetilgliossima (H2DMG) è un reagente organico in grado di complessare lo ione Ni2+
come ione dimetilgliossimato (HDMG)-.
[Ni(NH3)6]2+(aq) + 2 H2DMG(aq) → Ni(HDMG)2(s) + 2 NH4+(aq) + 4 NH3(aq)
Lo ione (HDMG)- si forma per reazione acido-base con NH3
CH3
C NOH
NH 3
C
CH3
CH3
C
CH3
NOH
C NOH
NO
-
e si lega allo ione Ni2+ per dare il complesso dal caratteristico color rosa-rosso
OH
CH3
2
CH3
CH3
C NOH
+
C
NO
-
Ni
C
2+
CH3
N
Ni
C
NO
2
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[14] Separazione dei cationi Al3+ e Zn2+
Un eccesso di acido riporta in soluzione come ioni Zn2+ e Al3+ gli alluminati e gli
zincati:
[Al(OH)4]-(aq) + 4 H+(aq) → Al3+(aq) + 4 H2O(l)
[Zn(OH)4]2-(aq) + +4 H+(aq) → Zn2+(aq) + 4 H2O(l)
A pH ≈ 9 in presenza di un eccesso di NH3, Al3+ riprecipita come idrossido insolubile
mentre lo ione Zn2+ forma lo ione complesso tetramminozinco solubile:
Zn2+(aq) + 4 NH3(aq) → [Zn(NH3)4]2+(aq)
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[15] Identificazione del catione Al3+
Il reagente aluminon è un colorante rosso che si adsorbe sulla superficie del precipitato
gelatinoso di Al(OH)3 quando questo riprecipita in ambiente basico dopo l’aggiunta di NH3 alla
soluzione acida dello ione Al3+. La reazione può essere scritta come:
Al3+(aq) + 3 NH3(aq) + 3 H2O(l) + alum.(aq) → Al(OH)3•alum.(s) + 3 NH4+(aq)
L’ aluminon è un sale di ammonio di un acido tricarbossilico (acido aurintricarbossilico):
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
[16] Identificazione del catione Zn2+
La soluzione contenente [Zn(NH3)4]2+ viene acidificata:
[Zn(NH3)4]2+(aq)
+ 4 H+(aq) → 4 NH4+(aq) + Zn2+(aq)
e ad essa viene aggiunto K4Fe(CN)6 che forma il complesso verde chiaro K2Zn3[Fe(CN)6]2
secondo la reazione:
3 Zn2+(aq) + 2 K4Fe(CN)6(aq) → K2Zn3[Fe(CN)6]2(s) + 6 K+(aq)
La reazione globale dei due processi è data da:
3 [Zn(NH3)4]2+(aq) + 2 K4Fe(CN)6(aq) + 12 H+(aq) →
→ K2Zn3[Fe(CN)6]2(s) + 12 NH4+(aq) + 6 K+(aq)
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
Alcune nozioni di base
ANCORA QUALCHE INFO SULLA PRECIPITAZIONE
DIGESTIONE
DI UN
PRECIPITATO
LEGGE DI STOKES
Esperienza 8: ANALISI QUALITATIVA: IDENTIFICAZIONE DI CATIONI
Alcune nozioni di base
CENTRIFUGAZIONE