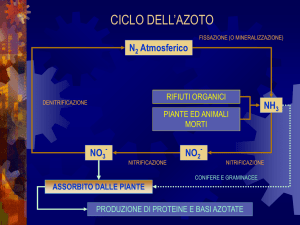
COMPLESSOMETRIA
Alcuni atomi o ioni di metalli (specialmente gli ioni dei metalli di transizione) possono
agire da acidi di Lewis ed unirsi con legami covalenti polari ad atomi, molecole o ioni
aventi almeno un doppietto elettronico non condiviso. Il prodotto di una tale reazione di
addizione è detto composto di coordinazione o complesso. Ad esempio:
NH3
Cu++
+
4 :NH3
NH3
Cu
NH3
acido di Lewis
base di Lewis
NH3
complesso cupritetrammino
In un complesso si può distinguere un atomo centrale circondato da atomi o gruppi di
atomi detti leganti.
Il numero dei doppietti elettronici impegnati nella formazione di un complesso prende il
nome di numero di coordinazione.
Condizione fondamentale per l’applicazione all’analisi dei metodi complessometrici è
che risulti esattamente definito il rapporto di reazione tra lo ione coordinante e le specie
coordinate. Così, ad esempio, non può essere utilizzata la reazione tra Cu++ e NH3 , in
quanto i complessi amminici del Cu++ possono distribuirsi in una serie di composti a
contenuto diverso di NH3 : Cu(NH3) ++ , Cu(NH3 )2++ , ecc; ugualmente si verifica
per il Fe3+ con ioni CNS- dove il numero di ioni coordinati solfocianuro CNS- può
variare da 1 a 6.
Una delle applicazioni più note è il dosaggio del CN- con Ag+ per formazione del
complesso Ag(CN)2 - (metodo di Liebig), in cui il punto di equivalenza può essere
individuato dalla formazione di Ag Ag(CN)2 poco stabile, o meglio di AgI secondo il
perfezionamento apportato al metodo da Deniges.
Generalizzando una reazione di complessazione si può scrivere come:
A + nB
Dove n = 1,2,3….
ABn
e la specie B può presentare uno o più doppietti solitari.
In accordo con la legge di azione di massa, la costante che regola l’equilibrio è detta
costante di stabilità del complesso:
Kstab =
ABn
A Bn
mentre l’inverso prende il nome di costante di instabilità del complesso:
Kinst = 1
= A Bn
Kstab
ABn
E’ da osservare che l’equilibrio è in realtà costituito da più stadi; cioè, i leganti vengono
coordinati in stadi successivi.
A + B
AB
K1
AB + B
AB2
K2
ABn-1 + B
ABn
Kn
Pertanto, Kstab ha il significato di una costante di equilibrio “globale”, essa è uguale al
prodotto delle costanti di equilibrio dei singoli stadi.
Un complessante di notevole importanza analitica appartiene al gruppo degli acidi
amminocarbossilici ed è l’acido etilendiamminotetracetico EDTA.
L’acido amminopolicarbossilico ha la caratteristica di determinare la formazione di
complessi chelati, cioè di composti in cui lo ione metallico si lega con legame
coordinato all’azoto e con legame ionico ai carbossili, dando origine ad anelli
pentatomici molto stabili.
HOOC-CH2
CH2 -COOH
N-CH2-CH2 -N
HOOC-CH2
CH2 –COOH
INDICATORI METALLOCROMICI hanno la proprietà di formare complessi chelati,
con i cationi in esame, meno stabili dei corrispondenti complessi Me-EDTA. Il
complesso ha un colore diverso da quello dell’indicatore libero e la variazione
cromatica della soluzione permetterà di individuare il punto in cui l’EDTA ha
complessato quantitativamente il metallo sottraendolo al sistema metallo-indicatore
(viraggio).