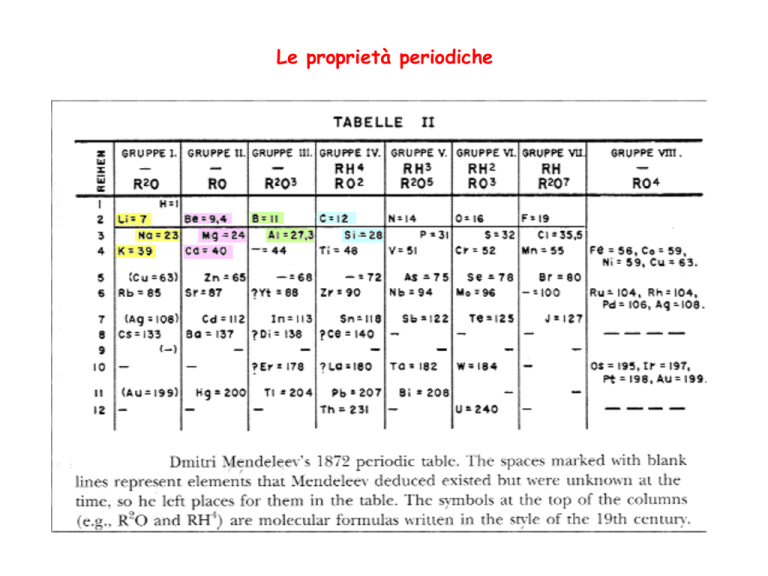
Le proprietà periodiche
Le proprietà degli elementi dipendono dalla configurazione elettronica esterna.
PERIODO
GRUPPO
Le proprietà periodiche
ENERGIA DI IONIZZAZIONE
L’energia minima che occorre fornire ad un atomo isolato gassoso
per toglierli un elettrone:
A
A + + e-
A+
A2+ + e-
A2+
A3+ + e-
H: 1s1
Li: 1s2 2s1
He: 1s2
Be: 1s2 2s2
Na: 1s2 2s2 2p63s1
L’aumento
che
si
osserva passando da Li
a Ne è spiegabile
considerando che gli
elettroni di uno stesso
livello
risentonaro,
all’aumente del numero
atomico,
di
una
maggiore
carica
nucleare e quindi sono
più attratti dal nucleo.
B: 1s2 2s2 2p1
C: 1s2 2s2 2p2
N: 1s2 2s2 2p3
O: 1s2 2s2 2p4
F: 1s2 2s2 2p5
Ne: 1s2 2s2 2p6
Terminato un periodo, l’elettrone in più
dell’elemento successivo si dispone in uno
strato più esterno e viene schermato dalla
carica nucleare dal “guscio” di elettroni
dello strato più interno completamente
riempito.
Le proprietà periodiche
AFFINITA’ ELETTRONICA
L’affinità elettronica è l’energia che viene liberata quando un atomo isolato addiziona un
elettrone:
A + e- AL’affinità elettronica può avere segno negativo se il processo assorbe energia o
positivo se rilascia energia. L’affinità elettronica misura la tendenza di un atomo ad
acquistare un elettrone ed è anch’essa una proprietà periodica.
Le proprietà periodiche
DIMENSIONI ATOMICHE
• I cationi sono sempre più piccoli dei corrispondenti atomi
• Gli anioni sono sempre più grandi dei corrispondenti atomi
• Gli elementi a sinistra perdono elettroni (bassa energia di
ionizzazione)
• Gli elementi a destra acquistano elettroni (alta affinità
elettronica)
Slater ha proposto, partendo dalle distanze tra gli atomi nelle sostanze
elementari e nei composti, dei valori per i raggi atomici tali che la somma dei
raggi dia le distanze tra i nuclei.
- Tabelle di raggi atomici (raggi di Slater) costruite sulla base delle
distanze interatomiche nelle sostanze elementari allo stato solido
(esperimenti di diffrazione)
- Diminuiscono lungo un periodo da sinistra a destra – cresce Z mentre
l’effetto di schermo rimane quasi costante
- Crescono scendendo lungo un gruppo – cresce Z, ma cresce molto
anche l’effetto di schermo
- Eccezione: rimangono costanti o diminuiscono passando dagli elementi
4d ai 5d (prima serie di transizione interna – lantanidi)