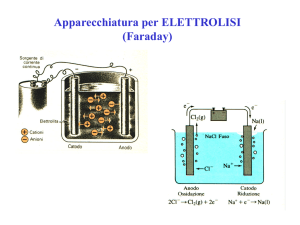
a
c
i
m
i
h
c
:
4
e
s
s
a
l
C
a
c
i
m
o
t
A
a
r
u
t
t
u
r
t
S
1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton),
particelle subatomiche, protone, neutrone, elettronie, nucleo.
2. Decidi se tra le seguenti coppie di particelle dal punto di vista elettrico c'è attrazione,
repulsione, oppure né attrazione né repulsione:
a. elettrone – elettrone
b. elettrone – protone
c. neutrone – protone
d. protone – protone
e. neutrone – neutrone
f. neutrone – elettrone
3. Controlla se sai definire i seguenti termini: numero atomico, numero di massa, isotopi,
simboli degli isotopi.
4. Un atomo ha 20 neutroni e 17 protoni.
a. Qual è il numero atomico dell'atomo?
b. Che atomo è?
c. Qual è il numero di massa?
d. Quanti elettroni sono presenti nell'atomo neutro?
e. Quale carica possiede il nucleo di questo atomo?
f. Quale carica possiedono complessivamente gli elettroni dell'atomo neutro?
5. Quanti protoni, neutroni ed elettroni sono presenti in un atomo neutro rappresentato dal
63 Cu
seguente simbolo: 29
?
6. Scrivi il simbolo dell'isotopo del carbonio con 8 neutroni.
7. Un primo atomo ha numero di massa 214 e numero atomico 84; un secondo atomo ha numero
di massa 214 e numero atomico 82. I due atomi sono isotopi tra di loro?
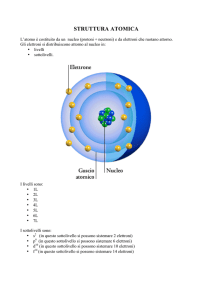
8. Controlla se sai definire i seguenti termini: principio di indeterminazione di Heisenberg,
orbitale, numeri quantici, numero quantico principale, numero quantico secondario, numero
quantico magnetico, numero quantico di spin, principio di esclusione di Pauli, sottolivelli.
9. Che cosa hanno di uguale e che cosa hanno di diverso:
a. un orbitale 1s e un orbitare 2s
b. un orbitale 2s e un orbitale 2p
10. È corretto dire che quando n = 2 si hanno orbitali 2s, 2p e 2d?
11. Disponi i sottolivelli del livello con n = 3 per energia crescente
12. Controlla se sai enunciare il principio dell'Aufbau e il principio di Hund e se sai definire il
termine: configurazione elettronica.
13. Mostra come gli elementi seguenti dispongono i propri elettroni negli orbitali; utilizza i
diagrammi con i quadratini e le frecce per indicare lo spin:
a. azoto
b. ossigeno
c. magnesio
14. Scrivi la configurazione elettronica di:
a. fosforo
b. idrogeno
c. fluoro
15. Scrivi la configurazione elettronica di:
a. argo
b. arsenico
c. calcio
16. Quali elemtni hanno le seguenti configurazioni elettroniche?
a.
1s2 2s2 2p6 3s2 3p6 4s2 3d8
b.
1s2 2s2 2p6 3s2 3p5
c.
1s2 2s2 2p6 3s2 3p6 4s1
17. In tutte le seguenti configurazioni elettroniche è presente un errore. Quale?
a.
1s2 2s6 2p6 3s2 3p6
b.
1s2 2s2 2p6 3s2 3p6 4s2 4p3
c.
1s2 1p6 2s2 2p6 3s2 3p6 4s2
a
c
i
m
i
h
c
:
4
e
s
s
a
l
C
a
c
i
d
o
i
r
e
p
a
l
o
v
a
T
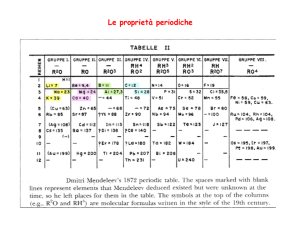
1. Controlla se sai definire i seguenti termini: comportamento periodico, tavola periodica,
periodi, gruppi, gruppi principali, elementi di transizione, metalli alcalini, metalli alcalino
terrosi, alogeni, gas nobili.
2. Perchè il terzo periodo comprende 8 elementi e il quarto 18?
3. Indica in quali orbitai dispongono i loro ultimi elettroni:
a. i metalli alcalini
b. gli alogeni
c. i tmetalli alcalino terrosi
d. i gas nobili
4. Decidi a quali elementi corrispondono le seguenti configurazioni elettroniche abbreviate:
a.
[Ne] 3s2
b.
[He] 2s2 2p1
c.
[Ar] 4s2 3d5
d.
[Kr] 5s2 4d10 5p2
e.
[Xe] 6s1
5. Alcune delle seguenti configurazioni sono corrette e altre errate; per quelle corrette decidi
qual è l'elemento corrispondente, per quelle errate spiega in che cosa consiste l'errore:
a.
[He] 2s2 2p3
b.
[Ar] 3s2
c.
[Ne] 3s2 3p6 4s1
d.
[Xe] 6s2
6. Quanti elettorni esterni possiedono i seguenti elementi?
a. Cl
b. O
c. Al
d. K
e. P
7. Indica quanti elettroni hanno:
a. i metalli alcalini
b. i metalli alcalino-terrosi
c. gli alogeni
d. i gas nobili
8. Scrivi i simboli di Lewis degli elementi del terzo periodo.
9. Controlla se sai definire i seguenti termini: proprietà periodiche, raggio atomico, energia di
prima ionizzazione, ione positivo o catione, ione negativo o anione, affinità elettronica,
elettronegatività, carattere metallico, metallo, non metallo, semimetallo.
10. Elenca le proprietà periodiche.
11. Anche il numero di elettroni esterni può essere considerato una proprietà periodica?
12. Perchè l'energia di prima ionizzazione aumenta nei periodi e diminuisce nei gruppi?
13. Scrivi la condigurazione elettronica completa degli ioni seguenti:
a.
O2-
b.
K+
c.
Cl-
d.
Mg2+
14. Decidi a quali ioni corrisponde ognuna delle seguenti descrizioni:
a.
ione con carica +2 e configurazione elettronica 1s2 2s2 2p6 3s2 3p6
b.
ione con carica -2 e configurazione eletronica 1s2 2s2 2p6 3s2 3p6
c.
ione con carica +3 e condigurazione elettronica 1s2 2s2 2p6
d.
ione con carica +1 e condfigurazione elettronica 1s2
15. In ognuna delle coppie seguenti indica l'atomo con dimensioni maggiori:
a. Li, Be
b. Li, Na
c. O, S
d. S, Cl
16. Quale tra i seguenti atomi ha le dimensioni maggiori: P, As, S, Se?
17. In ognuna delle coppie seguenti indica l'atomo con la maggiore energia di prima ionizzazione:
a. Na, Mg
b. Na, K
c. B, C
d. C, Si
18. In ognuna delle coppi eseguenti indica l'atomo con la maggiore affinità elettronica:
a. F, O
b. F, Cl
c. O, S
d. O, N
19. Scrivi nello spazio tratteggiato a quale gruppo appartiene ognu ocnfigurazione elettronica
esterna.
a. s1..................................................
b. s2 p6..................................................
c. s2 p5..................................................
d. s2..................................................
20. Scrivi le configurazioni elettroniche abbreviate degli elementi seguenti.
a. Li..................................................
b. F..................................................
c. Al..................................................
d. S..................................................
21. Che cosa hanno in comune lo ione Na+ e il Neon?
a. il numero di elettroni
b. il numero di protoni
c. il numero atomico
d. il numero di neutroni
22. Quanti elettroni possiedono gli ioni F-, O2-, Ba2+, H+?
a. 10, 10, 54, 0
b. 9, 8, 56, 1
c. 8, 6, 58, 2
d. 10, 7, 55, 0
23. Quali sono gli atomi neutri e ioni che possiedono 18 elettroni?
a.
Ar, Cl+, S2+, K-, Ca2-
b.
Ar, Cl2-, S-, K+, Ca+
c.
Ar, Cl-, S2-, K2+, Ca2+
d.
Ar, Cl-, S2-, K+, Ca2+
24. Rispetto al magnesio, l'alluminio:
a. è più grande e ha energia di ionizzazione maggiore
b. è più piccolo e ha energia di ionizzazione minore
c. è più grande e ha energia ionizzazione minore
d. è più piccolo e ha energia di ionizzazione maggiore