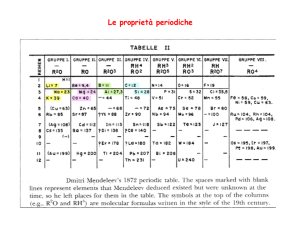
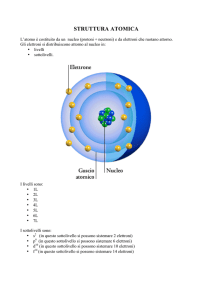
Il sistema periodico
Mendeleev,
1869
Ordinò gli
elementi allora
noti in
funzione delle
loro masse
atomiche
crescenti e
notò che le
loro proprietà
erano
«periodiche»
cioè si
ripetevano ad
intervalli
regolari.
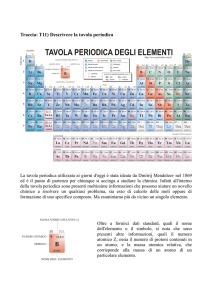
La tavola periodica moderna
Gli elementi sono disposti secondo il loro numero atomico crescente
La tavola periodica moderna
Gli elementi vengono incasellati in 8 colonne verticali dette
gruppi e in 7 file orizzontali dette periodi.
La tavola periodica moderna
I 7 periodi corrispondo ai 7 livelli energetici possibili per cui:
• il 1° periodo corrisponde al 1° livello energetico che potrà
contenere al max 2 elementi
H
1s1
He
1s2
La tavola periodica moderna
• il 2° periodo corrisponde al 2° livello energetico che potrà
contenere al max 8 elementi (dal Li al Ne) perchè 8 sono
gli e- max possibili nel secondo livello.
Li
1s2
2s1
Ne
1s2 2s2 2p6
La tavola periodica moderna
• il 3° periodo corrisponde al 3° livello energetico che potrà
contenere al max 18 elementi, ma in realtà ne troviamo
solo 8 perchè l’orbitale 3d abbiamo visto che viene
riempito dopo il 4s quindi lo troveremo nel 4° periodo.
Gli elementi vanno dal Na all’Ar
Na
1s2 2s2 2p6 3s1
Ar
1s2 2s2 2p6 3s2 3p6
La tavola periodica moderna
Gli elementi che riempiono gli orbitali 3d, 4d, 5d e 6d
prendono il nome di elementi o metalli di transizione.
La tavola periodica moderna
Allo stesso modo, quelli che riempiono i sottolivelli 4f e 5f
costituiscono 2 serie di 14 elementi che prendono il nome
rispettivamente di lantanidi e attinidi.
GRUPPI
I
II
VIII
III IV V VI VII
Per quanto riguarda i gruppi (colonne verticali) questi sono 8
(escludendo i metalli di transizione).
Proviamo per esempio a confrontare la
configurazione
elettronica
di
elementi
appartenenti allo stesso gruppo.
I
II
III
...
VIII
H = 1s1
Be = 1s2 2s2
B = 1s2 2s22p1
He = = 1s2
Li = 1s2 2s1
Mg = 1s2 2s22p6 3s2
Al = 1s2 2s22p6 3s23p1
Ne = = 1s2 2s22p6
Na = 1s2 2s22p6 3s1
Ca = 1s2 2s22p6 3s23p6 4s2 Ga = 1s2 2s22p6 3s23p6 4s24p1
Ar = = 1s2 2s22p6 3s23p6
GRUPPI
•
•
•
•
•
•
•
•
I metalli alcalini
II metalli alcalino-terrosi
III metalli terrosi
IV gruppo del C
V gruppo dell’N
VI gruppo dell’O
VII alogeni
VIII gas nobili
Ricapitolando....
Ogni nuovo periodo inizia con un elemento che ha un solo ein un nuovo livello di energia.
Gli elementi appartenenti allo stesso periodo hanno gli
elettroni più esterni in quel livello energetico.
Gli elementi che appartengono allo stesso gruppo possiedono lo
stesso numero di e- nel livello più esterno, elettroni di
valenza, dai quali dipendono le proprietà chimiche di un atomo
ovvero la reattività.
Es. tutti i metalli alcalini reagiscono violentemente con
l’acqua.
https://www.youtube.com/watch?v=0FYibWQkEMU
Notazione di Lewis
Provando a rappresentare gli elementi circondati da tanti
puntini quanti sono gli e- di valenza, notiamo che sono
corrispondenti al gruppo di appartenenza nella tavola periodica
(fa eccezione l’He).
Le proprietà periodiche
Grazie alla tavola periodica moderna è più intuitivo
comprendere come le configurazioni elettroniche esterne si
ripetano periodicamente.
Dalla configurazione elettronica dipendono le proprietà
chimiche degli elementi che sono anch’esse periodiche e sono:
1. Raggio atomico
2. Energia di ionizzazione
3. Affinità elettronica
4. Elettronegatività
Raggio atomico
E’ la distanza tra il nucleo e l’e- più esterno.
↑ gruppo
↓ periodo
Energia di ionizzazione
E’ l’energia che bisogna fornire ad un atomo per strappare
via l’e- più esterno trasformandolo in ione positivo; esprime
quindi la tendenza di un atomo a perdere e-.
A + energia A+ + e- (energia di I ionizzazione)
A+ + energia A2+ + e- (energia di II ionizzazione)
↑ periodo
↓ gruppo
A+ = catione
Affinità elettronica
E’ l’energia che si libera quando un atomo neutro acquista un
e- quindi esprime la tendenza di un atomo ad acquistare e-.
A + e- A- + E
↑ periodo
↓ gruppo
A- = anione
Elettronegatività
E’ una proprietà che unisce energia di ionizzazione e affinità
elettronica ed è tipica solo degli atomi allo stato combinato
cioè impegnati in un legame.
Può assumere valori da un minimo di 0,7 del Fr ad un max
di 4 del F.
↑ periodo
↓ gruppo
Elettronegatività
Questa proprietà indica la capacità di un atomo di attrarre a
sé gli e- condivisi nel legame con un altro atomo.
Es. nel legame H-F, sarà il F ad attrarre maggiormente gli edi legame poiché ha elettronegatività massima (4).
Proprietà metalliche
Mostrano proprietà metalliche tutti gli elementi che hanno
bassa elettronegatività quindi che tendono a cedere e-.
Mostrano proprietà non metalliche quelli che presentano elevata
elettronegatività quindi tendenza ad acquistare e-.
Per casa
• Studiare capitolo 9
• PROVA TU pag 154
• Es. pag 165 n° 5-6-7-8-13-17-18-32-33-37
• Es. pag 167 n° 5
• Tutti gli es. pag 168