Programmazione didattica annuale
anno scolastico 2016/2017
Docente prof.ssa di Caprio Angela Maria
Materia di insegnamento: Scienze naturali
Classe : 4B
Risultati di apprendimento in termini di Competenze
➜ spiegare le caratteristiche macroscopiche delle trasformazioni fisiche e chimiche mediante il
modello cinetico molecolare della materia. Usare la mole come unità di misura della quantità di
sostanza
➜ descrivere la natura delle particelle elementari che compongono l’atomo. Spiegare la struttura
elettronica a livelli di energia dell’atomo.
➜ identificare gli elementi attraverso le loro proprietà periodiche.
➜ Utilizzare il modello a orbitali dell’atomo. Spiegare perché gli atomi si legano assieme e i vari
modi in cui possono farlo.
➜ Utilizzare le formule dei composti inorganici per classificarli secondo le regole della
nomenclatura sistemica e tradizionale. Effettuare calcoli stechiometrici. Classificare le principali
reazioni chimiche.
➜ utilizzare le grandezze termodinamiche per descrivere le variazioni di energia dei sistemi
chimici. Descrivere i fattori che influenzano la velocità di una reazione. Spiegare le proprietà dei
sistemi chimici all’equilibrio
➜Spiegare le proprietà di acidi e basi. Identificare e bilanciare le reazioni di ossido riduzione
➜ Riconoscere i diversi tipi di rocce. Collegare i movimenti endogeni della Terra ai fenomeni
sismici e vulcanici
Modulo1
Spiegare il visibile con l’invisibile. Lavorare con gli atomi: la mole
abilità
Spiegare le caratteristiche
macroscopiche e microscopiche
delle principali trasformazioni
fisiche. Utilizzare il modello
cinetico-molecolare per
interpretare le trasformazioni
chimiche e fisiche. Calcolare la
massa molare di una sostanza.
Calcolare il numero di moli di
un campione. Ricavare la
formula di un composto
conoscenze
Definire le tre leggi ponderali
della chimica. Descrivere il
modello atomico di Dalton.
Massa atomica e massa
molecolare. Definizione di
mole. Numero di Avogadro.
Formula chimica
scansione temporale
Da metà settembre a metà
ottobre
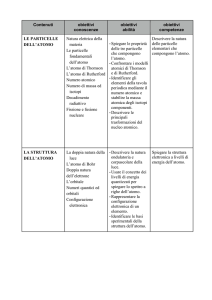
Modulo 2
Le particelle dell’atomo. L’atomo e i livelli di energia. Il sistema periodico. Il modello ad
orbitali.
abilità
Spiegare le proprietà delle tre
particelle che compongono
l’atomo. Comparare i modelli
atomici di Thomson e
Rutherford. Identificare gli
elementi mediante il numero
atomico e determinare la massa
atomica dagli isotopi
componenti. Descrivere le
principali trasformazioni del
nucleo atomico. Usare il
concetto di livelli di energia
quantizzati per spiegare lo
spettro a righe dell’atomo di
idrogeno. Rappresentare la
configurazione elettronica di un
elemento. Spiegare la relazione
tra struttura elettronica e
posizione degli elementi
all’interno della tavola
periodica. Descrivere le
principali proprietà periodiche
che confermano la struttura a
strati dell’atomo. Applicare il
concetto di orbitale al modello
atomico. Descrivere l’ordine di
riempimento degli orbitali.
conoscenze
scansione temporale
Natura elettrica della materia. le Da metà ottobre a metà
particelle elementari. I modelli novembre
atomici di Thomson e
Rutherford. Numero atomico,
numero di massa e isotopi. Il
nucleo dell’atomo e le sue
trasformazioni. La doppia
natura della luce. L’atomo di
Bohr. La configurazione
elettronica degli elementi. La
tavola periodica e le proprietà
periodiche. Principio di
indeterminazione. Concetto di
orbitale. Ordine di riempimento
degli orbitali.
Modulo 3
Legami chimici. La forma delle molecole. le soluzioni. Nomenclatura. Reazioni chimiche
abilità
Spiegare le proprietà osservabili
della materia sulla base della
sua struttura microscopica.
Comparare i diversi legami
chimici. Determinare la polarità
dei legami covalenti sulla base
delle differenze di
elettronegatività. Determinare
la geometria e la polarità delle
conoscenze
scansione temporale
Legami chimici e regola
Mese di dicembre
dell’ottetto. Concetto di
valenza. Il legame covalente. Il
legame ionico. Il legame dativo.
Il legame metallico. La teoria
del legame di valenza.
Ibridazione e geometria delle
molecole. La forma delle
molecole. Forze
molecole secondo il modello
VSEPR. Confrontare le forze di
attrazione interatomiche con le
forze intermolecolari.
Classificare i solidi in base alle
interazioni fra atomi e fra le
molecole. Spiegare la
formazione di soluzioni liquide,
solide e gassose. Preparare
soluzioni a concentrazione nota.
Descrivere le proprietà
colligative delle soluzioni.
intermolecolari. La
classificazione dei solidi.
Alcune proprietà intensive dei
liquidi. Le proprietà delle
soluzioni. La concentrazione
delle soluzioni. Proprietà
colligative delle soluzioni.
Pressione osmotica. Il numero
di ossidazione. Nomenclatura.
Classificazione delle reazioni
chimiche.
Modulo 4
I gas
abilità
Sapere interpretare le proprietà
fisiche dei gas mediante il
modello cinetico-molecolare.
Sapere descrivere l'effetto della
temperatura e del numero di
particelle sulla pressione e sul
volume di un gas. Correlare la
densità dei gas al volume
molare e alla massa molare.
Usare l'equazione generale per
il calcolo del volume molare e
delle altre variabili dei gas
conoscenze
scansione temporale
Proprietà generali dei gas. La
Mese di gennaio
teoria cinetico-molecolare.
Misurare la pressione dei gas.
Pressione, numero di molecole
e temperatura. La legge di
Boyle. La legge di Charles. La
legge di Gay-Lussac. La legge
combinata dei gas. La legge di
Dalton. La legge di Avogadro.
Relazioni tra moli, massa e
volume dei gas. La densità dei
gas. L'equazione di stato dei gas
ideali. Calcoli stechiometrici. I
gas reali
Modulo 5
L'energia, le reazioni e l'equilibrio
abilità
Utilizzare le grandezze
termodinamiche per descrivere
le variazioni di energia dei
sistemi chimici. Prevedere la
spontaneità di una
trasformazione conoscendo le
variazioni di entalpia ed
entropia. Descrivere i fattori
che influenzano la velocità di
una reazione. Spiegare le
conoscenze
scansione temporale
Reazioni esotermiche ed
Da febbraio a metà marzo
endotermiche. Primo principio
della termodinamica. Calori di
reazioni ed entalpia. L'entropia.
L'energia libera. La velocità di
una reazione. La teoria degli
urti e quella dello stato di
transizione. I fattori che
influenzano la velocità di una
reazione. L'equilibrio chimico.
proprietà dei sistemi chimici
all'equilibrio. Calcolare la
costante di equilibrio di una
reazione dai valori delle
concentrazioni. Valutare il
grado di completezza di una
reazione per mezzo della
costante di equilibrio. Sapere
applicare il principio di Le
Chatelier
Costante di equilibrio. Il
principio di le Chatelier.
Modulo 6
Il trasferimento di protoni ed elettroni
abilità
Spiegare le proprietà di acidi e
basi. Descrivere l'equilibrio
acido base in una soluzione
acquosa. Calcolare il pH delle
soluzioni acquose. Descrivere il
comportamento dei sali e dei
tamponi nelle soluzioni
acquose. Calcolare il numero di
ossidazione egli atomi.
Descrivere le reazioni di ossido
riduzione. Bilanciare le reazioni
di ossido riduzione. Descrivere
la pila di Daniel. Applicare le
leggi di Faraday ai processi
elettrochimici.
conoscenze
scansione temporale
Le teorie sugli acidi e le basi.
Da metà marzo fino alla fine
La ionizzazione dell'acqua. Il
del secondo quadrimestre
pH. La forza degli acidi e delle
basi. La neutralizzazione. Le
soluzioni tampone Il numero di
ossidazione. L'ossidazione el a
riduzione. Bilanciamento delle
reazioni di ossido riduzione.
Reazioni spontanee e non
spontanee. Le pile. La scala dei
potenziali normali di riduzione.
La cella elettrolitica. Le leggi di
Faraday
Metodologia: Strategie educative, strumenti e tecniche di lavoro, attività di laboratorio,
attività di progetto.
Nello studio, strumento indispensabile di riferimento sarà il libro di testo. Questo potrà essere
integrato con appunti del docente o con materiale scaricato da internet ( mappe, immagini, filmati) ;
la lezione sarà principalmente di tipo frontale ma dialogata per stimolare gli studenti al confronto
educativo, si prevede l’utilizzo del laboratorio di scienze con frequenza diversa nel corso dell’anno
( da settimanale a bisettimanale) in relazione agli argomenti svolti. Per i progetti nelle classi quarte
si fa riferimento alle attività programmate e votate in sede di collegio docenti.
Strumenti e metodologie per la valutazione delle conoscenze e delle abilità e per il giudizio di
competenza.
Le verifiche di scienze naturali sono di natura orale e scritta anche se il voto è unico;le verifiche
pertanto saranno in numero di tre, tra scritto e orale, nel primo trimestre ed di quattro nel secondo
quadrimestre. Un momento di crescita importante sarà rappresentato dall’autovalutazione, gli alunni
saranno invitati a valutare con l’attribuzione motivata di un voto le loro prestazioni; qualora il voto
del docente non dovesse concordare con quello espresso dall’alunno sarà compito del primo
spiegare il perché della discordanza Le valutazioni saranno attribuite tenendo conto della seguente
griglia di valutazione: voto 1 consegna in bianco o rifiuto verifica orale
voto 2-3 insufficienza gravissima: nessuna elaborazione, disimpegno
voto 4 gravemente insufficiente: scarso impegno, scarsa capacità logica e di sintesi
voto 5 insufficiente: conoscenza frammentaria, sintesi parziale
voto 6 sufficiente: conoscenza completa ma non approfondita
voto 7 discreto: conoscenza completa, discreta abilità di analisi
voto 8 buono: conoscenza completa e coordinata, esposizione chiara e precisa
voto 9 ottimo: impegno adeguato ed approfondito, sintesi originale e rigorosa, esposizione ricca
voto 10 eccellente: ottimo impegno che va al di là delle argomentazioni affrontate.
Attività di supporto ed integrazione. Iniziative di recupero Le attività di recupero saranno svolte in
itinere. Nel caso di argomenti particolarmente ostici, la programmazione verrà rallentata fino al
superamento dei problemi di comprensione da parte degli alunni. Sarà sempre data la possibilità,
agli alunni che presentano valutazioni insufficienti, di recuperare concordando con il docente i modi
e i tempi del recupero stesso.
Savignano,30/10/2016
La docente
Angela Maria di Caprio