Programmazione didattica annuale
anno scolastico 2014/2015
Docente prof.ssa di Caprio Angela Maria
Materia di insegnamento: Scienze naturali
Classe : 4A
Risultati di apprendimento in termini di Competenze
➜ spiegare le caratteristiche macroscopiche delle trasformazioni fisiche e chimiche mediante il modello
cinetico molecolare della materia. Usare la mole come unità di misura della quantità di sostanza
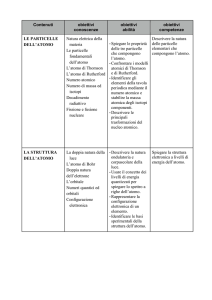
➜ descrivere la natura delle particelle elementari che compongono l’atomo. Spiegare la struttura
elettronica a livelli di energia dell’atomo.
➜ identificare gli elementi attraverso le loro proporietà periodiche.
➜ Utilizzare il modello a orbitali dell’atomo.Spiegare perché gli atomi si legano assieme e i vari modi in
cui possono farlo.
➜ Utilizzare le formule dei composti inorganici per classificarli secondo le regole della nomenclatura
sistemica e tradizionale.Effettusare calcoli stechiometrici. Classificare le principali reazioni chimiche.
➜ utilizzare le grandezze termodinamiche per descrivere le variazioni di energia dei sistemi chimici.
Descrivere i fattori che influenzano la velocità di una reazione. Spiegare le proprietà dei sistemi chimici
all’equilibrio
➜Spiegare le proprietà di acidi e basi. Identificare e bilanciare le reazioni di ossido riduzione
➜ Riconoscere i diversi tipi di rocce.Collegare i movimenti endogeni della Terra ai fenomeni sismici e
vulcanici
Spiegare il visibile con l’invisibile. Lavorare con gli atomi: la mole
abilità
conoscenze
Spiegare le caratteristiche
macroscopiche e microscopiche
delle principali trasformazioni
fisiche. Utilizzare il modello
cinetico-molecolare per
interpretare le trasformazioni
chimiche e fisiche. Calcolare la
massa molare di una sostanza.
Calcolare il numero di moli
di un campione. Ricavare la
Definire le tre leggi ponderali
della chimica.Descrivere il
modello atomico di Dalton.
Massa atomica e massa
molecolare.Definizione di mole.
Numero di Avogadro. Formula
chimica
scansione temporale
Dall’inizio dell’anno scolastico
alla prima settimana di ottobre.
(Molti argomenti sono già stati
trattati l’anno scorso)
formula di un composto
Le particelle dell’atomo. L’atomo e i livelli di energia. Il sistema periodico. Il modello ad orbitali.
abilità
Spiegare le proprietà delle tre
particelle che compongono
l’atomo. Comparare i modelli
atomici di Thomson e
Rutherford. Identificare gli
elementi mediante il numero
atomico e determinare la massa
atomica dagli isotopi
componenti. Descrivere le
principali trasformazioni del
nucleo atomico.Usare il
concetto di livelli di energia
quantizzati per spiegare lo
spettro a righe dell’atomo di
idrogeno. Rappresentare la
configurazione elettronica di un
elemento.Spiegare la relazione
tra struttura elettronica e
posizione degli elementi
all’interno della tavola
periodica. Descrivere le
principali proprietà periodiche
che confermano la struttuar a
strati dell’atomo.Applicare il
concetto di orbitale al modello
atomico. Descrivere l’ordine di
riempimentoi degli orbitali.
conoscenze
scansione temporale
Natura elettrica della materia.
dalla seconda settimana di
le particelle elementari. I
ottobre alla prima settimana di
modelli atomici di Thomson e
novembre.
Rutherford. Numero atomico,
mnumero di massa e isotopi.
Il nucleo dell’atomo e le sue
trasformazioni. La doppia natura
della luce. L’atomo di Bohr. La
configurazione elettronica degli
elementi. La tavola periodica e
le proprietà periodiche. Principio
di indeterminazione. Concetto di
orbitale. Ordine di riempimento
degli orbitali.
Legami chimici. La forma delle molecole. le soluzioni. Nomenclatura. Reazioni chimiche
abilità
conoscenze
Spiegare le proprietà osservabili
della materia sulla base della
sua struttura microscopica.
Comparare i diversi legami
chimici. Determinare la
polarità dei legami covalenti
sulla base delle differenze di
elettronegatività. Determinare
la geometria e la polarità delle
Legami chimici e regola
dell’ottetto. Concetto di
valenza. Il legame covalente.
Il legame ionico. Il legame
dativo. Il legame metallico. La
teoria del legame di valenza.
Ibridazione e geometria delle
molecole.La forma delle
molecole. Forze intermolecolari.
scansione temporale
dalla seconda settimana di
novembre alla fine del primo
quadrimestre
molecole secondo il modello
VSEPR.Confrontare le forze
di attrazione interatomiche
con le forze intermolecolari.
Classificare i solidi in base
alle interazioni fra atomi e
fra le molecole. Spiegare la
formazione di soluzioni liquide,
solide e gassose. Preparare
soluzioni a concentrazione
nota. Descrivere le proprietà
colligative delle soluzioni.
La classificazione dei
solidi.Alcune proprietà intensive
dei liquidi. Le proprietà delle
soluzioni. La concentrazione
delle soluzioni.Proprietà
colligative delle soluzioni.
Pressione osmotica. Il
numero di ossidazione.
Nomenclatura.Classificazione
delle reazioni chimiche.
Metodologia: Strategie educative, strumenti e tecniche di lavoro, attività di laboratorio, attività di progetto.
Nello studio, strumento indispensabile di riferimento sarà il libro di testo. Questo potrà essere integrato
con appunti del docente o con materiale scaricato da internet ( mappe, immagini, filmati) ; la lezione
sarà principalmente di tipo frontale ma dialogata per stimolare gli studenti al dialogo educativo, si
prevede l’utilizzo del laboratorio di scienze con frequenza diversa nel corso dell’anno ( da settimanale
a bisettimanale) in relazione agli argomenti svolti. Per i progetti nelle classi quarte si fa riferimento alle
attività programmate e votate in sede di collegio docenti.
Strumenti e metodologie per la valutazione delle conoscenze e delle abilità e per il giudizio di
competenza.
Le verifiche di scienze naturali sono di natura orale e scritta anche se il voto è unico;le verifiche pertanto
saranno in numero di tre, tra scritto e orale, nel primo trimestre ed di quattro nel secondo quadrimestre.
Un momento di crescita importante sarà rappresentato dall’autovalutazione, gli alunni saranno invitati
a valutare con l’attribuzione motivata di un voto le loro prestazioni; qualora il voto del docente non
dovesse concordare con quello espresso dall’alunno sarà compito del primo spiegare il perché della
discordanza
Le valutazioni saranno attribuite tenendo conto della seguente griglia di valutazione:
voto 1
voto 2-3
voto 4
voto 5
voto 6
voto 7
voto 8
voto 9
voto 10
consegna in bianco o rifiuto verifica orale
insufficienza gravissima: nessuna elaborazione, disimpegno
gravemente insufficiente: scarso impegno, scarsa capacità logica e di sintesi
insufficiente: conoscenza frammentaria, sintesi parziale
sufficiente: conoscenza completa ma non approfondita
discreto: conoscenza completa, discreta abilità di analisi
buono: conoscenza completa e coordinata, esposizione chiara e precisa
ottimo: impegno adeguato ed approfondito, sintesi originale e rigorosa, esposizione ricca
eccellente: ottimo impegno che va al di là delle argomentazioni affrontate, di stimolo per
Attività di supporto ed integrazione. Iniziative di recupero
Le attività di recupero saranno svolte in itinere. Nel caso di argomenti particolarmente ostici, la
programmazione verrà rallentata fino al superamento dei problemi di comprensione da parte degli
alunni.
Sarà sempre data la possibilità, agli alunni che presentano valutazioni insufficienti, di recuperare
concordando con il docente i modi e i tempi del recupero stesso.
Savignano, 20/10/2014
La docente
Angela Maria di Caprio