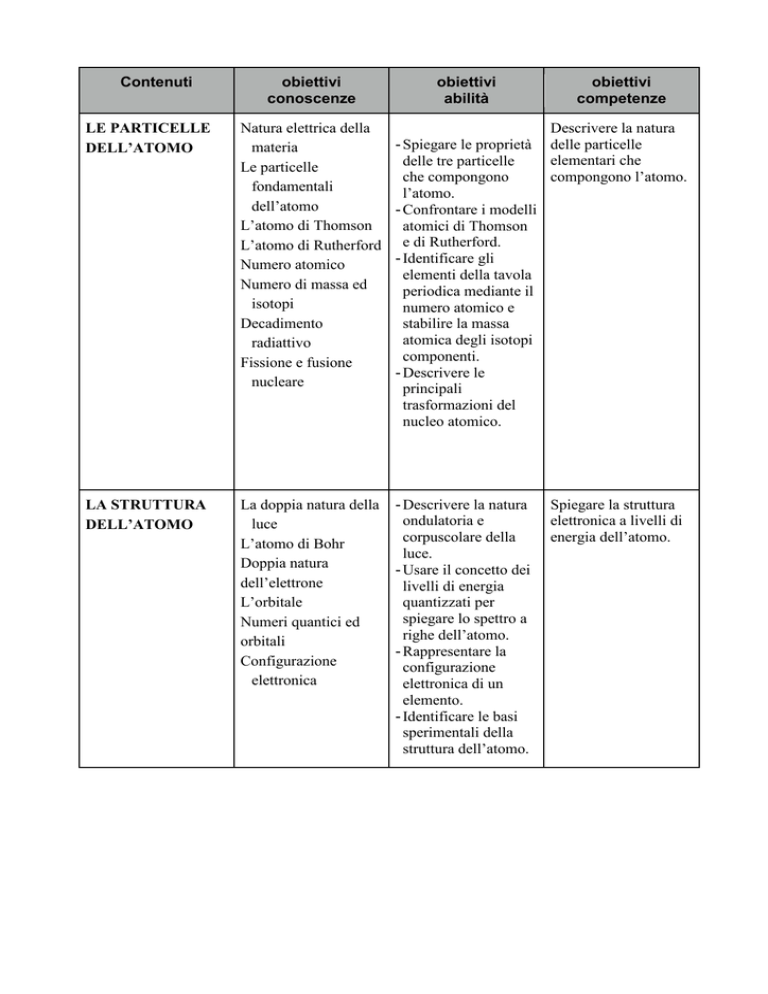
Contenuti
obiettivi
conoscenze
obiettivi
abilità
obiettivi
competenze
LE PARTICELLE
DELL’ATOMO
Natura elettrica della
materia
Le particelle
fondamentali
dell’atomo
L’atomo di Thomson
L’atomo di Rutherford
Numero atomico
Numero di massa ed
isotopi
Decadimento
radiattivo
Fissione e fusione
nucleare
Descrivere la natura
- Spiegare le proprietà delle particelle
elementari che
delle tre particelle
compongono l’atomo.
che compongono
l’atomo.
- Confrontare i modelli
atomici di Thomson
e di Rutherford.
- Identificare gli
elementi della tavola
periodica mediante il
numero atomico e
stabilire la massa
atomica degli isotopi
componenti.
- Descrivere le
principali
trasformazioni del
nucleo atomico.
LA STRUTTURA
DELL’ATOMO
La doppia natura della
luce
L’atomo di Bohr
Doppia natura
dell’elettrone
L’orbitale
Numeri quantici ed
orbitali
Configurazione
elettronica
- Descrivere la natura
ondulatoria e
corpuscolare della
luce.
- Usare il concetto dei
livelli di energia
quantizzati per
spiegare lo spettro a
righe dell’atomo.
- Rappresentare la
configurazione
elettronica di un
elemento.
- Identificare le basi
sperimentali della
struttura dell’atomo.
Spiegare la struttura
elettronica a livelli di
energia dell’atomo.
Contenuti
obiettivi
conoscenze
obiettivi
abilità
obiettivi
competenze
IL SISTEMA
PERIODICO
Il sistema periodico di
Mendeleev
La moderna tavola
periodica
I simboli di Lewis
Le proprietà
periodiche
Metalli non metalli e
semimetalli
- Discutere lo sviluppo
storico del concetto
di periodicità.
- Spiegare la relazione
fra struttura
elettronica e
posizione degli
elementi sulla tavola
periodica.
- Descrivere le
principali proprietà
periodiche che
confermano la
struttura a strati
dell’atomo.
- Descrivere le
principali proprietà
di metalli,
semimetalli e non
metalli
Identificare gli
elementi attraverso il
loro numero atomico e
mediante le proprietà
intensive di ciascun
elemento.
I LEGAMI
CHIMICI
La regola dell’ottetto.
I legami interatomici
(legame covalente,
legame ionico,
legame metallico)
- Descrivere le
proprietà osservabili
dei materiali sulla
base della loro
struttura
microscopica.
- Comparare i diversi
legami chimici.
Stabilire la polarità dei
legami covalenti e
delle molecole sulla
base delle differenze
di elettronegatività
degli elementi e della
geometria delle
molecole.
Spiegare la struttura
delle sostanze che
presentano legame
ionico, legame
covalente e legame
metallico.
LE NUOVE
TEORIE DEL
LEGAME
Ibridazione degli
orbitali e geometria
delle molecole
- Spiegare
l’ibridazione..
Disegnare le strutture
elettroniche delle
principali molecole.
Utilizzare le diverse
teorie sui legami
chimici per spiegare le
proprietà e le strutture
delle molecole
Contenuti
obiettivi
conoscenze
Le interazioni dipoloLE FORZE
dipolo, le forze di
INTERMOLECOLA
London, il legame
RI E GLI STATI
ad idrogeno
CONDENSATI
Forze di coesione
DELLA MATERIA
intermolecolari e
stati di aggregazione
della materia
obiettivi
abilità
obiettivi
competenze
Spiegare le proprietà
fisiche dei materiali
sulla base delle
interazioni
microscopiche fra
atomi, ioni e molecole
e della loro struttura
cristallina.
- Confrontare le forze
di attrazione
interatomiche
(legame ionico,
legame covalente e
legame metallico)
con le forze
intermolecolari.
- Spiegare le
differenze nelle
proprietà fisiche dei
materiali, dovute alle
interazioni
interatomiche e
intermolecolari.
- Classificare i solidi
in base alle
interazioni fra atomi
e fra molecole.
-












