Riepilogando….
I numeri quantici
LE COMBINAZIONI DEI NUMERI QUANTICI
Forma e proprietà dell’orbitale 1s
Proprietà degli orbitali 2s
Forma e proprietà degli orbitali 2p
Forma e proprieta’ degli orbitali d
Orbitali di tipo f
Comportamento degli elettroni in un campo magnetico
IL NUMERO QUANTICO DI SPIN
L’elettrone ruota su sé stesso generando un
campo magnetico
Esistono due possibili versi di
rotazione: orario e antiorario, a cui
corrispondono due orientazioni
opposte del campo magnetico
Un elettrone ruotando su sé stesso può generare solo due opposti valori di
momento magnetico quindi ms può assumere solo due valori che per
convenzione vengono indicati con +1/2 e -1/2.
Lo spin dell’elettrone è quantizzato
Numeri quantici
Configurazione elettronica
Ogni atomo è caratterizzato da una particolare disposizione degli elettroni nei
suoi orbitali
La configurazione elettronica rappresenta tale disposizione ed è una specie di
“carta d’identità” dell’atomo
In questa notazione semplificata il numero di elettroni di un certo
sottolivello è posto ad apice del simbolo del sottolivello stesso
Configurazione elettronica degli atomi polielettronici
La configurazione elettronica fondamentale di un elemento
si può costruire in base alle seguenti regole
1. Principio di esclusione di Pauli: uno stesso orbitale può
ospitare al massimo due elettroni, con spin +½ e –½
2. Regola di Hund: gli elettroni tendono ad occupare orbitali
degeneri singolarmente, con i loro spin paralleli
3. Principio della costruzione progressiva: si occupano
prima gli orbitali a più bassa energia e poi quelli a energia
più elevata.
Il principio di esclusione di Pauli
In un atomo non possono coesistere due elettroni caratterizzati dagli
stessi valori dei numeri quantici n, l, ml, ms
Un orbitale (definito da una terna di valori di n, l e ml) potrà
descrivere solo due elettroni, purché questi abbiano valori diversi del
numero quantico di spin (elettroni con spin accoppiati o appaiati o
antiparalleli)
ORDINE DI PENETRAZIONE
Regola di Hund o della massima molteplicità
Ogni qual volta due o più elettroni “occupano” orbitali degeneri, essi
tendono a disporsi in modo da occupare il massimo numero di orbitali e
con lo stesso valore di spin (elettroni spaiati con spin paralleli)
Regola di Hund o della massima molteplicità
Principio della costruzione progressiva
Regola di Aufbau
Numero atomico e configurazione elettronica
PROTONI = p+
NUCLEO
NEUTRONI = n
ELETTRONI = eNumero di protoni = NUMERO ATOMICO (Z)
Nell’atomo neutro Z = numero di elettroni
Configurazione elettronica degli elementi
Z = 3 Litio (Li)
1s22s1 [He]2s1
Proprietà degli elementi
• Le proprietà chimiche e fisiche variano in funzione del numero
atomico in maniera regolare e periodica
• E’ possibile organizzare gli elementi per numero atomico
crescente
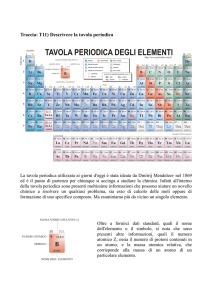
TAVOLA PERIODICA DEGLI ELEMENTI
La POSIZIONE che un elemento occupa
nella tabella periodica è un riflesso della sua
CONFIGURAZIONE ELETTRONICA
La tavola periodica di Mendeleev
Nella tavola periodica di Mendeleev il peso atomico era messo in
relazione con le proprietà chimiche e fisiche degli elementi
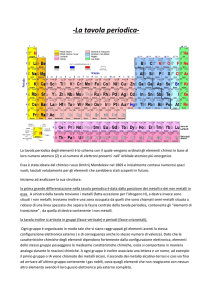
La moderna tavola periodica
Tavola periodica
Periodi
La configurazione elettronica si completa gradualmente
Le proprietà variano con continuità
Gruppi
Medesima configurazione elettronica esterna
Proprietà chimiche simili
Gruppi
Periodi
Tavola periodica
Configurazione elettronica e tavola periodica
Gli elementi di un gruppo hanno la stessa configurazione elettronica
“esterna”
Proprietà periodiche degli elementi
Le proprietà atomiche degli elementi dipendono dalla loro configurazione
elettronica
Le proprietà atomiche che variano in maniera ricorrente lungo ciascun periodo
e gruppo della tavola periodica sono chiamate proprietà periodiche degli
elementi
Carica nucleare (Zeff o Z*)
Raggio atomico
Energia di ionizzazione
Affinità elettronica
Elettronegatività
Carattere metallico
• Reattività
• Natura del legame
• Configurazione cristallina
• Proprietà acido-base
• Densità
• …..
Carica nucleare effettiva
La carica nucleare effettiva è la carica reale che l’elettrone “sente” dal nucleo
positivo
La carica nucleare effettiva è la risultante della forza attrattiva esercitata dal
nucleo sull’elettrone e le forze repulsive generate dagli elettroni dei gusci più
interni
Zeff = Z - S
S = costante di schermo
Zeff è minore della carica nucleare
Zeff aumenta man mano che ci si avvicina al nucleo: ns > np > nd > nf
Carica nucleare effettiva
Zeff è la stessa per elementi nello stesso gruppo, mentre aumenta
spostandosi verso destra nella tavola periodica
Raggio atomico
Variazione del raggio atomico lungo un gruppo
La dimensione di un atomo dipende dalla distanza media degli
elettroni di valenza dal nucleo
• Aumenta il livello energetico (aumenta n)
• Aumenta la distanza media degli elettroni di valenza dal nucleo
• Il numero di elettroni di valenza si mantiene costante
Il raggio atomico aumenta
lungo un gruppo
Raggio atomico
Variazione del raggio atomico lungo un periodo
• Il numero di elettroni di valenza e la carica nucleare aumentano
• Il numero quantico principale rimane costante
La carica nucleare effettiva aumenta
Il raggio atomico diminuisce
lungo un periodo
Raggio atomico e ionico
Cationi: ioni positivi generati da atomi
che cedono uno o più elettroni
Anioni: ioni negativi generati da atomi che
hanno acquistato uno o più elettroni
Raggio ionico minore del raggio atomico
Raggio ionico maggiore del raggio atomico
Le proprietà periodiche degli elementi
Dimensioni dei cationi e anioni (a sinistra) e degli atomi (a destra) in pm
Energia o potenziale di ionizzazione
Energia di Ionizzazione (E.I.)
Minima energia da somministrare ad un atomo isolato in fase gassosa
(X), per strappargli un elettrone, trasformandolo in uno ione positivo (X+)
X (g) + E.I.
X+(g) + e-
L’Energia di Ionizzazione è sempre positiva
Energia o potenziale di ionizzazione
X(g) + Eion X+(g) + e-
prima ionizzazione
X+(g) + Eion X2+(g) + e-
seconda ionizzazione
X2+(g) + Eion X3+(g) + e-
terza ionizzazione
Mg (g) Mg+(g) + eMg+(g) Mg2+(g) + eMg2+(g) Mg3+(g) + e-
IE (1) = 738 kJ/mol
IE (2) = 1451 kJ/mol
IE (3) = 7733 kJ/mol
Energia o potenziale di ionizzazione
Variazione lungo un gruppo
• Il numero di elettroni di valenza si mantiene costante
• Aumenta il livello energetico (aumenta il numero quantico principale)
L’energia di attrazione tra l’elettrone e il nucleo diminuisce
Lungo un gruppo l’energia di ionizzazione diminuisce
Energia o potenziale di ionizzazione
Variazione lungo un periodo
Il numero di elettroni di valenza aumenta
Il numero quantico principale si mantiene costante
Lungo un periodo la carica nucleare effettiva aumenta
L’attrazione del nucleo sugli elettroni di valenza aumenta
Lungo un periodo l’energia di ionizzazione aumenta
Energia o potenziale di ionizzazione
Affinità elettronica
E’ la variazione minima di energia che si ha quando un elettrone viene
attratto da un atomo isolato allo stato gassoso
Ea.e. < O
Processo esotermico
Elettronegatività
Capacità di un atomo in una molecola di attirare elettroni di un altro
atomo, impegnato in un legame comune
omeopolare
eteropolare
ionico
Carattere metallico
Metalli
• Elementi con bassa energia di ionizzazione e bassa affinità elettronica
• Formano solo ioni positivi
• Sono malleabili e duttili
• Sono buoni conduttori di corrente e di calore
• Sono sistemati a sinistra e al centro della tavola periodica
• Sono tutti solidi eccetto il mercurio
Non metalli
• Hanno elevate energia di ionizzazione e affinità elettronica
• Non sono lucenti, né malleabili e non conducono bene corrente
e calore
• Sono sistemati a destra della tavola periodica
• Sono solidi (es. iodio), liquidi (es. bromo) e gassosi (es. cloro)
Semi-metalli
•
•
•
•
•
Elementi con alta affinità elettronica
Formano difficilmente ioni
Hanno aspetto brillante o opaco
Sono solidi
conducono l’elettricità meno dei metalli e più dei non metalli
Carattere metallico
Periodicità delle proprietà degli elementi
La tavola periodica in relazione alle proprietà chimiche
Esempio: I metalli alcalini
Hanno caratteristiche di lucentezza, elevata conducibilità termica ed elettrica
Reagiscono con acqua dando gli idrossidi e liberando idrogeno
2 M(s) + 2H2O(l) 2 MOH(aq) + H2(g)
Possono formare ossidi basici di formula M2O che con acqua
danno idrossidi che si comportano come basi forti
2 M(s) + ½O2(g) M2O(s)
M2O(s) + H2O(l) 2MOH(s) 2 Li+ + 2 OHEssendo molto reattivi non si trovano mai come metalli liberi in natura ma come
cationi in sali quali NaCl