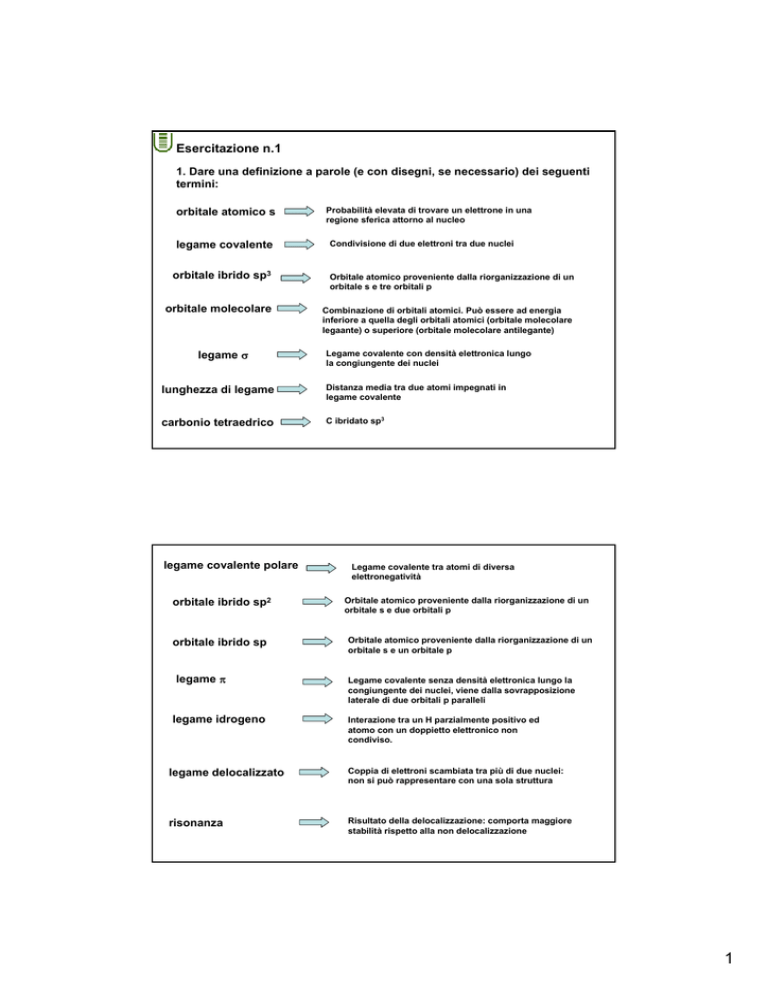
Esercitazione n.1
1. Dare una definizione a parole (e con disegni, se necessario) dei seguenti
termini:
orbitale atomico s
legame covalente
Probabilità elevata di trovare un elettrone in una
regione sferica attorno al nucleo
Condivisione di due elettroni tra due nuclei
orbitale ibrido sp3
Orbitale atomico proveniente dalla riorganizzazione di un
orbitale s e tre orbitali p
orbitale molecolare
Combinazione di orbitali atomici. Può essere ad energia
inferiore a quella degli orbitali atomici (orbitale molecolare
legaante) o superiore (orbitale molecolare antilegante)
legame σ
Legame covalente con densità elettronica lungo
la congiungente dei nuclei
lunghezza di legame
Distanza media tra due atomi impegnati in
legame covalente
carbonio tetraedrico
C ibridato sp3
legame covalente polare
orbitale ibrido sp2
orbitale ibrido sp
legame π
legame idrogeno
Legame covalente tra atomi di diversa
elettronegatività
Orbitale atomico proveniente dalla riorganizzazione di un
orbitale s e due orbitali p
Orbitale atomico proveniente dalla riorganizzazione di un
orbitale s e un orbitale p
Legame covalente senza densità elettronica lungo la
congiungente dei nuclei, viene dalla sovrapposizione
laterale di due orbitali p paralleli
Interazione tra un H parzialmente positivo ed
atomo con un doppietto elettronico non
condiviso.
legame delocalizzato
Coppia di elettroni scambiata tra più di due nuclei:
non si può rappresentare con una sola struttura
risonanza
Risultato della delocalizzazione: comporta maggiore
stabilità rispetto alla non delocalizzazione
1
2. a) Individuare gli otto elettroni leganti associati all'atomo di carbonio in
ciascuna delle seguenti strutture:
:O:
..
..
:O::C::O:
..
..
:O :: C :: O :
::
H:C:H
H:C:::N:
:O:
..
..
H:C:H
H:C:::N:
b) Nelle strutture precedenti assegnare gli elettroni associati a ciascun atomo
di H e gli otto elettroni associati a ciascun atomo di ossigeno e di azoto.
..
..
:O::C::O:
H:C:::N:
:O:
::
H:C:H
5. Ciascuna delle seguenti strutture contiene un doppio o un triplo legame.
Scrivere le formule di Lewis e di Kekulé (a legame di valenza) corrispondenti:
HCN, Cl2CO, C2Cl4, C2H2, C2H4, CH2O
H:C:::N:
N:
H C
..
..
:Cl:
:Cl:
..
:Cl:C::C:Cl:
C
..
:Cl:
:Cl
..
.. :
H..
..H
..C::C..
H
H
..
:Cl :
..
:Cl:
. . ..
C::O:
..
:Cl:
..
C
:Cl
.. :
H:C:::C:H
H
H
C
H
C
H
H..
..
..C::O..
H
..
: Cl :
..
O..
C
: Cl
:
..
H C
C H
H
C
..
O..
H
2
15. Per ciascuna delle seguenti strutture dire se le coppie di atomi di
carbonio indicate giacciono o no sullo stesso piano:
H
CH3
H3C
C
H
H
C
H
H3C
C
C
C
C
H
H
sì
H
CH3
CH3
H
H
C
H
H3C
C
H
CH2
H3C
H3C
H3C
C
C
C
C
H
H
no
H
H
CH3
HC
CH2 CH3
C
HC
C
HC
CH2 CH3
sì
C
C
sì
(sono sulla stessa retta)
H
H
(per una retta ed un punto al di fuori di essa passa un piano)
16. Dire il valore degli angoli di legame indicati nelle seguenti strutture:
H
H
H C
C
H
H
H2C
120°
(sp2)
120°
(sp2)
109°(sp3)
H
180°(sp)
C
C
C
H
H3C
109°(sp3)
H
C
CH
C
H
H
H
H
17. Dire, in ciascuna delle seguenti coppie, se è più corto il legame (1) o (2):
1
2
Cl CH2CH3 Cl CH
C(sp3)-Cl
2
1
H3C
CH2
C(sp2)-Cl
O
1
H
CH3 O C CH3
C(sp2)-O
più corto
C(sp3)-O
più corto
C(sp2)-H
CH3
2
C
H
CH C
C H C(sp)-H
più corto
3
32. Quale dei seguenti composti può formare legame idrogeno con se
stesso? e con l'acqua?:
CH3CH2CH2OH; CH3COCH3; (CH3)3CH
a
a
H
H
CH3 CH2 CH2 O..
CH3 CH2 CH2 O..
H
H
O CH2 CH2 CH3
CH3 CH2 CH2 O
..
H O
H
CH3 C
O. .
O H
H
CH3
a
d
d
d
H
non può formare legame H con se stesso
(manca l'H legato ad un atomo elettronegativo
O H
CH3
NON può formare legame idrogeno
CH3 CH CH3
33. a) Mostrare tutti i tipi di legame idrogeno in una soluzione acquosa
di (CH3)2NH. Quale è il più forte?
H
H3C ..
H3C N H
H3C
:N CH
3
H3C
CH3
H
H3C
H3C
N:
H
H
:O
:O
O H
H
H
H
legame H più forte:tra l'H più positivo
(legato all'atomo più elettronegativo) e
l'atomo accettore meno elettronegativo
(donatore migliore)
H O
H
CH3
H3C
H3C N H
H3C
b) Indicare il legame idrogeno tra due molecole di metanolo (CH3OH) e
quello tra una molecola di metanolo ed una di acqua.
CH3
O H
CH3
:O
O H
H
CH3
H
CH3
O H
:O
H
H
:O
H
4












