Lo stato liquido
Le particelle sono in continuo movimento, anche se questo risulta più
limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle
particelle è chiamato moto Browniano.
Proprietà dei liquidi:
• Isotropia
• Fluidità
• Facile diffusione reciproca
Classificazione:
- liquidi ionici, costituiti da ioni (es. i sali allo stato fuso)
- i liquidi molecolari, costituiti da molecole.
• i liquidi molecolari semplici: tra le molecole esistono soltanto
forze di van der Waals
• i liquidi molecolari con legami a idrogeno: le interazioni tra le
molecole si stabiliscono soprattutto attraverso legami a idrogeno
La tensione di vapore
Evaporazione da recipiente aperto:
T2 > T 1
T1
T2
P
Evaporazione da recipiente chiuso:
P = Pressione o tensione di vapore del liquido
T= costante
Temperatura di ebollizione: temperatura alla quale la
tensione di vapore del liquido uguaglia la pressione esterna.
Si parla di temperatura normale di ebollizione quando la
pressione esterna è pari a 1 atm
fenomeno superficiale
Evaporazione
nell'intervallo Tc < T < Te
fenomeno massivo
Ebollizione
quando Pvapore = Pesterna
L’equazione di Clausius-Clapeyron
Q
dP
=
dT
2
P R ⋅T
P = tensione di vapore del liquido
Q = calore di vaporizzazione molare
T = temperatura
⇓
log e p2 − log e p1 =
Q⎛ 1 1 ⎞
⎜ − ⎟
R ⎜⎝ T1 T2 ⎟⎠
Per i solidi:
calore di vaporizzazione Q
calore di sublimazione S
Essendo S > Q
⎛ dP ⎞
⎛ dP ⎞
> ⎜
⎜
⎟
⎟
⎝ dT ⎠ solido
⎝ dT ⎠ liquido
⇒
la curva che rappresenta la tensione di vapore di un solido, a temperature
prossime a quella di solidificazione, ha una pendenza maggiore di quella
del liquido:
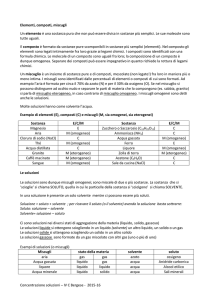
Soluzioni e loro composizione
Soluzione = sistema fisicamente omogeneo a più componenti
solide
Soluzioni
liquide
gassose
Solvente = componente nello stesso stato di aggregazione della soluzione
Soluto o soluti = l'altro o gli altri componenti
Composizione di una soluzione
• frazione ponderale: è il rapporto tra la massa gi (espressa in grammi) dell’iesimo componente e la massa (sempre espressa in grammi) della
soluzione:
g
Wi = i
g tot
• frazione ponderale percentuale (o percentuale ponderale o percentuale in
peso): si ottiene moltiplicando la frazione ponderale per 100
% peso = Wi ⋅ 100 =
gi
⋅ 100
g tot
• concentrazione ordinaria (o concentrazione percentuale): rappresenta la
quantità in peso di soluto disciolto in 100 parti di solvente
g
C % = soluto ⋅ 100
g solvente
• frazione molare: è il rapporto tra il numero di moli del componente i-esimo
ni e il numero di moli totali ntot presenti in soluzione
n
Xi = i
∑ Xi =1
ntot
• concentrazione in volume (o percentuale in volume): rappresenta il
volume del componente contenuto in 100 volumi di soluzione:
% volume =
Vi
⋅ 100
Vtot
Grandezze dimensionate:
• concentrazione in g/l: è il rapporto tra la massa gi (espressa in grammi) del componente iesimo e il volume della soluzione.
g
C= i
V
• molarità (o concentrazione molare) M: è il rapporto tra il numero di moli della specie
considerata e il volume totale (espresso in litri) della soluzione:
M =
[HCl] = 1.2
ni
V
⇔ soluzione 1.2 M di HCl
• molalità (o concentrazione molale) m: rappresenta il numero di moli di soluto contenute in
1000 g (1 kg) di solvente
m=
ni
1000 g di solvente
m=
a ⋅ 1000
b ⋅ PM
a = grammi di soluto di peso molecolare PM
b = grammi di solvente
• normalità (o concentrazione normale) N: rappresenta il numero di grammi-equivalenti (o
semplicemente equivalenti) contenuti in 1 litro di soluzione
N=
g equivalenti
V
Equivalente di una determinata sostanza = quantità di sostanza che trasporta una carica
elettrica (positiva o negativa) pari a 1 mole di cariche unitarie.
g equivalenti =
g
PE
PE = peso equivalente dell'elemento o del composto
♣
PE di un elemento = numero di parti in peso dell’elemento
che possono combinarsi direttamente o indirettamente con
1.008 parti in peso di idrogeno.
PA
PE =
valenza
♣
PE di un composto:
- idrossido: PE =
- acido:
PE =
- sale:
PE =
PM idrossido
numero di gruppi ossidrili
PM acido
numero di atomi di H acidi
numero di equivalenti (n.e.)
PM sale
numero complessivo delle valenze
degli atomi del metallo contenuti nel sale
PE =
PM composto
n.e.
N = M ⋅ n.e.
Solubilità
È la massima concentrazione che una sostanza può raggiungere in
un solvente senza che si abbia separazione di fase
soluzione satura
soluto solido
Variabili:
• Temperatura
• Pressione
Effetto della temperatura
♣
soluto gassoso: la solubilità diminuisce all'aumentare della T
♣
soluto solido: all'aumentare di T la solubilità può aumentare o
diminuire a seconda che il processo di dissoluzione sia
accompagnato da assorbimento o sviluppo di calore:
fase endotermica
(assorbimento di calore)
solido cristallino
distruzione del reticolo
interazione associativa
tra le particelle costituenti
il solido e le molecole
del liquido
soluzione
fase esotermica
(sviluppo di calore)
Effetto della pressione
♣
soluto gassoso: la solubilità aumenta decisamente
all'aumentare della P
♣
soluto solido: l'influenza della pressione è assai
modesta
Le proprietà colligative
Sono proprietà che dipendono unicamente dal numero e non dalla
natura delle particelle di soluto presenti nell’unità di volume della
soluzione.
- Legge di Raoult
- Crioscopia
- Ebullioscopia
- Pressione osmotica
Legge di Raoult
È valida per soluzioni ideali:
- sono costituite da componenti con struttura chimica simile
- nella loro formazione non si ha nessun effetto termico
(sviluppo o assorbimento di calore)
Pi = X i ⋅ Pi*
Pi = pressione parziale dell’i-esimo componente
Pi* = tensione di vapore del componente i-esimo puro alla
0
temperatura considerata (spesso indicata come Pi )
Xi = frazione molare dell’i-esimo componente
Pertanto:
P=
∑P =∑X
i
i
⋅Pi*
Per una soluzione binaria (2 componenti):
P = PA* ⋅ X A + PB* ⋅ X B
Essendo XA + XB = 1
(
)
P = PA* ⋅ (1 − X B ) + PB* ⋅ X B = PA* + PB* − PA* ⋅ X B
⇒ Per una soluzione ideale la tensione di vapore ha una
dipendenza lineare con la frazione molare di uno qualunque dei
due componenti.
P*A
P
PA
P*B
PB
0
1
XB
XA
1
0
Hp: Soluto B non volatile ⇒ la sua tensione di vapore è trascurabile rispetto a
quella di A:
P = PA* ⋅ X A + PB* ⋅ X B ≅ PA* ⋅ X A = PA* ⋅ (1 − X B )
PA* − P
nB
=
=
X
B
n A + nB
PA*
Limitazioni della legge di Raoult (e delle altre proprietà colligative):
- è applicabile solo a soluzioni piuttosto diluite
- il soluto B deve avere una tensione di vapore molto bassa e
comunque trascurabile rispetto al solvente A
- il soluto B e il solvente A non devono reagire tra loro nè dare origine
a soluzioni solide
- il soluto B sciogliendosi nel solvente A non deve dare nè fenomeni
associativi nè dissociativi: non è applicabile alle soluzioni di elettroliti
Crioscopia ed ebullioscopia
In una soluzione costituita da un soluto non volatile disciolto in un
solvente, la temperatura di ebollizione della soluzione è, a parità di
pressione esterna, superiore a quella del solvente e la temperatura di
inizio congelamento della soluzione è inferiore a quella di congelamento
del solvente:
Legge generale dell’ebullioscopia:
∆Te = Te' − Te = K e ⋅ m
Ke = costante ebullioscopica [°C/mol]
Legge generale della crioscopia:
∆Tc = Tc - Tc' = K c ⋅ m
Kc = costante crioscopica [°C/mol]
Kc e Ke variano in funzione del tipo di solvente
considerato:
Solvente
H2O
CH3COOH
CHCl3
C6H5OH
Kc
[°C/mol]
Ke
[°C/mol]
1.86
3.9
4.67
7.40
0.51
3.07
3.63
3.56
Comportamento crioscopico di una soluzione:
• il solvente solidifica tutto a Tc e anche se si sottrae calore la T
rimane costante a tale valore fin quando la solidificazione non è
completa;
• da una soluzione diluita si separa al raffreddamento come prima
fase solida il solvente puro; sottraendo calore la T continua a
diminuire
Curve di raffreddamento:
Temperatura
Temperatura
liquido
T'c
Tc
liquido
liquido + solvente solido
solvente e soluto solidi
Teutettica
liquido + solido
solido
liquido + solvente solido + soluto
Tempo
Tempo
Solvente puro
Soluzione
La pressione osmotica
B
A
Solvente
Soluzione
membrana semipermeabile
⇒
si crea un dislivello h tra le superfici libere dei due liquidi
π
B
h
A
π ⋅V = n ⋅ R ⋅ T
π = pressione osmotica [atm]
V = volume della soluzione [l]
n = numero di moli di soluto
T = temperatura assoluta
litri ⋅ atmosfere
R = costante pari a 0.082
mol ⋅ K
Applicazioni: osmosi inversa