Elementi, composti, miscugli
Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono
tutte uguali.
Il composto è formato da sostanze pure scomponibili in sostanze più semplici (elementi). Nel composto gli
elementi sono legati intimamente fra loro grazie ai legami chimici. I composti sono identificati con una
formula chimica. Le molecole di un composto sono uguali fra loro; la composizione di un composto è
dunque omogenea. Separare dei composti può essere impegnativo in quanto richiede la rottura di legami
chimici.
Un miscuglio è un insieme di sostanze pure e di composti, mescolate (non legate!) fra loro in maniera più o
meno intima. I miscugli sono identificati dalle percentuali di elementi o composti di cui sono formati. Ad
esempio l’aria è formata per circa il 70% da azoto (N) e per il 30% da ossigeno (O). Se nel miscuglio si
possono distinguere ad occhio nudo e separare le parti di materia che lo compongono (es. sabbia, granito)
si parla di miscuglio eterogeneo, in caso contrario di miscuglio omogeneo. I miscugli omogenei sono detti
anche le soluzioni.
Molte soluzioni hanno come solvente l’acqua.
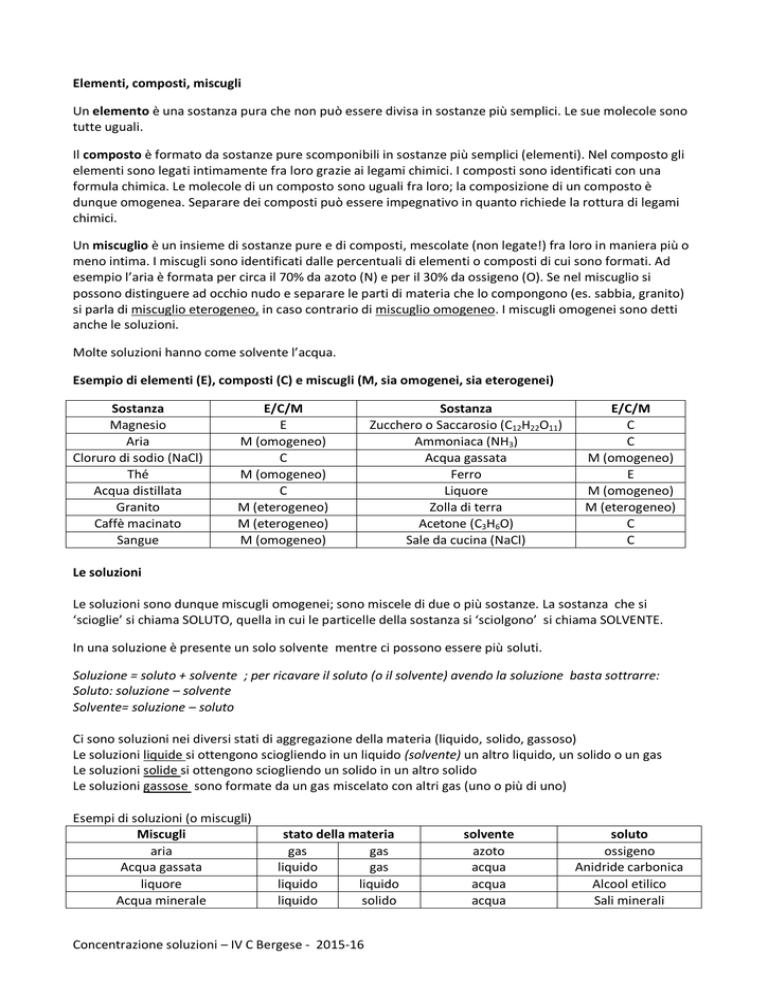
Esempio di elementi (E), composti (C) e miscugli (M, sia omogenei, sia eterogenei)
Sostanza
Magnesio
Aria
Cloruro di sodio (NaCl)
Thé
Acqua distillata
Granito
Caffè macinato
Sangue
E/C/M
E
M (omogeneo)
C
M (omogeneo)
C
M (eterogeneo)
M (eterogeneo)
M (omogeneo)
Sostanza
Zucchero o Saccarosio (C12H22O11)
Ammoniaca (NH3)
Acqua gassata
Ferro
Liquore
Zolla di terra
Acetone (C3H6O)
Sale da cucina (NaCl)
E/C/M
C
C
M (omogeneo)
E
M (omogeneo)
M (eterogeneo)
C
C
Le soluzioni
Le soluzioni sono dunque miscugli omogenei; sono miscele di due o più sostanze. La sostanza che si
‘scioglie’ si chiama SOLUTO, quella in cui le particelle della sostanza si ‘sciolgono’ si chiama SOLVENTE.
In una soluzione è presente un solo solvente mentre ci possono essere più soluti.
Soluzione = soluto + solvente ; per ricavare il soluto (o il solvente) avendo la soluzione basta sottrarre:
Soluto: soluzione – solvente
Solvente= soluzione – soluto
Ci sono soluzioni nei diversi stati di aggregazione della materia (liquido, solido, gassoso)
Le soluzioni liquide si ottengono sciogliendo in un liquido (solvente) un altro liquido, un solido o un gas
Le soluzioni solide si ottengono sciogliendo un solido in un altro solido
Le soluzioni gassose sono formate da un gas miscelato con altri gas (uno o più di uno)
Esempi di soluzioni (o miscugli)
Miscugli
aria
Acqua gassata
liquore
Acqua minerale
stato della materia
gas
gas
liquido
gas
liquido
liquido
liquido
solido
Concentrazione soluzioni – IV C Bergese - 2015-16
solvente
azoto
acqua
acqua
acqua
soluto
ossigeno
Anidride carbonica
Alcool etilico
Sali minerali
Leghe metalliche: bronzo
Solido
solido
Rame (85%-90%)
Stagno (15%-10%)
Una soluzione si dice satura quando a quella temperatura non è possibile sciogliere altro soluto nel
solvente (la quantità disciolta è la massima possibile)
La solubilità è la massima quantità di soluto che può essere sciolta in una determinata quantità di solvente
Concentrazione di soluzioni
La concentrazione mette in relazione le quantità dei componenti di un miscuglio. Fra i modi di esprimere la
concentrazione: parti per milione, % in peso, % in volume
Concentrazione in parti per milione
p.p.m (parti per milione) equivale a mg/l.
Indica i mg di soluto presenti in 1 litro o in 1 kg di soluzione
Corrisponde alle parti di soluto presenti in un milione (1000000) di parti di soluzione
Concentrazione percentuale in peso
% in peso grammi di soluto /100 grammi soluzione
Esempio:
Determinare la percentuale in peso di una soluzione di 70 g che contiene 15 g di soluto.
15: 70 = x : 100
x= 15/70*100 x= 21,4%
Esempio:
Trovare la percentuale in peso di una soluzione contenente 15 g di soluto in 55 g di solvente.
Occorre trovare il peso della soluzione che è dato da soluto + solvente 15 + 55 = 70 g
15: 70 = x : 100
x= 15/70*100
x= 21,4%
Esempio
Una torta contiene il 5% in peso di cloruro di sodio. Calcola la quantità di cloruro di sodio presente in una
torta di 500g.
5:100= x:500 X= 5*500/100 = 25 g cloruro sodio
Esempio
Una torta contiene il 30% in peso di saccarosio. Calcola la quantità di saccarosio presente in una torta di
400g.
30:100=x:400 x= 30*400/100 = 120 g saccarosio
Concentrazione percentuale in volume
% in volume ml di soluto/100 ml soluzione
Nel caso dell’alcol si usano i gradi e si usa il simbolo ° ; ad esempio 5° vuol dire 5 gradi ed in particolare che
ci sono 5 ml di alcol disciolti in 100 ml di soluzione.
Esempio
Quanti millilitri di alcol etilico ci sono in una bottiglia di vino da 500 ml la cui concentrazione in alcol è 13°?
13° vuol dire 13 % in volume e cioè 13 ml di alcol su 100 ml di soluzione. Per trovare quanti ml di alcol ci
sono in 500 ml si fa la seguente proporzione:
13: 100 = x :500 X=13*500/100 = 65 ml
Concentrazione soluzioni – IV C Bergese - 2015-16
Esempio
Quanti millilitri di alcol etilico ci sono in una bottiglia di vino da 1,5 l la cui concentrazione in alcol è 11° %
in volume?
11° vuol dire 11% in volume, quindi 11 ml su 100 ml soluzione
1,5 litri equivalgono a 1500 ml. La proporzione è:
11: 100= x : 1500 X=11*1500/100 = 165 ml
Concentrazione soluzioni – IV C Bergese - 2015-16