CATENA RESPIRATORIA (CR)
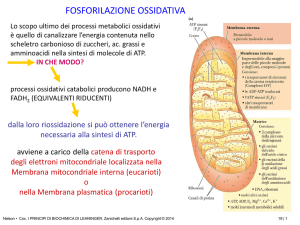
FOSFORILAZIONE OSSIDATIVA (FO)
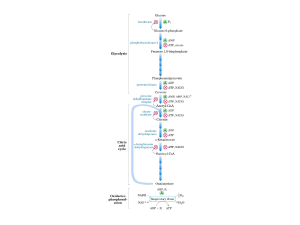
- Decarb. ossid. piruvato
- -Ossidazione acidi grassi
- Vie ossidative aa
- Ciclo di Krebs
avvengono tutte nella matrice mitocondriale
In tutte queste vie si formano
NADH e FADH2 che hanno un elevato
potenziale di trasferimento degli eQuesti e- vengono trasportati fino all’O2
attraverso una catena di trasporto degli edetta catena respiratoria
Il processo è fortemente esoergonico:
una parte dell’energia viene usata
per generare ATP
Ossidazione = Trasporto di eFosforilazione = Formazione di ATP
L'ossidazione e la fosforilazione
sono processi accoppiati:
fosforilazione ossidativa
Il potenziale di trasferimento
degli e- (potenziale redox)
del NADH e del FADH2
potenziale di trasferimento del gruppo fosforico
(potenziale fosforico) dell’ATP
La F.O. ha luogo
sulla catena respiratoria localizzata
nella membr. mitoc. interna
Il numero e le dimensioni
dei mitocondri, nonchè
lo sviluppo delle creste mitocondriali,
riflettono la capacità ossidativa
dei tessuti
Miocardio
- metabolismo aerobio
- mitocondri grandi e numerosi
- creste molto sviluppate
Muscolo scheletrico
- metabolismo aerobio e anaerobio
- meno mitocondri, più piccoli
- creste poco sviluppate
Mitocondri di fegato di ratto
a riposo
in attività
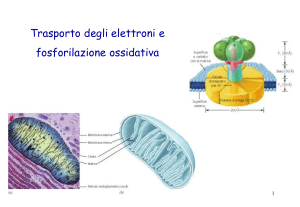
La membr. mitoc. est. è permeabile alla
maggior parte delle molecole piccole ed agli
ioni, grazie alla presenza di canali proteici
costituiti dalla porina
La membr. mitoc. int. presenta
una permeabilità altamente selettiva
La CR consiste in
- cinque complessi enzimatici
(I, II, III, IV, V o ATP sintasi)
- due trasportatori mobili
(CoQ e citocromo c)
I complessi isolati dall'I al IV
catalizzano anche in vitro
trasferimenti di e- da donatori
(NADH o succinato) all‘O2,
mediante alcuni trasportatori
intermedi (Q e cit c).
L’ATP sintasi possiede in vitro
solo un'attività che idrolizza
l'ATP, mentre l'attività
sintetasica è assente
I componenti della CR sono orientati secondo il potenziale redox
crescente, che va da valori negativi (NADH) a valori positivi (O2)
Un potenziale redox negativo segnala un
agente riducente che tende a perdere eUn potenziale redox positivo segnala un
agente ossidante che tende a captare e-
A monte del blocco i trasportatori sono ridotti (blu)
A valle del blocco i trasportatori sono ossidati (rosso)
Centri Fe-S
- sono i gruppi prostetici delle proteine
Fe-S (o ferroproteine non eminiche)
- sono presenti nei complessi I, II e III
- il Fe passa ciclicamente da +2 a +3
Il CoQ
- essendo piccolo ed idrofobico, diffonde
liberamente nel bilayer lipidico
- potendo trasportare sia e- che H+ svolge
un ruolo importante nell’accoppiamento tra
flusso elettronico e movimento protonico
I citocromi sono proteine eminiche che
partecipano a reazioni redox
In essi il Fe passa continuamente durante il
trasporto degli e- dallo stato di ossidazione
+3 a +2
In base agli spettri di assorbimento della
luce si distinguono tre classi: a, b e c
Le tre classi a, b e c differiscono per
la natura delle catene laterali dell’eme,
nonché per il tipo di legame che lega
l’eme alla parte proteica
L’eme dei citocromi di tipo a e b è legato
non covalentemente alla parte proteica
L’eme del citocromo c è invece legato
covalentemente attraverso residui di
Cys della proteina
I citocromi di tipo a e b sono proteine
integrali di membrana
Il citocromo c è invece una proteina
solubile che si lega mediante interazioni
elettrostatiche alla superf. esterna
della membr. mitoc. int.
COMPLESSO I
NADH +CoQ NAD+ + CoQH2
COMPLESSO III
CoQH2 + cit c (Fe3+) CoQ + cit c (Fe2+)
COMPLESSO IV
cit c (Fe2+) + ½ O2 cit c (Fe3+) + H2O
COMPLESSO II
FADH2 + CoQ FAD + CoQH2
Oltre che dal NADH, gli e- che arrivano
sul CoQ provengono da
- succinato (succinato DH => complesso II)
- glicerolo 3P (glicerolo 3P DH)
- acil CoA (acil CoA DH)
Struttura del
complesso II
(succinato DH)
Il complesso del citocromo bc1 (Complesso III)
è un dimero formato da due monomeri identici
La proteina di Rieske è una variante delle proteine Fe-S:
in esse il Fe è coordinato con due His, non con Cys
Il ciclo dell'ubichinone (ciclo Q)
Due molecole di QH2 vengono ossidate a Q
rilasciando 2 H+ per Q (4 H+ in totale) nello
spazio intermembrana
Ciascun QH2 dona un e- (tramite il centro Fe-S)
al cit c1 e un altro (tramite il cit b) a
una molecola di Q riducendola a QH2
in due tappe successive, utilizzando anche
2 H+ prelevati dalla matrice mitocondriale
Il ciclo Q regola il trasferimento degli
e- da un trasportatore a due e- (Q) a
trasportatori ad un solo e- (i citocromi)
e spiega la stechiometria della reazione
in cui sono traslocati 4 H+ per ogni 2 etrasferiti
Il citocromo c è una proteina solubile dello
spazio intermembrana: quando il suo gruppo
eme accetta un e- del complesso III, il cit c
si sposta verso il complesso IV per donare l'ea un centro rameico binucleare di questo enzima
Il complesso IV (o citocromo ossidasi) trasporta
gli e- dal cit c all‘O2 riducendolo ad H2O
È composto da 13 subunità di cui tre (I, II e III)
sono fondamentali per la funzionalità del complesso,
ma il ruolo preciso della III non è ancora chiaro
Complesso IV o
citocromo ossidasi
La subunità I contiene un eme a
ed un centro binucleare, Fe-Cu,
formato da un eme a3 e da uno
ione rame, CuB
La subunità II contiene un centro
binucleare, CuA, formato da due
ioni Cu complessati con gli -SH
di due Cys
Il trasferimento degli e- procede dal cit c
al centro CuA, al gruppo eme a, al centro
a3-CuB e finalmente all’O2
Complesso IV
Ognuna delle due molecole di cit
c ridotte dona un e- al centro CuA
Da qui gli e- passano attraverso
l'eme a al centro Fe-Cu.
L‘O2 ora si lega al gruppo eme a3
e viene ridotto nel suo perossido
derivato (O22-) dagli e- provenienti
dal centro Fe-Cu.
Complesso IV
Il rilascio di altri due e- provenienti
dal cit c converte O22- in due
molecole di H2O, utilizzando 4 H+
“substrato” della matrice mitocondr.
Nello stesso momento altri 4 H+
vengono pompati dalla matrice
(meccanismo ancora non chiaro)
Il trasferimento di due e- dal NADH all‘O2
NADH + H+ + ½ O2 NAD+ + H2O
è una reazione fortemente esoergonica
G’0 = -52.6 kcal/mole
Il reale rapporto [NADH]/[NAD+] è ben al di sopra
dell'unità, e quindi
G’ = >> -52.6 kcal/mole
Una parte di questa energia viene usata per
pompare H+ fuori dalla matrice mitocondriale
Per ogni coppia di e- trasferiti all‘O2,vengono
trasferiti dalla matrice allo spazio intermembrana
4 H+ dal complesso I
4 H+ dal complesso III
2 H+ dal complesso IV
Il pompaggio di H+ determina una differenza sia nella concentrazione
chimica di H+ (pH) sia nella distribuzione delle cariche attraverso la
membrana ().
Si crea così un gradiente elettrochimico che genera la forza motrice
protonica che porta alla sintesi di ATP.