Trasporto degli elettroni e
fosforilazione ossidativa
1
2
Gli organismi aerobici durante il processo di ossidazione dei carburanti
metabolici consumano ossigeno e producono biossido di carbonio:
C6H12O6 + 6O2
6CO2 + 6 H2O
suddivisa in due semireazioni:
C6H12O6 + 6O2
6CO2 + 12 H+ + 12 eOssidazione degli atomi di C del glucosio
6O2 + 12 H+ + 12 e-
6 H2O
Riduzione dell’ossigeno molecolare
3
Gli e- rilasciati durante
l’ossidazione del glucosio non sono
trasferite direttamente all’O2 ma
ai coenzimi NAD+ e FAD
tramite i coenzimi, gli e- passano
alla catena di trasporto degli e-
4
Durante il processo di trasporto degli elettroni accadono i eguenti eventi:
1) NADH e FADH2 sono riossidati a NAD+ e FAD
2) il trasferimento degli e- partecipa all’ossidazione-riduzione di 10 centri
redox localizzati in 4 complessi enzimatici
3) durante il trasferimento degli e-, dal mitocondrio vengono espulsi dei
protoni con la generazione di un gradiente protonico attraverso la
membrana mitocondriale.
5
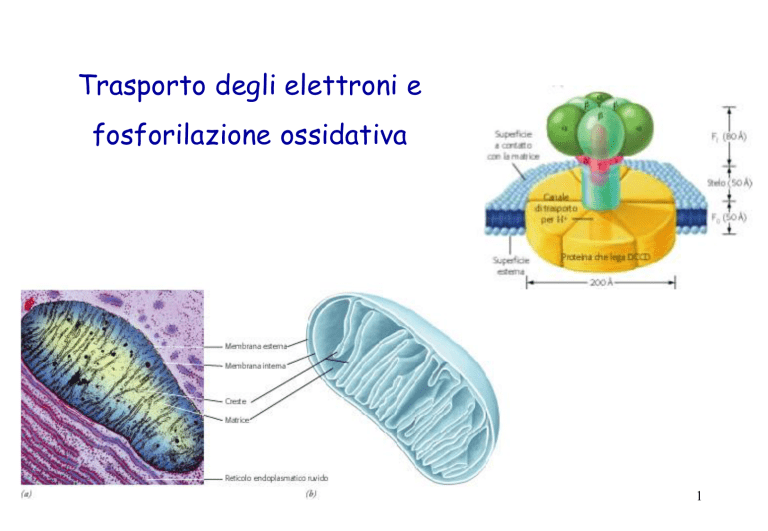
6
Struttura di un
mitocondrio
80%
proteine
50% lipidi
50% proteine
7
NAD+, NADH, NADP+, NADPH, FAD, FADH2
non possono attraversare la membrana mitocondriale interna
8
Sistemi navetta di substrati:
si servono di isoforme citoplasmatiche e mitocondriali dello stesso enzima
per trasportare gli elettroni dal citosol al mitocondrio.
9
Gli elettroni del NADH vengono trasportati dal citosol all’interno del mitocondrio
mediante un processo che implica 3 tappe.
Il sistema navetta del
glicerofosfato
trasferimento di una
coppia di e-
glicerolo 3-P deidrogenasi
isozima
FAD dip.
10
Shuttle malato – aspartato (fegato, muscolo cardiaco)
il NADH(H+) formatosi nella glicolisi può essere ossidato a spese dell’ossalacetato:
(e-)
4
1
malato deidrogenasi
(reaz. di riduzione)
mmi
3
2
reaz. di transamminazione
malato deidrogenasi
ossidato nella catena respiratoria
(reaz. di ossidazione)
11
MITOCONDRIO
Meccanismo conformazionale del traslocatore ADP-ATP: adenina nucleotide traslocasi
12
I due sistemi di trasporto
mitocondriale per il Ca
2+
I MT funzionano da tamponi
per il calcio citosolico.
Importanza della distribuzione
intracellulare del calcio:
contrazione muscolare,
trasmissione neuronale,
secrezione, azione degli ormoni
antiporto
con ioni Na+
L’entrata nella matrice
è promossa dal potenziale di membrana
negativo che attrae gli ioni positivi.
La velocità dipende dalla [Ca++] esterna
matrice
mitocondriale
Se la [Ca++]cit
Se la [Ca++] cit
= aumenta l’entrata
= diminuisce
l’entrata
13
La catena respiratoria libera energia grazie alla differenza dei
potenziali di riduzione tra il donatore (NADH + H+) e l’accettore (O2)
di elettroni. Gran parte di questa energia viene impiegata dall’ATP
sintasi per convertire l’ADP in ATP
14
Il flusso di elettroni può produrre un lavoro biologico:
nel “circuito che potenzia un motore”, la fonte di e- può essere una batteria che
contiene due specie chimiche che hanno una diversa affinità per gli e- . Il flusso
elettronico procederà spontaneamente nel circuito guidato da una forza
proporzionale alla differenza tra le due affinità detta forza elettromotrice (fem).
La fem può generare un lavoro se al circuito viene collegato un trasduttore
energetico.
15
In un analogo “circuito biologico” la fonte di elettroni è un composto ridotto come
per es. il glucosio. Quando viene ossidato enzimaticamente sono rilasciati e- che
fluiscono spontaneamente attraverso una serie di trasportatori intermedi fino a
raggiungere una specie chimica con un’elevata affinità per gli e- come l’ossigeno.
La forza motrice che si genera fornisce energia ad una varietà di trasduttori
molecolari (enzimi e proteine) che compiono un lavoro biologico.
16
L’ossidazione biologica completa di sostanze organiche nutrienti crea un
flusso di elettroni che procede verso l’ossigeno mediante una serie di
trasportatori di elettroni intermedi che si comportano come un ponte a
cestelli:
reazione redox esoergonica: gli elettroni passano spontaneamente da un
trasportatore a bassa affinità per gli elettroni ad un altro con affinità
maggiore e così via. La reazione complessiva è:
sostanza organica + O2 D CO2 + H2O + energia
17
Il sistema mitocondriale di trasporto degli e- non è altro che una sequenza di
reazioni di ossido riduzione
Durante le reazioni redox, gli elettroni
direttamente dai donatori agli accettori:
trasferiti
possono
passare
Fe2+ + Cu2+ D Fe3+ + Cu+
In alternativa, gli elettroni possono essere trasferiti da un donatore a un
accettore mediante un trasportatore di elettroni:
XH2 + Y D X +Y H2
NADH + H+ + FAD
NAD+ + FADH2
18
Le forme ossidate e ridotte dei composti sono dette coppie redox.
donatore di e- (agente riducente)
accettore di e- (agente ossidante)
La facilità con la quale gli e- passano dal riducente all’ossidante è espressa
quantitativamente dal valore del potenziale di ossido-riduzione del sistema.
19
donatore di e- (agente riducente)
accettore di e- (agente ossidante)
In una coppia redox il riducente con un potenziale di ox-red molto negativo cede
facilmente i suoi e- a coppie con potenziali redox meno negativi o più positivi
Viceversa un forte ossidante (caratterizzato da un potenziale redox molto positivo)
mostra una grande affinità per gli e-.
20
Conoscendo i potenziali standard di ox-red si può predire la direzione del flusso di e-
Il più forte agente ossidante
cioè ha elevata affinità per gli
elettroni
e-
21
La catena di trasporto degli elettroni può essere divisa in 4 complessi:
Schema dei complessi e del percorso degli elettroni nella catena di trasporto
degli elettroni nei mitocondri
22
La catena respiratoria comprende 3 complessi proteici inseriti nella
membrana mitocondriale interna (complessi I, III e IV) e molecole di
trasferimento mobili, quali il coenzima Q e il citocromo-c:
• complesso I: NADH deidrogenasi
• complesso III: citocromo-c reduttasi
• complesso IV: citocromo-c ossidasi
II
Il complesso II è la succinato deidrogenasi, è l’unico enzima
presente del ciclo dell’acido citrico presente nella membrana
interna mitocondriale. Il complesso V, l’ATP sintasi, non
23
partecipa al trasferimento di elettroni
Tutti i complessi della catena respiratoria sono formati da
numerose subunità polipeptidiche e contengono una serie di
coenzimi redox legati alle proteine:
• Flavine: FMN e FAD nei complessi I e II
• Coenzima Q
• Centri Ferro-Zolfo: complessi I, II e III
• Gruppi eme: II, III e IV
I trasportatori flavinici e il CoQ sono trasportatori misti:
trasportano elettroni e H+
I centri Ferro-Zolfo e i gruppi eme dei citocromi sono
trasportatori puri: trasportano elettroni
24
Nicotinamide adenina dinucleotide (NAD+)
e nicotinamide adenina dinucleotide fosfato
(NADP+).
R= H nel NAD+
R= PO3–- nel NADP
25
• L’FMN e il FAD subiscono delle
reazioni
di
ossido-riduzione
reversibili. L’FMN è saldamente
legato al complesso-I della catena
respiratoria e non si comporta come
un substrato diffusibile. Il FAD è
tenacemente legato al complesso II,
o succinato deidrogenasi. Le flavine
sono dei derivati della vitavina
riboflavina
26
Flavina adenina dinucleotide (FAD)
Costituita da FMN + AMP
27
•Il CoQ è diffusibile e può spostarsi,
durante il trasporto elettronico, tra
molecole donatrici e accettrici.
28
Stati di ossidazione di Flavin mononuleotide (FMN) e
Coenzima Q (CoQ) o ubichinone
IL FMN e il CoQ (che possono trasferire uno o due
elettroni per volta) sono il punto di contatto tra il
donatore di due elettroni NADH e i citocromi accettori di
un solo elettrone
29
Forma
ossidata
Forma radicalica
Forma ridotta
30
• I centri Fe-S, come i nucleotidi flavinici, sono strettamente legati
alle proteine.
•Il ferro è legato allo zolfo elementare e ai gruppi tiolici di cisteine
messe a disposizione dalla proteina.
•Benchè in un centro possano essere presenti vari atomi di ferro, i
centri ferro-zolfo partecipano a reazioni di trasferimento di un solo
elettrone
Esempi di centri ferro-zolfo
31
• I citocromi rappresentano l’ultima classe di componenti che partecipano al trasporto
degli elettroni.
•I citocromi sono delle proteine contenenti eme.
•Ciascun citocromo è costituito da una catena polipeptidica e da un gruppo eme
specifico.
•Il ferro presente nei citocromi, ma non quello nell’emoglobina, subisce delle ossidoriduzioni fisiologiche passando dallo stato ferroso (2+) a quello ferrico (3+) e viceversa
Struttura del citocromo c mitocondriale
32
Esempi di gruppi eme
I gruppi eme sono composti
tetrapirrolici contenenti
ferro
33
Sequenza del trasporto degli elettroni
4 H+
Complesso I
Complesso II
Succinato
deidrogenasi-FAD
FeS, cit b560
34
Complesso I (NADH deidrogenasi)
NADH
Q
NADH deidrogenasi
(FMN)
4 H+
4 H+
35
Complesso II: catalizza l’ossidazione del FADH2 da parte del CoQ
FADH2 + CoQ (ossidato)
FAD + CoQ
(ridotto)
4 H+
Complesso I
Complesso II
Succinato deidrogenasi/
a glicerofosfato deidrogenasi
36
Il complesso III catalizza l’ossidazione del CoQ (ridotto) da parte del
citocromo c
CoQ (ridotto) + citocromo c
citocromo c (ridotto) + CoQ (ossidato)
(ossidato)
4 H+
Complesso I
Complesso II
37
Ciclo Q :
1) accoppiamento del trasferimento degli e(dal CoQ al cit.c) con il trasporto dei
protoni transmembrana.
2) facilita il passaggiio dall’ubichinolo
(che trasporta 2 e-) al cit.c (che trasporta
1 e-)
(*)
(*)
il semichinone trasferisce l’e- prima ad un
centro FeS detto Centro di Rieskie e poi al cit.c1.
38
Ciclo Q:
1) e-
centro FeS
ridotto
cit. c1
cit. c
(*)
2) e-
cit. bL
cit. bH
UQ
(ubichinone
ossidato)
ubichinone
ridotto
(semichinonico)
che capta due protoni
dal versante della matrice
per formare QH2
39
40
Il complesso IV (citocromo c-ossidasi) catalizza l’ossidazione del citocromo
c ridotto da parte dell’O2, l’accettore terminale degli elettroni nel
processo di trasporto degli elettroni
citocromo c
(ridotto)
4 H+
2 H+
Complesso I
citocromo c (ossidato) + H2O
+ ½ O2
Complesso II
citocromo c
ossidasi
41
42
43
Anemia da carenza di Ferro
Fabbisogno di ferro
in un uomo adulto: 1mg/die
in una donna in età fertile: 2mg/die
in una donna in gravidanza: 3mg/die
Il ferro è necessario per il mantenimento di una quantità normale di Hb,
di citocromi e di centri ferro-zolfo.
44
45
46
47
48
Microfotografia elettronica di
particelle submitocondriali sulla
membrana mitocondriale interna.
49
Struttura del complesso mitocondriale
dell’ATP sintasi
50
51
L’ENERGIA LIBERA
A
B
DG= GB - GA
il cambiamento di energia libera è uguale alla differenza delle energie libere di A e B
Se la [B] è più elevata della [A], la reazione A
è favorita, è spontanea, è esoergonica: DG0
Se la [A] è più elevata della [B], la reazione A
è sfavorita, non spontanea, endoergonica: DG0
B
0 (energia libera negativa)
B
0 (energia libera positiva)
52
Il trasferimento di energia dai coenzimi ridotti ai legami fosforici ad alta energia
NADH + H+ + ½ O2
NAD+ + H2O
DG°’= -220 kJ/mol (-52 kcal/mol)
ADP + Pi
ATP + H2O
DG°’= -30,5 kJ/mol (-7,3 kcal/mol)
53
Il dinitrofenolo, farmaco dimagrante
54
Proteine disaccoppianti
UCP, UnCoupling Proteins
UCP 1 (termogenina): presente nel tessuto adiposo bruno
UCP 2:ubiquitaria
UCP 3: muscolo scheletrico
UCP 4,UCP 5: cervello
55
56
57
58
Regolazione della fosforilazione ossidativa
regolazione retroattiva: ADP stimola la respirazione e la sintesi di ATP
ATP le inibisce
regolazione mediata da modifiche covalenti:
il complesso IV fosforilato è inattivo (PKA) e defosforilato è attivo (fosfatasi)
59
Nella riduzione di O2 si cela un pericolo:
-il trasferimento di 4 elettroni dà origine a prodotti innocui
- il trasferimento di un singolo elettrone forma un anione superossido
-il trasferimento di 2 elettroni genera un perossido
O2 e-
.
O2 - e-
O2 2-
60
I derivati tossici dell’ossigeno molecolare (ROS) vengono rimossi da enzimi protettivi
superossido
dismutasi
.
2 O2 + 2H+
.
2 H2O
Catalasi
2 GSH + H2O2
O2 + H2O2
O2 + 2H2O
GSSG + 2 H2O
61
Miopatie mitocondriali
-il lattato si accumula nel liquido cerebrospinale
-crampi, debolezza muscolare, encefalopatia
-esame dei MT del tessuto muscolare
-trattamento con CoQ10
-Carenza di CoQ10: forma rara che colpisce i bambini.
-Neuropatia ottica ereditaria di Leber (mutazione del Complesso I)
-I mitocondri svolgono un ruolo centrale nell’apoptosi
62












