FOSFORILAZIONE OSSIDATIVA
Lo scopo ultimo dei processi metabolici ossidativi
è quello di canalizzare l’energia contenuta nello
scheletro carbonioso di zuccheri, ac. grassi e
amminoacidi nella sintesi di molecole di ATP.
IN CHE MODO?
processi ossidativi catabolici producono NADH e
FADH2 (EQUIVALENTI RIDUCENTI)
dalla loro riossidazione si può ottenere l’energia
necessaria alla sintesi di ATP.
avviene a carico della catena di trasporto
degli elettroni mitocondriale localizzata nella
Membrana mitocondriale interna (eucarioti)
o
nella Membrana plasmatica (procarioti)
Nelson • Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright © 2014
19 | 1
NADH e FADH2 si riossidano trasferendo gli e- a centri redox organizzati in complessi
Complesso I
NADH-deidrogenasi
Complesso II
Succinatodeidrogenasi
Il flusso degli
elettroni lungo la
catena di trasporto
è spontaneo, ogni
reazione redox
risulta esoergonica
Complesso III
Citocromo CUbichinolo
-ossidoreduttasi
Complesso IV
Citocromo
C-ossidasi
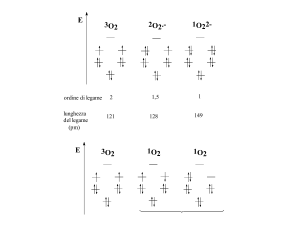
La sequenza dei trasportatori lungo la membrana interna mitocondriale non è casuale: sono
disposti secondo un ordine di potenziale di riduzione (E 0’) crescente, che garantisce un
processo redox globalmente esoergonico
NADH + H+ + ½ O2
NAD+ + H2O
ΔG0’complessivo = -nFΔE0’ = -2(96.5)[0.82-(-0.32)] = -220 KJ/mol
COMPLESSO I (14>>46 componenti proteiche)
(NADH-deidrogenasi o NADH:ubichinone ossidoreduttasi)
NADH +
H+ +
H:- + H+
FMN
NAD+ + FMNH2
1 :H- trasferito sull’FMN
1H+ 1eFMNH2 +
FMNH· + Fe+2S
1H+ 1e+3
FMNH· + Fe S
FMN + Fe+2S
Fe+3S
FMNH2 cede i 2 elettroni 1 alla
volta ai centri Fe-S e rilascia 2 H+
alla matrice
I centri Fe-S trasportano solo ee solamente 1 alla volta.
Sono presenti 8 centri Fe-S che costituiscono un
canale per gli e- e li indirizzano all’accettore finale:
UBICHINONE
Nelson • Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright © 2014
Proviene dai
cicli ossidativi
19 | 4
D. Voet, J.G. Voet, C.W. Pratt, FONDAMENTI DI BIOCHIMICA 2/E, Zanichelli Editore S.p.A. Copyright © 2007
CENTRI Fe-S (è lo ione ferro che trasferisce l’e- cambiando stato di
ossidazione: Fe3+ > Fe2+ )
Fe4-S4
Fe-S
Fe2-S2
D. Voet, J.G. Voet, C.W. Pratt, FONDAMENTI DI
BIOCHIMICA 2/E, Zanichelli Editore S.p.A.
Copyright © 2007
4H+ vengono traslocati nello spazio intermembrana
per ogni NADH che è ossidato
Si dirige al
complesso III
Nella porzione del complesso
integrata nella membrana mit.
interna è localizzata una
pompa protonica (antiporto
H+/Na+).
Attivata da cambiamenti conformazionali associati al flusso di eall’interno del complesso proteico.
Il complesso I può accettare e- anche dal NADPH (con bassa efficienza). Il NADPH è
preferibilmente riossidato in altre vie (biosintesi) o se necessario attraverso una
transidrogenasi
Rifornisce la catena di
NADPH + NAD+
NADP+ + NADH
trasporto mitocondriale
COMPLESSO II (4 subunità proteiche e 5 gruppi prostetici)
(Succinato deidrogenasi o Succinato:Ubichinone ossidoreduttasi)
Enzima coinvolto nel ciclo di Krebs, catalizza l’ossidazione del
succinato a fumarato a carico del FAD.
Succinato + FAD
QH2
2H+ 2e-
Fumarato + FADH2
Verso il complesso III
Il FADH2 trasferisce i 2 e- 1 alla volta ai centri 2Fe2S che cedono poi gli e- all’ubichinone (Q) che si
riduce a Ubichinolo (QH2) accettando anche 2 H+
dalla matrice.
Nel complesso II è presente anche un gruppo eme
b che protegge dalla formazione di specie reattive
dell’O2 (ROS): “acchiappa e- in fuga”
Il complesso II non è associato ad una pompa protonica, d’altra parte la redox che avviene non
libererebbe energia sufficiente ad attivare la traslocazione di H+
Nelson • Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright © 2014
19 | 8
La formazione di radicali liberi dell’O2 è frequente durante il trasporto di e-.
Sono però vari i meccanismi di difesa dalle specie reattive dell’O2 (ROS).
Altri agenti antiossidanti oltre
al glutatione sono l’ac.
Ascorbico, le vitamine E, A che
agiscono come trappole di
radicali liberi.
Nelson-Cox, I principi di Biochimica di Leningher 5/E, Zanichelli Ed. S.p.A. Copyright © 2010
L’ubichinone o coenzima Q rappresenta il punto di raccolta degli e- provenienti dai
processi ossidativi catabolici.
Sistema navetta glicerolo
3-fosfato (elettroni del
NADH citosolico prodotto
nella glicolisi)
(ETF) Flavoproteina
trasportatrice di e-
β-ossidazione acidi
grassi: si producono
equivalenti riducenti
di FADH2
Nelson-Cox, I principi di Biochimica di Leningher 5/E, Zanichelli Ed. S.p.A. Copyright © 2010
contiene 1 centro 2Fe-2S
in cui il Fe è coordinato
anche da residui di His
COMPLESSO III (11 componenti)
(Ubichinolo:citocromo c ossidoreduttasi)
Subunità principali:
2 coppie di Citocromo b
(2 gruppi eme: bH e bL)
2 coppie di Citocromo C1
(1 gruppo eme c1)
2 coppie di ISP
(1 centro 2Fe-2S)
cit c
Eme c1
citocromo c1
Questi dimeri sono inseriti nella membrana
mit. interna.
Citocromo C = accettore finale di eÈ una subunità mobile e solubile, nello stato
ossidato si associa al complesso sul lato
esterno.
citocromo b
I citocromi hanno come gruppo prostetico dei gruppi eme che coordinano uno ione
Fe3+ = centro redox adibito al trasferimento di elettroni
Nelson • Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright © 2014
19 | 11
Fe-protoporfirina IX (citocromi b, Hb, Mb)
Eme a (citocromi a)
Eme c (citocromi c) legato
alla proteina con legami
tioeteri
Suddivisi in base allo spettro
di assorbimento della luce.
Hanno potenziali di
riduzione differenti (a seconda
delle interazioni stabilite dal Fe
con i residui amminoacidici
della proteina)
Ossidazione del QH2 nel complesso III
A) 1a molecola di QH2 si lega vicino all’eme bL : rilascia 2 elettroni e si ossida a Q
liberando 2H+ nello spazio intermembrana
1e-
Eme bL
Eme bH
e-
dalla matrice
1e-
ISP (Fe2-S2)
Eme c1
Q
H+
QH· Rimane
legato nel
complesso
Cit c
Complesso IV
B) 2a molecola di QH2: rilascia 2 elettroni e si ossida a Q liberando 2H+ nello
spazio intermembrana
1e-
Eme bL
Eme bH
e-
dalla matrice
1e-
ISP (Fe2-S2)
Eme c1
QH·
H+
QH2
Rilasciato
Cit c
Complesso IV
Per ogni 2 QH2 riossidati si riforma 1 QH2: complessivamente 2 e- sono trasferiti sul cit. c
e 4 H+ sono traslocati nello spazio intermembrana
COMPLESSO IV (13 subunità) – proteina transmembrana- (citocromo c ossidasi)
Catalizza l’ossidazione del citocromo c e la riduzione dell’O2 ad H2O
Subunità II = 1 centro redox:
CuA (centro binucleare a 2 atomi di rame) riceve e- dal CytCrid
2H+
Subunità I = 3 centri redox:
eme a (Fe3+)
eme a3 (Fe3+)
Centro binucleare
CuB
Riduce l’O2
Il passaggio di e- attraverso i centri redox libera
energia sufficiente da attivare una canale
protonico: 2H+ traslocati fuori per ogni ½ O2
che viene ridotto ad 1 H2O
2CytC
-
2e
½ O2
Tutti i centri redox del complesso IV
trasferiscono 1 e- per volta. Per ridurre
completamente l’O2 ad H2O occorrono 4 e(quindi devono giungere al complesso IV 4 cit
c ridotti) e 4H+ (sottratti dalla matrice).
Nelson • Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright © 2014
2H+
2H+ 1 H2O
19 | 14
Per ogni NADH riossidato i complessi della catena di trasporto degli e- traslocano 10 H+ nello
spazio intermembrana, per ogni FADH2 riossidato sono traslocati 6 H+.
1NADH >>>> 10 H+out >>>> ½ O2 → H2O
Nella catena di trasporto sono trasferiti 2 e+
1 FADH2 >>>> 6 H out >>>> ½ O2 → H2O
Riduzione completa di O2
2NADH >>>> 20 H+out >>>> O2 → 2H2O
Trasferimento di 4 e-
Riduzione completa di O2
2FADH2 >>>> 12 H+out >>>> O2 → 2H2O
Trasferimento di 4 e-
I complessi I, III e IV generano un gradiente protonico che è sia un gradiente di
concentrazione [H+] sia un gradiente elettrico. L’energia libera rilasciata dalle
reazioni redox lungo la catena di trasporto degli e- viene immagazzinata come
FORZA MOTRICE PROTONICA (teoria chemiosmotica di Mitchell)
+
A cavallo della membrana mitocondriale interna si
stabilisce una differenza di potenziale
elettrochimico (differenza di carica e di pH)
Spazio
intermembrana
Matrice
FORZA MOTRICE
PROTONICA
I protoni sono spinti a rientrare nella matrice
secondo gradiente e ciò rende disponibile energia
libera che viene utilizzata per la sintesi di ATP
La porta d’accesso verso la matrice
per i protoni è il canale protonico
dell’ATP-sintasi, l’enzima che
sintetizza ATP.
Nelson • Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright © 2014
19 | 16





![(Microsoft PowerPoint - Norme x esami [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/006672086_1-e4d714634554d1d8872697f43f2abb68-300x300.png)