Scheda di lavoro relativa all'esperienza di laboratorio di
TERMODINAMICA
Scopo dell'esperienza:
stabilire quando una reazione sviluppa o assorbe calore e calcolare il calore scambiato;
calcolare l'entalpia molare di reazione.
Premessa teorica e pratica:
Le misure di calore che riguardano la solubilità di solidi in acqua e le comuni
reazioni di laboratorio, tutti processi condotti a pressione/temperatura costante, possono
essere eseguite in modo semplice con un calorimetro, dove il mescolamento dei reattivi è
garantito da un …………………….. e la misura delle temperature condotta con un
………………………
Il calorimetro permette di misurare la quantità di massa/calore scambiata dalla reazione che avviene in
soluzione acquosa e la relativa massa di acqua (detta liquido calorimetrico), supponendo tutto il sistema
aperto/chiuso/isolato. Come è noto un sistema isolato scambia/non scambia né ………………. né
………………….. con l’ambiente circostante.
Il calore scambiato a pressione costante coincide con la variazione di energia interna U/entalpia
H/entropia S/energia libera di Gibbs G/temperatura T. L’ ………… è una grandezza cinetica/termodinamica che
dipende/non dipende solamente dallo stato del sistema, si tratta dunque di una funzione di stato/percorso. Nel caso
particolare di una reazione chimica, la sua variazione ΔH nel corso di una reazione chimica, pari a ΔH = Hfinale Hiniziale, è uma misura della differenza tra l’energia liberata per la …..……….……….. di nuovi legami e di quella
spesa per la scissione dei legami nei reattivi/prodotti.
L’entalpia molare di reazione è ........................................................................................................................
…………………………………………………………………………………………………………………………
Nel caso reagiscano sostanze allo stato gassoso ΔH può differire molto da ΔU (essendo H=U+PV) ma, nel
caso di reazioni a cui partecipano solo solidi e liquidi si ha che ΔH≈ΔU. L’energia interna U di un sistema è data
dalla somma dell’energia cinetica e potenziale di tutte le particelle che lo costituiscono. Un sistema varia il suo
contenuto di energia termica solo se si ha …………………….. di temperatura; varia il suo contenuto di energia
chimica solo se cambiano la sua composizione a causa di ……………………….chimiche o se si verificano
passaggi di ………………………….
Il primo principio della termodinamica afferma che …………………………………………………………
…………………………………………………………………………………………………………………………
Materiale: ...................................................................................................................................................................
.........................................................................................................................................................................................
Reattivi: .....................................................................................................................................................................
Procedimento con eventuali osservazioni personali:
1a PROVA: .....................................................................................................................................................................
…………………………………………………………………………………………………………………………
2a PROVA:......................................................................................................................................................................
…………………………………………………………………………………………………………………………
3a PROVA:......................................................................................................................................................................
…………………………………………………………………………………………………………………………
4a PROVA:......................................................................................................................................................................
…………………………………………………………………………………………………………………………
La pesata della soda solida NaOH va eseguita rapidamente in quanto ……………………………………………….
Elaborazione dei risultati ottenuti:
reazione di…
Scrivo le reazioni per ciascuna prova:
1a prova:
NaOH(s) ............ (aq) + .............(aq)
…………… .............................................. ionica
2a prova:
NH4Cl(s) ............ (aq) + .............(aq)
............................................................................
3a prova:
HCl(aq) + NaOH(aq) .............(aq) + .............(l)
………………......................................acido/base
4a prova:
HCl(aq) + NaOH(s) .............(aq) + ..............(l)
................................... e ........................................
Commento alla tabella
n° prova
Quantità di reattivo
1
mNaOH=.................. g
2
mNH4Cl=.................. g
3
VNaOH=................. ml
Massa
T=(Tf-Ti)
Reazione
Soluzione (g)
(°C)
endo/esotermica
Q (J)
n (mol)
-H (J/mol)
VHCl= .................. ml
4
mNaOH=.................. g
VHCl=.................. ml
La massa della soluzione si ottiene sommando alla massa d'acqua la massa del soluto. Si assume che le
soluzioni abbiano uguale/diversa densità dell'acqua (pari a ………..) e il suo stesso calore specifico (pari a
………….). Il volume della soluzione si suppone pari a quello dell’acqua.
Osservo che là dove si ha un aumento di temperatura della soluzione la reazione è endotermica/esotermica
poiché il calore ceduto/assorbito va a diminuire/aumentare la temperatura del sistema; viceversa osservo che là
dove si ha una diminuzione di temperatura la reazione è endotermica/esotermica poiché il calore ceduto/assorbito
va a diminuire/aumentare la temperatura del sistema.
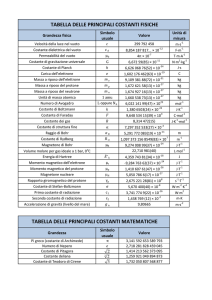
Il calore scambiato è stato calcolato applicando la formula Q = .........................................., dove c, il
calore specifico della soluzione viene posto pari a 4,18 J/(Kg), ………. è la massa della soluzione e ΔT= ….…
Un esempio di calcolo è il seguente: ………………………………………………………………………………..
…………………………………………………….........................................................................................................
Stiamo assumendo inoltre che: il recipiente non scambi/scambi calore né con l’ambiente né con il liquido
calorimetrico e che la presenza delle piccole quantità dei reagenti e prodotti di reazione sia quasi del tutto
trascurabile.
Per calcolare il calore molare di reazione (J/mol) procedo come segue:
Per ogni reazione calcolo il numero di moli dei reagenti e le riporto nella tabella:
1a prova:
nNaOH ......................................................................................................................................................................................................... mol
2a prova:
nNH 4Cl ......................................................................................................................................................................................................... mol
3a prova:
nNaOH ......................................................................................................................................................................................................... mol
nHCl ......................................................................................................................................................................................................... mol
4a prova:
nNaOH ......................................................................................................................................................................................................... mol
nHCl ......................................................................................................................................................................................................... mol
divido il calore scambiato per il rispettivo numero di moli e ottengo il calore molare di reazione o entalpia molare
di reazione H (scelgo la soda come reagente di riferimento per le reazioni 3 e 4):
osservo che la reazione somma delle reazioni 1 e 3 corrisponde proprio alla reazione n. …….. e che anche
l’entalpia molare calcolata è circa la ........................................... Ciò dimostra che H è davvero una funzione di
…………………………………..
Conclusioni dell'esperienza:
Tre delle reazioni esaminate (relative alle prove 1, ….., …….) si formano molecole più/meno stabili con legami
più/meno forti; l’energia potenziale del sistema aumenta/diminuisce e si assorbe/produce calore che fluisce verso
l’ambiente. Nella reazione endotermica accade invece che ....................................................................................
.........................................................................................................................................................................................
Si tratta in tutti e 4 i casi di processi spontanei per cui Δ….<0. Analizzando il fattori entalpico (che misura la spinta
alla formazione di legami forti/deboli) ed entropico (che misura la tendenza al maggior/minor disordine) per ogni
reazione osservo che:
valore di ΔH
valore di ΔS
valore di
ΔG= ΔH-T·ΔS
<0 (favorevole)
……. (favorevole)
………………
…………………..
…………………..
…………………..
3
…………………..
…………………..
…………………..
………………………………………………
……………………………………………….
4
…………………..
…………………..
…………………..
………………………………………………
………………………………………………
casi
1
2
commento
entrambi i fattori sono favorevoli in quanto la
reazione è esotermica e porta ad un aumento
di disordine per dissociazione del soluto in
acqua
La variazione di energia libera è negativa in
quanto il fattore entropico prevale su quello
………………. Ciò è garantito soltanto a
alte/basse temperature