Regione
cerniera
Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica
dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da
heavy, in rosso nel disegno) e due leggere (L, light, in blu). Le due catene H
e le due catene L sono tra loro identiche. Ciascuna catena presenta nella
parte COOH terminale una regione formata da una sequenza di aminoacidi
uguali in tutti gli anticorpi della stessa classe (regione costante). Al contrario
nella parte NH2 terminale la sequenza degli aminoacidi varia tra anticorpo ed
anticorpo (regione variabile).
Ognuna di queste quattro catene è costituita dalla ripetizione di strutture
simili, ciascuna costituita da 100-110 aminoacidi e contenente un ponte S-S
(nel disegno rappresentate come strutture anulari).
Le catene pesanti e quelle leggere sono tenute unite tra loro da ponti S-S (in
nero)
Considerando la forma di base di una Ig (il monomero) si vede che è una
struttura simmetrica, a forma di Y, in cui i bracci sono flessibili permettendo
così all’anticorpo di poter legare due antigeni uguali anche se posti a diversa
distanza. La flessibilità della molecola Ig è conferita dalla presenza di una
regione della catena H, detta regione cerniera che permette ampie
rotazioni spaziali (freccia verde).
1
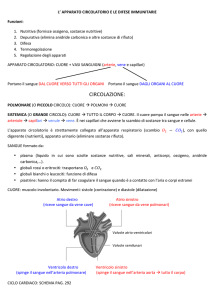
Quando il sangue periferico viene fatto coagulare e il coagulo contenente
le cellule ed i fattori della coagulazione, viene eliminato, rimane la frazione
liquida del sangue chiamata siero. Sottoponendo il siero ad elettroforesi
(esame di laboratorio in cui le proteine contenute in un fluido vengono
separate mediante l’applicazione di un campo elettrico) ad un pH
lievemente basico (pH 8,2) si riconoscono cinque gruppi di proteine con
caratteristiche globulari, caratterizzate ciascuna da una differente motilità
elettroforetica (velocità di migrazione verso l’anodo, il polo positivo del
campo elettrico). La frazione più rappresentata e con maggiore mobilità
elettroforetica è quella costituita dalla albumina, seguita poi dalla frazione
contenente le alfa1, le alfa2 e le beta globuline. La frazione proteica la cui
quantità aumenta nel sangue di un individuo vaccinato rispetto ad uno non
vaccinato, è quella detta gamma e che contiene gli anticorpi o
immunoglobuline. Dall’ampiezza del piccolo elettroforetico, si evince che
la frazione gammaglobulinica è caratterizzata da un insieme di proteine
con mobilità elettroforetiche differenti. Questa eterogeneità della frazione
gammaglobulinica ha costituito uno dei maggiori ostacoli allo studio della
struttura degli anticorpi. Il problema venne risolto grazie allo studio del
siero dei pazienti affetti da mieloma multiplo in cui la frazione
gammaglobulinica è rappresentata nella quasi totalità da un singolo tipo di
anticorpi, derivati da una unica plasmacellula che, in seguito alla
trasformazione neoplastica, prolifera in modo incontrollato
2
Le Ig si trovano ancorate alla membrana plasmatica dei linfociti B, dove
svolgono la funzione di recettore antigene-specifico, oppure, una volta
secrete dalle plasmacellule, nei fluidi biologici quali plasma, secrezioni
mucosali, fluidi interstiziali dei tessuti e latte, dove svolgono la funzione di
protezione nei confronti dell’antigene. Le Ig legano con molta specificità
l’antigene in forma nativa. Questo legame scatena una serie di eventi che
culminano con la neutralizzazione o distruzione dell’antigene stesso.
Inoltre gli anticorpi,
Inoltre,
anticorpi grazie al legame con recettori per le Ig rivestono la
superficie di alcune cellule del sistema immunitario.
3
La parte NH2 terminale delle catene H e della catena L (in arancio nel disegno) presenta
una sequenza di aminoacidi che è diversa per ogni anticorpo,
anticorpo e che pertanto viene detta
regione variabile. Le due porzioni variabili delle catene H sono identiche tra loro come
lo sono quelle delle due catene L. Le regioni variabili di una catena H e di una catena L
formano il sito combinatorio che lega l’antigene (nel disegno rappresentato come una
freccia verde). Ogni Ig è formata da due catene H e da due catene L uguali, per cui ogni
anticorpo presenta due siti che legano l’antigene.
Nel nostro organismo esistono almeno 1011 Ig con siti combinatori diversi; questa grande
varietà permette ad una persona di riconoscere e legare un vastissimo numero di
antigeni diversi e quindi di potersi difendere da un numero molto grande di microbi e
sostanze penetrate al suo interno.
Le Ig si legano ad ogni tipo di molecola tra cui zuccheri, lipidi, ormoni e anche
macromolecole complesse quali carboidrati complessi, fosfolipidi, acidi nucleici e
proteine Normalmente i microbi e le macromolecole sono più grandi del sito
proteine.
combinatorio e quindi le Ig legano solo piccole porzioni della macromolecola. La capacità
degli anticorpi di legare le molecole in forma nativa, come sono in natura, è in contrasto
con la capacità del recettore per l’antigene dei linfociti T (il TCR) che invece riconosce e
lega solo i peptidi quando sono presentati nelle tasche delle glicoproteine del complesso
maggiore di istocompatibilità.
4
Normalmente i microbi e le macromolecole sono più grandi del sito
combinatorio e quindi le Ig legano solo piccole porzioni della
macromolecola. La capacità degli anticorpi di legare le molecole in forma
nativa, come sono in natura, è in contrasto con la capacità del recettore
per l’antigene dei linfociti T (il TCR) che invece riconosce e lega solo i
peptidi quando sono presentati nelle tasche delle glicoproteine HLA.
5
Il legame che un’Ig stabilisce con l’antigene dipende dalla
complementarietà spaziale tra il sito combinatorio e l’antigene. I
legami tra l’antigene e il sito combinatorio della Ig sono legami deboli, non
covalenti. Ciò fa si che il legame sia reversibile, cioè l’Ig lega l’antigene o
si distacca da questo in base alla complementarietà tra l’antigene ed il sito
combinatorio dell’Ig e alla quantità di molecole di Ig o di antigene che sono
presenti.
6
7
8
9
10
11
La forza del legame tra Ig ed antigene (l’affinità delle Ig) dipende dalla
complementarietà spaziale che permette il formarsi di numerosi legami
deboli.
12
La parte dell’Ig che non lega l’antigene (la parte Fc, viola chiaro nel
disegno) è responsabile delle funzioni effettrici dell’Ig e quindi ne
determina l’attività biologica. Quando un’Ig ha legato un antigene, si ha un
cambiamento di forma della parte Fc che la rende capace di legare le
proteine del complemento o di legarsi ai recettori dell’Fc.
L’Fc è la parte dell’Ig che lega le proteine del complemento, e così ne
attiva la potente azione biologica. E ancora, L’Fc si lega ai recettori delle
Ig presenti sulla membrana di molte cellule (neutrofili, eosinofili, mastociti,
basofili e cellule NK). L’Fc delle Ig è inoltre responsabile del passaggio
delle Ig nelle secrezioni, tra cui il latte, e permette il passaggio, attraverso
la placenta, degli anticorpi dalla mamma al feto.
La parte Fc delle Ig regola la vita media delle Ig, e quindi la quantità di Ig
presenti in circolo e nei tessuti.
Le Ig possono essere costituite da cinque tipi diversi di catene pesanti,
ognuna con un differente parte Fc. Le cinque catene pesanti sono dette:
alfa (α), delta (δ), epsilon (ε), gamma (γ) e mu (µ). A seconda del tipo di
catena pesante utilizzata dall’anticorpo si distinguono cinque diverse
classi o isotipi di Ig: le IgA, IgD, IgE, IgG e IgM.
Ciascuna classe di Ig svolge funzioni effettrici differenti, che dipendono
dalle caratteristiche dell’Fc.
13