ATTIVITA' OTTICA DEI COMPOSTI CHIRALI
Alcuni composti chirali possono manifestare attività ottica se colpiti da un fascio di luce
polarizzata.
Luce polarizzata
Un fascio di luce è costituito da onde elettromagnetiche, le quali oscillano sugli infiniti piani
perpendicolari alla direzione di propagazione; un fascio di luce che attraversi un
polarizzatore, (come un prisma), vedrà fuoriuscire da quest'ultimo solo le onde oscillanti su
un unico piano, tale è la luce piano-polarizzata, o semplicemente luce polarizzata. Il
polarimetro è lo strumento che misura il grado di polarizzazione di un fascio di luce.
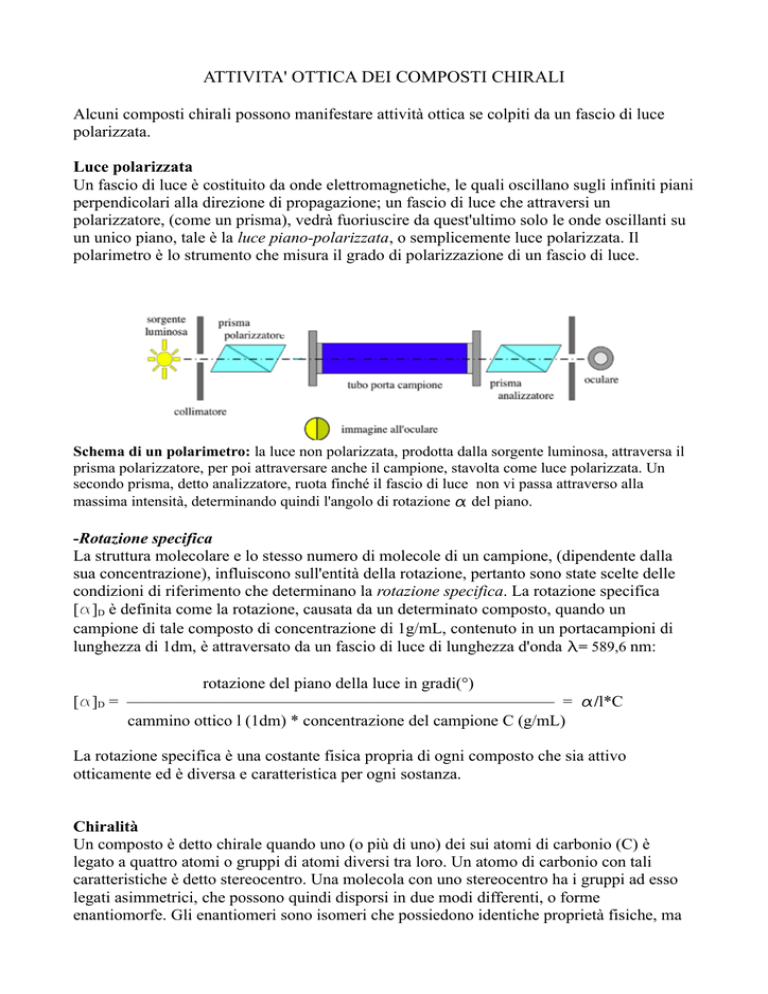
Schema di un polarimetro: la luce non polarizzata, prodotta dalla sorgente luminosa, attraversa il
prisma polarizzatore, per poi attraversare anche il campione, stavolta come luce polarizzata. Un
secondo prisma, detto analizzatore, ruota finché il fascio di luce non vi passa attraverso alla
massima intensità, determinando quindi l'angolo di rotazione a del piano.
-Rotazione specifica
La struttura molecolare e lo stesso numero di molecole di un campione, (dipendente dalla
sua concentrazione), influiscono sull'entità della rotazione, pertanto sono state scelte delle
condizioni di riferimento che determinano la rotazione specifica. La rotazione specifica
[a]D è definita come la rotazione, causata da un determinato composto, quando un
campione di tale composto di concentrazione di 1g/mL, contenuto in un portacampioni di
lunghezza di 1dm, è attraversato da un fascio di luce di lunghezza d'onda l= 589,6 nm:
rotazione del piano della luce in gradi(°)
[a]D = —–———————————————————————— = a/l*C
cammino ottico l (1dm) * concentrazione del campione C (g/mL)
La rotazione specifica è una costante fisica propria di ogni composto che sia attivo
otticamente ed è diversa e caratteristica per ogni sostanza.
Chiralità
Un composto è detto chirale quando uno (o più di uno) dei sui atomi di carbonio (C) è
legato a quattro atomi o gruppi di atomi diversi tra loro. Un atomo di carbonio con tali
caratteristiche è detto stereocentro. Una molecola con uno stereocentro ha i gruppi ad esso
legati asimmetrici, che possono quindi disporsi in due modi differenti, o forme
enantiomorfe. Gli enantiomeri sono isomeri che possiedono identiche proprietà fisiche, ma
ruotano il piano della luce polarizzata che li colpisce in senso opposto l'uno rispetto all'altro:
in questo consiste l'attività ottica dei composti chirali.
La chiralità, quindi, oltre a determinare l'esistenza degli enantiomeri, è anche condizione
necessaria, ma non sufficiente, affinché una molecola mostri attività ottica; infatti alcuni
composti chirali ruotano il piano della luce polarizzata che li attraversa verso sinistra o
verso destra.
Lo schema di struttura di seguito mostra il tartrato di sodio e ammonio, la stessa molecola
studiata da Pasteur quando si rese conto dell'esistenza di forme “speculari” di una stessa
molecola:
-
COO Na
│
H — C — OH
│
HO — C — H
│
-
+
COO NH
+
Una miscela di un composto chirale che abbia un solo stereocentro contiene il 50% di
ciascun enantiomero; essa è otticamente inattiva, in quanto la rotazione del piano della luce
polarizzata, negli enantiomeri di una stessa molecola, è opposta in senso ma uguale in
valore assoluto. Gli enantiomeri di una molecola mostreranno attività ottica se separati tra
loro, come fece Pasteur, quando notò che i cristalli di tartrato di sodio e ammonio erano
presenti, come precipitati nella sua soluzione, in due forme speculari.
Il piano della luce polarizzata viene ruotato dai composti otticamente attivi in senso orario o
in senso antiorario; le molecole che mostrano attività ottica vengono quindi suddivise in
molecole levogire, se ruotano il piano della luce verso sinistra (in senso antiorario), e in
molecole destrogire, se ruotano il piano della luce verso destra (in senso orario). Le
molecole levogire sono per convenzione contrassegnate dalla lettera L o dal segno -, quelle
destrogire dalla lettera D o dal segno +. Levogiro e destrogiro non sempre corrispondono
rispettivamente alla notazione S ed R, esistono infatti composti con configurazione S che
sono destrogiri e composti con configurazione R che sono levogiri; l'acido lattico ne è un
esempio:
enantiomero con configurazione S:
2
HOOC
1
OH
H
\
|
/
enantiomero con configurazione R:
1
HO
2
H
\
|
C
C
|
CH3
3
|
CH3
3
Acido(+) lattico
COOH
/
Acido(-) lattico
Una molecola con più di uno stereocentro può avere più di due forme enantiomorfe, infatti il
numero massimo di stereoisomeri che può avere una molecola è pari a 2n, dove n è il
numero di stereocentri nella molecola; gli stereoisomeri calcolati in tal modo non sono però
tutti enantiomeri: sono infatti presenti anche diastereoisomeri, che hanno la stessa
configurazione in almeno un centro chirale, e composti meso, che risultano essere composti
diversi dagli altri isomeri, e quindi con diverse caratteristiche fisiche; inoltre alcuni
stereoisomeri in realtà sarebbero sottoposti ad una tensione sterica troppo elevata per
esistere. Per fare un esempio, l'acido tartarico, avendo due stereocentri, può teoricamente
avere fino a 4 stereoisomeri: l'acido tartarico 2R,3R e l'acido tartarico 2S,3S sono
enantiomeri, perché speculari e non sovrapponibili; gli stereoisomeri con configurazione
2R,3S e 2S,3R sono la stessa molecola: se uno di essi viene ruotato di 180° possono essere
sovrapposti. Ciò deriva dal fatto che la molecola in questo caso è attraversata da un piano di
simmetria, all'altezza del legame tra il secondo e il terzo C; composti di questo tipo risultano
essere achirali pur possedendo stereocentri, e sono detti composti meso:
enantiomero 2R,3R
enantiomero 2S,3S
stereoisomeri 2R,3S e 2S,3R: sono la stessa
molecola achirale attraversata da un piano
di simmetria, quindi un composto meso.
COOH
│
H — C — OH
│
OH — C — H
│
COOH
COOH
│
OH — C — H
│
H — C — OH
│
COOH
COOH
COOH
│
│
H — 2C — OH OH — 2C — H
|
|
-------------------- -------------------|
|
H — 3C — OH OH — 3C— H
│
│
COOH
COOH
I composti chirali otticamente attivi sono gli enantiomeri (levogiro e destrogiro), i quali
sono in genere presenti in una miscela del composto in rapporto 50:50, una miscela di
questo tipo non manifesta, (come già accennato), attività ottica, è definita miscela racemica
ed è indicata con i prefissi uniti d,l o con i simboli ±, ad indicare che le rotazioni del piano
della luce si compensano a vicenda.












