TERMODINAMICA
1° Principio: variabili, lavoro, enunciati
James P. Joule
Antonio Ballarin Denti
[email protected]
VARIABILI TERMODINAMICHE
Lo stato termodinamico di un sistema è descritto
dalle variabili macroscopiche fondamentali
pressione, volume, temperatura
Tali variabili sono legate da un’equazione di stato
IL LAVORO DI UN SISTEMA TERMODINAMICO
Se un sistema si espande può compiere lavoro
(o assorbire lavoro dall’ambiente esterno)
Dato un corpo cilindrico di sezione S che si espande
di un tratto dh. Il lavoro compiuto sarà:
Il lavoro totale per passare dallo stato A a B:
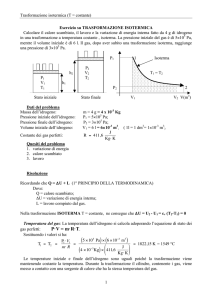
In una trasformazione P-V
P
B
A
V
Se in una trasformazione stato iniziale e stato finale coincidono
si parla di trasformazioni cicliche. Il lavoro compiuto in
un ciclo è l’area racchiusa dalla curva ABCD
P
B
A
C
D
Il lavoro tra ABC sarà
(espansione)
>0
Il lavoro tra CDA sarà
(compressione)
<0
V
Il lavoro totale è positivo: area tratteggiata
In una trasformazione isoterma da V1 a V2 il lavoro sarà:
tenendo in conto:
Se n = 1
PRIMO PRINCIPIO
Si definisce ENERGIA INTERNA di un sistema la somma
delle energie cinetiche delle molecole e l’energia
potenziale delle loro interazioni
L’ ENERGIA INTERNA U è una funzione di stato
P
A
U
B
Ad ogni stato del sistema
C
E
1 unico valore di U
D
V
In un gas perfetto l’energia interna dipende solo dalla T
U
P
A
UA
B
UB
V
Nella trasformazione A B
U è funzione di stato ∆U dipende
solo da A e B e non dal cammino
Convenzione dei segni
Q: calore che il sistema assorbe dall’ambiente esterno
W: lavoro che il sistema fa sull’ambiente esterno
We: lavoro che l’ambiente esterno fa sul sistema
Q>0
W>0
Q<0
W<0
sistema
We<0
We>0
ambiente
Q>0 : calore assorbito
Q<0 : calore ceduto
W,We>0 : lavoro fatto
W,We<0 : lavoro ricevuto
Possiamo allora dire che:
I PRINCIPIO
La variazione di energia interna di un sistema è uguale alla
quantità di energia scambiata con l’ambiente sotto forma
di calore e lavoro, ciascuna con il corretto segno algebrico
Ovvero:
Poiché il lavoro compiuto dal sistema è uguale e
opposto a quello compiuto dall’ambiente:
Si ha:
I PRINCIPIO E TRASFORMAZIONI DI UN GAS PERFETTO
1. TRASFORMAZIONE ISOCORA ( V costante, dV = 0 )
P
B
A
V
Il calore che il sistema assorbe dall’ambiente aumenta
la sua energia interna e quindi la sua temperatura
2. TRASFORMAZIONE ADIABATICA ( Q costante, dQ = 0 )
Se il sistema fa lavoro
sull’ambiente esterno
la sua U diminuisce
3. TRASFORMAZIONE ISOTERMA ( T costante )
P
Allora:
A
Il lavoro fatto dal sistema
(espandendosi) è uguale al
calore assorbito dall’ambiente
W
B
V