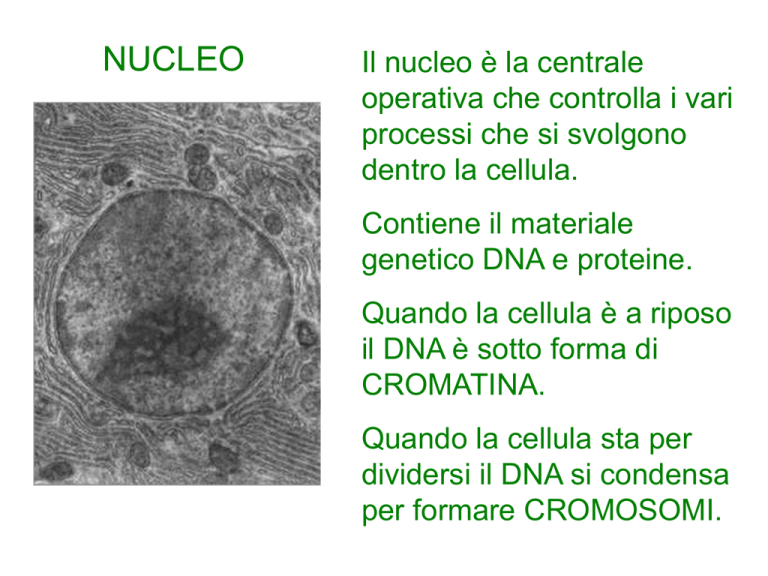
NUCLEO
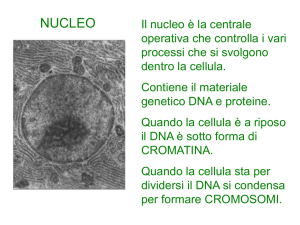
Il nucleo è la centrale
operativa che controlla i vari
processi che si svolgono
dentro la cellula.
Contiene il materiale
genetico DNA e proteine.
Quando la cellula è a riposo
il DNA è sotto forma di
CROMATINA.
Quando la cellula sta per
dividersi il DNA si condensa
per formare CROMOSOMI.
I territori dei
cromosomi sono
le posizioni ben
definite che
essi occupano nel
nucleo della
cellula e che può
cambiare con
la specializzazione
della cellula
Nella figura si vedono i
cromosomi di un fibroblasto
umano, colorati con specifiche
sonde fluorescenti
Nel nucleo delle cellule eucariotiche i cromosomi interfasici occupano territori
distinti; ben poco si sa sulla correlazione tra ordine strutturale della cromatina
e funzionamento del genoma
Studiando in modo tridimensionale il genoma umano e murino (cellule ES e
cellule terminalmente differenziate), si è visto che il genoma dei mammiferi è
suddiviso in specifici domini topologici (grandi megabasi) che sono una
diffusa caratteristica strutturale dell’organizzazione del genoma
Analizzando 17 differenti tessuti di topo sono stati trovati presenti in
tutti:
- 162 piccoli domini con elevata espressione e regolazione genica, che
contengono poche sequenze di ripetizioni di DNA e contengono anche geni
housekeeping;
- 29 grandi domini con bassa espressione e regolazione genica, che
contengono molte sequenze ripetute di DNA e regioni prive o povere di geni
Topological domains in mammalian genomes identified by analysis of chromatin interactions - Dixon et al. – Nature, 485, 376-380, 2012 - doi: 10.1038/nature11082
Classification of topological domains based on gene expression and regulation - Genome. 2013 Jul;56(7):415-423 - Zhao J, Shi H, Ahituv N
I domini della cromatina sono regioni di genoma povere di eterocromatina,
stabili nei diversi tipi di cellule e molto conservati tra le specie, costituiscono
una proprietà intrinseca dei genomi dei mammiferi.
I confini dei domini topologici sono ricchi di CTCF (proteina insulator che
impedisce l’interazione tra promotori ed enhancer), di geni housekeeping, di
geni per tRNA, di retrotrasposoni e SINE, indicando che questi fattori
hanno un ruolo nella strutturazione del genoma in domini topologici.
La stabilità dei domini nei diversi tipi di cellule è sorprendente dato il
funzionamento cellula-specifico della cromatina. La spiegazione è che
l'organizzazione dei domini è stabile nei vari tipi di cellule, ma le regioni
all'interno di ogni dominio sono dinamiche, per partecipare agli eventi
regolatori specifici di ogni tipo di cellula.
Topological domains in mammalian genomes identified by analysis of chromatin interactions - Dixon et al. – Nature, 485, 376-380, 2012 - doi: 10.1038/nature11082
Classification of topological domains based on gene expression and regulation - Genome. 2013 Jul;56(7):415-423 - Zhao J, Shi H, Ahituv N
La cellula è un sistema chimico di auto-organizzazione che utilizza dinamiche epigenetiche
per regolare la funzione del genoma sulla base di una complessa regolazione per propagare la
memoria del destino delle cellule
L’attività trascrizionale condiziona
l’avvolgimento tridimensionale della cromatina che si estende dai territori dei cromosomi
Le regioni represse dei cromosomi tendono a stare vicine tra loro, mentre i domini attivi sono
esposti al di fuori dei territori dei cromosomi, dando luogo a superdomini topologici composti
da più domini funzionalmente simili
La posizione dei territori è vincolata dalla loro associazione con la membrana nucleare, con gli
hubs di trascrizione e con i cluster centromerici
Functional implications of genome topology - Nat Struct Mol Biol. 2013 Mar;20(3):290-9. doi: 10.1038/nsmb.2474 - Cavalli G, Misteli T.
Geni attivi nel nucleo per espressione e coregolazione genica. Questi geni
sono nella eucromatina e si trovano in loop che si estendono al di fuori dei
territori dei cromosomi. Colocalizzano sia in cis che in trans, sono
riconosciuti dai fattori di trascrizione e trascritti dalla RNApol II.
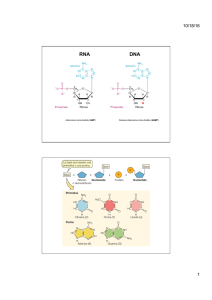
Organizzazione del DNA in Cromatina
Organizzazione di Istoni e DNA nei Nucleosomi
•
L’ottamero di istoni è
formato da due istoni
H2A, due istoni H2B, due
istoni H3 e due istoni H4.
•
L’istone H1 è il più grande
e si trova sempre al di
fuori del nucleosoma.
• la formazione dei nucleosomi è influenzata dalla sequenza del DNA;
• alterazioni del posizionamento dei nucleosomi portano a non funzionamento.
H1
Funzione Linker
H2A
H2B
a-elica
variabile
H3
H4
conservata
N
ISTONI:
piccole
proteine
basiche,
altamente
conservate
I nucleosomi variano nella composizione in istoni, possono incorporare
istoni varianti e/o con modificazioni post-traduzionali delle catene laterali
La struttura della cromatina non è così uniforme e regolare come era stato
precedentemente ipotizzato
Nelle cellule eucarioti il DNA genomico è impacchettato con una uguale
massa di proteine per formare la cromatina
Nucleosoma formato da un avvolgimento di DNA di ~ 145-147 bp intorno ad
un ottamero di istoni
I nucleosomi formano lunghe sequenze che possono subire interazioni a corto
raggio con nucleosomi vicini per formare le fibre di cromatina
Successive interazioni fibra-fibra contribuiscono all’elevato grado di
compattazione osservato nei cromosomi
New insights into nucleosome and chromatin structure: an ordered state or a disordered affair? - Luger et al. - Nature
Reviews Molecular Cell Biology, 13, 436-447, 2012 - doi: 10.1038/nrm3382
La cromatina costituisce una barriera per i fattori di
trascrizione e per tutte le proteine che possono legare DNA
decompattazione
complessi che
rimodellano la
cromatina
compattazione
Gli istoni modificati legano specifiche proteine che
hanno specifici domini:
- bromodomini per legare gli istoni acetilati
- cromodomini per legare i siti metilati
- altri domini per legare i siti fosforilati, poliADP-ribosilati, ubiquitinati
L’acetilazione degli istoni avviene
sui gruppi R positivi delle lisine che
si trovano nelle code degli istoni
L’acetilazione degli istoni allenta la
struttura della cromatina e promuove
l’inizio della trascrizione
Le istone acetiltrasferasi (HAT)
catalizzano il trasferimento di un
gruppo acetile dall’acetil-CoA alla coda
dell’istone, sia nei nucleosomi che nel
citosol, per consentire l’ingresso nel
nucleo degli istoni di nuova sintesi
Le istone deacetilasi (HDAC)
catalizzano la deacetilazione ed
inducono compattazione della
cromatina e repressione della
trascrizione
Le differenze tra
i vari tipi di cellule
di un organismo
dipendono da
differenze
nell’espressione
di geni da un
genoma identico
I geni localizzati
nell’eterocromatina
non sono espressi
Le modificazioni degli istoni e del DNA influenzano sia la
struttura della cromatina che l’espressione genica
Rappresentazione semplificata del rapporto tra cromatina aperta e chiusa. Nello
stato trascrizionalmente permissivo la cromatina è caratterizzata
da istoni iperacetilati e iperfosforilati ad opera di istoni acetil transferasi (HAT) e
protein chinasi (PK).
Queste modificazioni post-traduzionali creano una forza repulsiva tra istoni limitrofi
e DNA che allenta la compattezza della cromatina per dare accesso al
macchinario di trascrizione ed agli attivatori trascrizionali.
La relazione tra metilazione degli istoni, catalizzata dalle istone metil transferasi
(HMT) e le istone demetilasi (HDM) e la loro influenza sulla trascrizione genica è
residuo-specifica. La metilazione del DNA (raffigurata a destra) si verifica su
dinucleotidi CpG e la sua influenza sulla trascrizione del gene dipende dalla
zona cromosomica in cui si verifica.
Ac = acetil, Cr = crotonil, Me = metil, Me1 = monometil, Me2 = dimetil, Me3 = trimetil, P = fosfo, U = ubiquitil.
Histone acetylation: molecular mnemonics on the chromatin - Nat Rev Neurosci. 2013 Feb;14(2):97-111. doi:
10.1038/nrn3427 - Gräff J, Tsai LH.
La posizione dei nucleosomi non è assoluta, ma soggetta a modifiche nel
tempo attraverso il movimento spontaneo o attraverso l'azione di fattori di
modellamento
New insights into nucleosome and chromatin structure: an ordered state or a disordered affair? - Luger et al. - Nature
Reviews Molecular Cell Biology, 13, 436-447, 2012 - doi: 10.1038/nrm3382
Il rimodellamento della cromatina può essere dovuto a modificazione
chimica degli istoni oppure ad un effetto meccanico ATP-dipendente
Modificazione degli istoni
Modellatori ATP-dipendenti
i)
ii )
iii )
iv )
I sistemi modellatori della cromatina ATP-dipendenti sono coinvolti in
numerosi processi fondamentali come la trascrizione, la riparazione del
DNA, la replicazione ed il mantenimento della struttura dei cromosomi
Le loro funzioni sono regolate in una miriade di modi, tra cui modificazioni
post-traduzionali e variazione della loro composizione in subunità proteiche
The regulation of ATP-dependent nucleosome remodelling factors - Mutat Res. 2007 May 1;618(1-2):41-51 - Hogan C,
Varga-Weisz P.
Modellatori della cromatina ATP-dipendenti
scivolamento del nucleosoma
Modificazione della spaziatura tra nucleosomi
I complessi del poro
nucleare (NPC) sono canali
acquosi multiproteici che
attraversano la membrana
nucleare e collegano nucleo
e citoplasma.
Nuclear pore complex composition: a new regulator of tissuespecific and developmental functions - Nat Rev Mol Cell Biol.
2012 Nov;13(11):687-99. doi: 10.1038/nrm3461 - Raices M,
D'Angelo MA.
I complessi
del poro
nucleare
(NPC) sono
canali acquosi multiproteici che
attraversano la membrana nucleare e
collegano nucleo e citoplasma. Gli
NPC, costituiti da copie multiple di
circa 30 diverse proteine note come
nucleoporine (NUPS), hanno una
struttura complessiva che è conservata in tutte le cellule anche
se nuove evidenze suggeriscono che la composizione proteica
degli NPC varia nei diversi tipi di cellule e tessuti. Mutazioni
delle nucleoporine possono causare malattie tessuto-specifiche.
Gli NPC presentano eterogeneità di composizione/funzione
dato che le cellule usano combinazioni delle nucleoporine per
assemblare NPC con proprietà distinte e funzioni specializzate.
Nuclear pore complex composition: a new regulator of tissue-specific and developmental functions - Nat Rev Mol Cell Biol. 2012 Nov;13(11):68799. doi: 10.1038/nrm3461 - Raices M, D'Angelo MA.
Nei complessi del poro
nucleare (NPC) le due
membrane dell’involucro
nucleare sono fuse tra
loro dall’azione di proteine
molto conservate, le
nucleoporine (Nup),
tra cui Nup53 che
per le sue capacità
deformanti le membrane
è cruciale per il montaggio
di NPC.
Dimerization and direct membrane interaction of Nup53 contribute to nuclear pore complex assembly - Vollmer et al. The EMBO Journal (2012) 31, 4072–4084. doi:10.1038/emboj.2012.256
NPC specializzati nel trasporto
nucleare e nell'organizzazione
del genoma. (a,b) schema dei
nuclei di tre diversi tipi di cellule
con NPC di composizione
diversa, che trasportano cargo
diversi o interagiscono con
regioni cromosomiche diverse;
(c) NPC con differenti composizioni
possono coesistere nella stessa
cellula. NPC con proprietà distinte
possono essere utilizzati per
specifiche funzioni cellulari ed
avere un ruolo nell’organizzazione
tridimensionale del genoma.
Nuclear pore complex composition: a new regulator of tissue
specific and developmental functions - Nat Rev Mol Cell Biol.
2012 Nov;13(11):687-99. doi: 10.1038/nrm3461 - Raices M,
D'Angelo MA.
Meccanismi di trasporto nucleare: (a) molecole più piccole di
40 kDa (4-5 nm di diametro) passano attraverso il complesso
del poro nucleare (NPC) per diffusione passiva senza
riconoscimento specifico. Molecole più grandi (proteine ed
alcuni mRNA) si legano a recettori che riconoscono sequenze
di localizzazione nucleare e sequenze di esporto dal nucleo;
Nuclear pore complex composition: a new regulator of tissue-specific and developmental functions - Nat Rev Mol Cell
Biol. 2012 Nov;13(11):687-99. doi: 10.1038/nrm3461 - Raices M, D'Angelo MA.
Meccanismi di trasporto nucleare: (b) ingresso nel nucleo:
una volta legato il cargo nel citoplasma, le importine
interagiscono con NPC, attraversano il canale di trasporto
centrale. All'interno del nucleo legano una GTPasi (RAN·GTP),
induzione cambiamento conformazionale per il rilascio del
cargo, il complesso importina/RAN·GTP trasloca nel citoplasma;
Nuclear pore complex composition: a new regulator of tissue-specific and developmental functions - Nat Rev Mol Cell
Biol. 2012 Nov;13(11):687-99. doi: 10.1038/nrm3461 - Raices M, D'Angelo MA.
Meccanismi di trasporto nucleare: (c) uscita dal nucleo: nel nucleo le
esportine legano cargo e RAN·GTP, e passano attraverso NPC per
raggiungere il citoplasma. Nel passaggio, la proteina RANGAP induce RAN
ad idrolizzare il GTP. Il risultante complesso RAN·GDP interagisce nel
citoplasma con il fattoredi trasporto nucleare NTF2 per traslocare di nuovo
nel nucleo dove il fattore di scambio RCC1 media lo scambio tra GDP e
GPT per riformare nuovamente RAN·GTP.
Nuclear pore complex composition: a new regulator of tissue-specific and developmental functions - Nat Rev Mol Cell Biol. 2012 Nov;13(11):687-99. doi:
10.1038/nrm3461 - Raices M, D'Angelo MA.
Interazione dinamica tra involucro nucleare
e cromatina durante la riprogrammazione
ed il differenziamento. Nelle cellule
differenziate, l'involucro nucleare è regolare
e rotondo. Le proteine della lamina nucleare,
incluse le lamine A e B, sono
strettamente disposte lungo la membrana
nucleare interna. Di conseguenza, il
genoma è organizzato in domini associati
alla lamina (LAD) che costituiscono la
maggioranza dell’eterocromatina della
periferia nucleare. La maggior parte dei
geni associati al differenziamento sono
localizzati tra i LAD lontano dalla
membrana nucleare interna e rimangono
trascrizionalmente attivi. Al contrario, le
cellule staminali pluripotenti non
esprimono le lamine A, e l'associazione
delle lamine B con la cromatina è dinamico.
Questo è associato con una morfologia
nucleare deformata. Inoltre, lo spazio
intermembrana dell'involucro nucleare è più
ampio ed irregolare. Come risultato, il genoma
è lassamente organizzato e raramente si osserva eterocromatina nella periferia nucleare. Inoltre,
i geni specifici delle cellule staminali non sono localizzati nei LAD e sono attivati.
Navigating the epigenetic landscape of pluripotent stem cells - Mo Li1 et al. – Nature Reviews Molecular Cell Biology, 13,
524-535, 2012 - doi: 10.1038/nrm3393
Le cellule di un organismo multicellulare pur avendo gli stessi geni, sono in grado
di rispondere a segnali di differenziamento in modo variabile.
Le cellule sono plastiche, sono in grado di eseguire la loro funzione specializzata
pur mantenendo la capacità di adattarsi ai cambiamenti ambientali.
Questo si realizza attraverso molteplici meccanismi che coinvolgono la regolazione
diretta dello stato della cromatina in risposta a stimoli.
E’ ancora poco conosciuto come le vie di trasduzione del segnale possano
comunicare direttamente con cromatina per cambiare il paesaggio epigenetico, ma
è sempre più evidente la possibilità che la cromatina agisca come sito di
integrazione e di stoccaggio dei segnali.
Nei mammiferi, le informazioni comunicate agli organi sensoriali sono trasmessi al
sistema nervoso centrale, in cui l'informazione viene elaborata e convertita in una
risposta fisiologica.
A livello cellulare, le cascate di signalling trasmettono messaggi tramite
proteine effettrici che raggiungono il nucleo, dove opportuni fattori di trascrizione
attivano/inibiscono l’espressione genica. Questo evento può essere di natura
transitoria, ad esempio quando una cellula deve rispondere ad un evento acuto e poi
tornare al suo precedente stato stazionario.
Emerging roles for chromatin as a signal integration and storage platform - Nat Rev Mol Cell Biol. 2013 Apr;14(4):211-24. doi:
10.1038/nrm3545 - Badeaux AI, Shi Y.