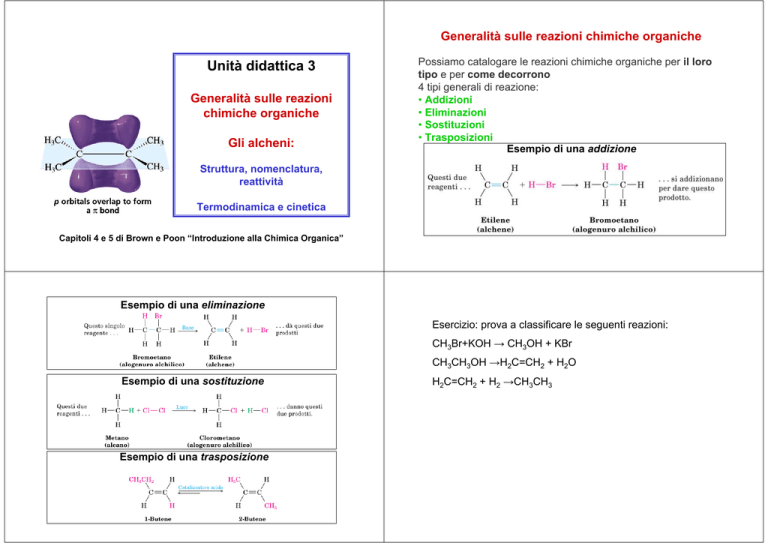
Generalità sulle reazioni chimiche organiche
Unità didattica 3
Generalità sulle reazioni
chimiche organiche
Gli alcheni:
Possiamo catalogare le reazioni chimiche organiche per il loro
tipo e per come decorrono
4 tipi generali di reazione:
• Addizioni
• Eliminazioni
• Sostituzioni
• Trasposizioni
Esempio di una addizione
Struttura, nomenclatura,
reattività
Termodinamica e cinetica
Capitoli 4 e 5 di Brown e Poon “Introduzione alla Chimica Organica”
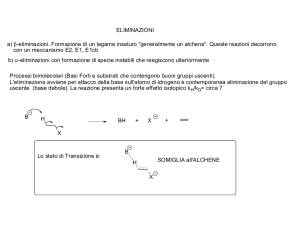
Esempio di una eliminazione
Esercizio: prova a classificare le seguenti reazioni:
CH3Br+KOH → CH3OH + KBr
CH3CH3OH →H2C=CH2 + H2O
Esempio di una sostituzione
Esempio di una trasposizione
H2C=CH2 + H2 →CH3CH3
A seconda di come decorrono (il loro meccanismo) possiamo parlare di:
Rottura omolitica del legame
Rottura eterolitica del legame
In ogni reazione si formano
Formazione omogenica del legame
e/o rompono dei legami
Formazione eterogenica del legame
Reazioni radicaliche o polari
Radicale reagente
Un radicale strappa un
atomo ad un reagente
producendo un altro
radicale in una reazione di
sostituzione radicalica
Oppure può addizionarsi
ad un alchene generando
un nuovo radicale in una
addizione radicalica
La clorurazione del metano è un esempio di reazione radicalica
Fasi di una reazione radicalica:
1.
Iniziazione
2.
Propagazione
3.
terminazione
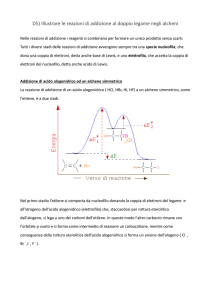
Le reazioni polari avvengono a causa dell’attrazione tra cariche negative e
positive e dipendono quindi dalla diversa elettronegatività degli atomi.
Il carattere polare di un legame dipende anche dalle interazioni dei gruppi
funzionali. Ad esempio il carattere elettronpovero di un carbonio legato ad un
ossigeno dipende dalla protonazione (la carica) di questo.
Atomi grandi tengono meno
saldamente legati i loro elettroni
Figura 5.2 Alcuni nucleofili ed elettrofili. Le mappe di
potenziale elettrostatico
identificano gli atomi
nucleofili (rosso; negativo)
e gli atomi elettrofili
(blu; positivo).
Le cariche opposte si attraggono, per cui i siti elettronricchi di una molecola
reagiscono con i siti elettronopoveri di un’altra.
Si forma un legame quando un atomo elettronricco dona una coppia di
elettroni ad un atomo elettronpovero e si spezza un legame quando
entrambi gli elettroni restano ad un atomo solo.
L’acqua come nucleofilo, l’acqua come elettrofilo
Analogamente, per il metanolo:
Confronto tra i legami carbonio-carbonio singolo e doppio. Un doppio
legame è sia più accessibile ai reagenti che si avvicinano sia più
elettronricco (nucleofilo). Una mappa di potenziale elettrostatico
dell’etilene indica che il doppio legame è la zona di più alta carica negativa
(rosso).
La reazione di addizione ad un alchene
MECCANISMO: Reazione di addizione elettrofila di HBr all’etilene. La
reazione avviene in due stadi che coinvolgono entrambi interazioni
elettrofilo-nucleofilo.
Il nucleofilo può essere carico negativamente o neutro
elettrofili
La carica si conserva sempre
L’elettrofilo può essere carico positivamente o neutro
La termodinamica descrive le proprietà di un sistema all’equilibrio
ΔG°
Parametri termodinamici
=
ΔH° – TΔS°
La variazione di energia libera standard (detta di Gibbs)
L’entalpia (ΔH°): il calore ceduto o assorbito dalla reazione
L’entropia (ΔS°) una misura della libertà di movimento
La regola dell’ottetto deve sempre essere rispettata: se una coppia di
elettroni si sposta verso un atomo che ha già l’ottetto, un’altra coppia deve
spostarsi da quell’atomo (e questo può comportare rottura di legami)
Equilibri, velocità delle reazioni, variazione di energia
Il calore di reazione
(Legami formati nei prodotti, legami rotti nei reagenti)
Tabella 5.3 Alcuni valori di energia di dissociazione di legame.
Solvatazione è l’interazione tra un solvente
e una molecola (o ione) in soluzione
Perché avvenga una reazione, le molecole devono collidere e devono
riorganizzarsi atomi e legami.
Questo si può rappresentare con un diagramma di energia di reazione:
Il meccanismo dell’addizione di
HBr all’etilene
La solvatazione può cambiare il ΔH° e/o il ΔS°, e di
conseguenza il ΔG°
Lo stato di transizione
È la struttura instabile ad energia più alta coinvolta nel
meccanismo di reazione. Decade verso i prodotti, o verso i
reagenti. Non può essere isolato. È un massimo nel
diagramma di energia di reazione. Lo stato di transizione ha
dei legami parzialmente formati.
La differenza di energia tra reagenti e stato di transizione è l’energia di
attivazione (ΔG‡). Determina la velocità di una reazione ad una data
temperatura.
Il calore fornisce ai
reagenti l’energia
necessaria per
superare la barriera
dell’energia di
attivazione.
Il postulato di Hammond: lo stato di transizione sarà
più simile alle specie a cui è più prossimo
energeticamente
Una reazione esoergonica
ha uno stato di transizione
precoce, una
endoergonica uno tardivo.
Questo ci aiuta a
spiegare il ΔG‡ in
funzione della struttura e
regole di stabilità note di
reagenti o prodotti
Un composto a vita breve che si forma (e scompare) in una reazione multistadio è
un intermedio di reazione. È un minimo relativo nel diagramma di energia della
reazione.
Un intermedio ha i legami
completamente formati
Il diagramma è fatto di due stadi,
l’intermedio, prodotto del primo
stadio è reagente del secondo.
Congiungendo i due diagrammi dei
due stadi ottengo il diagramma
complessivo per la reazione.
Per dati reagenti e prodotti (una reazione) il ΔG° è definito, ma il cammino di
reazione (numero di stadi, intermedi, stati di transizione, energie di attivazione)
dipendono dalla modalità in cui la reazione è svolta. Ad esempio, in presenza di
un catalizzatore, la reazione avviene con un meccanismo diverso e si abbassano
le energie di attivazione, accelerando la reazione.
La cinetica chimica ha a che fare con la velocità delle reazioni e
con i fattori che la deterinano
Velocità di reazione =
Numero di collisioni
per unità di tempo
Frazione ad
Frazione ad
x energia sufficiente x orientazione
opportuna
Lo stadio più lento determina la velocità globale della
reazione (il rate-limiting step)
Gli alcheni
Idrocarburi contenenti doppi legami C-C
C
C
Il doppio legame:
Gruppo funzionale
Centro di reattività
Hanno grande importanza industriale
Formula Moleculare di un Alchene
Alchene aciclico:
CnH2n
Alchene ciclico:
CnH2n–2
Nomenclatura sistematica degli alcheni
• Cercare la catena continua più lunga che contenga il gruppo funzionale
CH3CH2=CH2
• Cita i sostituenti in ordine alfabetico
• Attribuisci il nome con il numero più basso possibile per un
sostituente e poi con i numeri più bassi possibili per gli altri
• Non serve numerazione del gruppo funzionale (il doppio legame
C-C) in un alchene ciclico
Nomenclatura speciale
La struttura degli alcheni
Carboni vinilici
Gli orbitali p si sovrappongono per fare un legame π
Carboni allilici
I 6 atomi di carbonio
giacciono nello stesso piano
Gli isomeri degli alcheni
I momenti di dipolo degli isomeri degli alcheni
La conversione tra isomeri per gli alcheni richiede la
rottura del legame π tra i due carboni sp2
La conversione cis-trans per la visione
La nomenclatura nel sistema E,Z
Regola 1: Considera il numero atomico degli atomi
legato direttamente al carbonio sp2 in questione.
Isomeri E e Z
Si dà alta priorità all’atomo con numero atomico più alto
Regola 2: Se c’è un ‘pareggio,’ considera gli atomi
attaccati agli atomi ad uguale numero atomico.
Regola 4: Elenca le priorità a seconda del numero di
massa degli isotopi degli atomi.
Regola 3: Nel caso un atomo abbia legami multipli,
nel calcolo della priorità consideralo come se fosse
legato con multipli legami singoli.
Un alchene è una molecola ricca di elettroni, un
nucleofilo, cioè un atomo o molecola ricca di
elettroni che li può condividere con un elettrofilo.
I nucleofili sono attratti da atomi o molecole elettrondeficienti, gli elettrofili.
Addizione elettrofila di HBr ad un alchene
Il risultato complessivo di un’addizione
elettrofila ad un alchene
due stadi
La velocità di reazione è controllata
dallo stadio più lento, quello di
formazione dell’intermedio, che poi
reagisce velocemente per dare i
prodotti
Esempi
Quale è il prodotto per un alchene non simmetricamente sostituito?
Lo stadio di formazione del carbocatione è quello più lento
Il carbocatione
più stabile
Stabilità dei carbocationi
stabilità crescente
La velocità di reazione e ΔG‡
Più stabile è lo stato di transizione
più bassa è ΔG‡
più veloce è la reazione
I gruppi alchilici diminuiscono la concentrazione di
carica positiva sul carbonio positivo
La stabilità aumenta con il grado di sostituzione per
effetti induttivi e di iperconiugazione
Storicamente si spiegava con:
La regola di Markovnikov
L’elettrofilo si aggiunge al carbonio sp2 che è legato al
maggior numero di idrogeni
E’ una reazione regioselettiva: si forma solo
(o prefenzialmente) un isomero costituzionale
Per il postulato di Hammond, nella formazione endoergonica del carbocatione, stadio
lento, lo stato di transizione assomiglierà al carbocatione, per cui a carbocationi più
stabili corrisponderanno stati di transizione più stabili e, conseguentemente, reazioni più
veloci.
Il catione tert-butilico è più stabile e si forma più velocemente.
Addizione di acqua ad un alchene
Addizione di un alcol in catalisi acida
Analoga alla precedente
Trasposizione di Carbocatione
Spostamento 1,2 di idruro
Un carbocatione
più stabile
Trasposizione di Carbocatione
Spostamento 1,2 di metile
Un carbocatione
più stabile
:H– o :CH3– si spostano con la loro coppia di elettroni di legame per dare il
carbocatione più stabile
Trasposizione di Carbocatione
Addizione di alogeni ad un alchene
A volte il risultato dello spostamento 1,2 di
alchile è curioso: una espansione di anello
Un carbocatione
più stabile
L’addizione di alogeno è stereoselettiva
Addizione di alogeni in presenza di acqua
Il meccanismo di formazione di una aloidrina
Consideriamo lo stato di
transizione per
prevedere la
regioselettività della
reazione
Anche questa reazione è stereoselettiva (OH entra sulla faccia opposta rispetto a Br)
Addizione di borano
Idroborazione e ossidazione
addizione anti-Markovnikov
Formazione di prodotti anti-Markovnikov
addizione Markovnikov
Sostituzione del boro con OH
Formazione di alchilborani
Addizione anti-Markovnikov di OH
Sintesi del bromobutano: per via cationica o per
via radicalica
La generazione del
radicale Br•
Addizione di radicale ad un alchene
Br• più stabile è il
propagatore della
catena
Stabilità relative dei radicali alchilici
stabilità crescente
Calcolo del ΔH°
Idrogenazione catalitica di un alchene
Addizione di idrogeno agli alcheni
(riduzione)
Gli isomeri di un alchene hanno diversa stabilità
L’idrogenazione è anche un metodo sperimentale per determinare la
stabilità di un composto
I due idrogeni entrano dallo stesso lato del doppio legame C-C
stabilità crescente
La tensione sterica negli alcheni
Ossidazione di un alchene a glicole (diolo vicinale)
La reazione è stereoselettiva
Gli alcheni sono reagenti versatili
per la sintesi di una grande
varietà di prodotti