ISTITUTO TECNICO INDUSTRIALE STATALE
Guglielmo Marconi
Verona
Programma (piano di lavoro) svolto
Anno Scolastico 2014/2015
Materia
SCIENZE INTEGRATE: Chimica e Laboratorio
Classe
1AC
Docenti
Maria I. Viviani – Nicolis L.
Nome documento
CHI1ACs.doc
UDA 1: Nozioni propedeutiche e avvio all'attività di laboratorio
2
Prerequisiti .......................................................................................................... 2
Unità didattica 1: La chimica ed il metodo scientifico .................................................. 2
Unità didattica 2: Le grandezze e la loro misura ........................................................ 2
Verifiche: modalità e descrizione ............................................................................. 3
UDA 2: La struttura della materia
3
Unità didattica 1: Gli stati di aggregazione ed i passaggi di stato ................................ 3
Unità didattica 2: I miscugli e le sostanze pure………………………………………………………………….4
Verifiche: modalità e descrizione ............................................................................. 3
UDA 3: La struttura dell'atomo
4
Unità didattica 1: Le Leggi ponderali ........................................................................ 4
Unità didattica 2: La struttura atomica e le proprietà periodiche .................................. 5
Verifiche: modalità e descrizione ............................................................................. 5
UDA 4: I legami chimici
5
Unità didattica 1: I legami chimici intramolecolari ..................................................... 5
Unità didattica 2: I legami chimici intermolecolari ...................................................... 6
Verifiche: modalità e descrizione ............................................................................. 6
Firma docente/i
Firma Responsabile Utenza
Firma Dirigente
Page 1 of 6
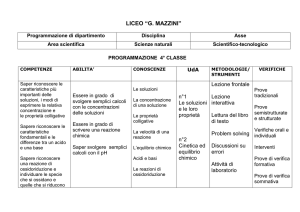
Programmazione didattica
SCIENZE INTEGRATE: Chimica e Laboratorio Classe 1ACa
UDA 1: Nozioni propedeutiche e avvio all’attività di
laboratorio
Prerequisiti
Proporzioni, formule dirette e inverse, potenze e loro proprietà, notazione scientifica,
costruzione grafici e relazione tra le due variabili.
Unità didattica 1: La chimica ed il metodo scientifico
Ore
10
Periodo
Settembre - ottobre
Obiettivi specifici
Condivisione del percorso didattico, della metodologia
e dei criteri di valutazione.
Saper risolvere semplici esercizi relativi a proporzioni,
formule inverse, notazione scientifica ed equivalenze.
Definire la chimica.
Conoscere le fasi del metodo sperimentale.
Conoscere le basilari norme antinfortunistiche, i
simboli di pericolosità delle sostanze chimiche e
l’attrezzatura di laboratorio.
Saper lavorare in laboratorio in sicurezza utilizzando
gli idonei dispositivi di protezione.
Argomenti
Teoria :
Elementi base di matematica
Cos’ è la chimica
Le fasi del metodo scientifico
Laboratorio:
Presentazione e regolamento del laboratorio,
norme di comportamento per la sicurezza e la
prevenzione di incidenti e uso dispositivi di
protezione individuale e collettiva.
Simboli di pericolo sostanze chimiche; lettura
etichetta e scheda di sicurezza.
Norme di primo intervento in caso di incidenti.
Unità didattica 2: Le grandezze e la loro misura
Ore
10
Periodo
Settembre - Ottobre
Obiettivi specifici
Conoscere le grandezze del S.I. e le principali
grandezze derivate.
Saper eseguire conversioni tra diverse scale di
misura.
Saper usare correttamente strumenti di misura di
volume e di massa indicandone le caratteristiche
strumentali.
Saper registrare ed elaborare i dati relativi alle
esperienze.
Saper costruire un semplice grafico e individuare la
relazione tra le due variabili.
Saper determinare la densità di corpi solidi.
Argomenti
Teoria:
Grandezze del sistema internazionale e
principali grandezze derivate (densità e calore)
Conversioni da multipli e sottomultipli
Conversioni da Celsius e Kelvin e viceversa
Grandezze intensive ed estensive
Laboratorio:
Vetreria comune, tarata e graduata ed altre
attrezzature
comunemente
utilizzate
in
laboratorio.
Bilance elettroniche (tecnica ed analitica).
Misure di volume e di massa con gli idonei
Page 2 of 6
Programmazione didattica
SCIENZE INTEGRATE: Chimica e Laboratorio Classe 1ACa
strumenti.
Determinazione della densità di corpi solidi (di
forma irregolare).
Verifiche: modalità e descrizione
Prove strutturate e/o semistrutturate. Eventuali verifiche orali.
UDA 2: La struttura della materia
Unità didattica 1: Gli stati di aggregazione ed i passaggi di stato
Ore
10
Periodo
Novembre - dicembre
Obiettivi specifici
Conoscere gli stati fisici della materia e i passaggi di
stato (andamento della curva di riscaldamento e
raffreddamento di una sostanza pura).
Interpretare i passaggi di stato alla luce della teoria
cinetica.
Verificare l'invarianza dei punti fissi alle soste
termiche ed i cambiamenti delle proprietà del
sistema al variare della temperatura.
Costruire sperimentalmente ed analizzare il grafico
tempo-temperatura relativamente al riscaldamento e
al raffreddamento di una sostanza pura.
Argomenti
Teoria:
Gli stati fisici della materia: modello particellare
I passaggi di stato (calore latente)
Laboratorio:
Comportamento di una sostanza pura al
riscaldamento
ed
al
raffreddamento:
costruzione dei grafici tempo/temperatura.
Unità didattica 2: I miscugli e le sostanze pure
Ore
16
Periodo
Ottobre - novembre
Obiettivi specifici
Conoscere la suddivisione della materia: sostanze
pure e miscele.
Comprendere che una miscela è costituita da più
sostanze.
Distinguere i sistemi omogenei da quelli eterogenei
sulla base del concetto di fase.
Riconoscere le differenze tra miscela e composto;
distinguere gli elementi dai composti; i simboli dalle
formule; gli atomi dalle molecole.
Conoscere e saper usare le principali tecniche di
separazione di miscele.
Conoscere la differenza tra trasformazioni fisiche e
Argomenti
Teoria:
La suddivisione della materia
Concetto di fase
Sistemi omogenei ed eterogenei
Trasformazioni fisiche e chimiche
Principali tecniche di separazione di miscele
Laboratorio:
Tecniche di separazione dei componenti di
miscele ( sedimentazione e decantazione, vari
tipi di filtrazione, centrifugazione, evaporazione,
Page 3 of 6
Programmazione didattica
SCIENZE INTEGRATE: Chimica e Laboratorio Classe 1ACa
chimiche e saperle distinguere.
distillazione
semplice
e
frazionata,
cromatografia su carta , estrazione con
solvente, cristallizzazione, sublimazione e
brinamento).
Verifiche: modalità e descrizione
Prove strutturate e/o semistrutturate. Eventuali verifiche orali.
UDA 3: La struttura dell’atomo
Unità didattica 1: Le leggi ponderali
Ore
4
Periodo
gennaio
Obiettivi specifici
Argomenti
Conoscere, verificare sperimentalmente ed applicare Teoria:
la legge di Lavoisier
La legge di conservazione della massa
Conoscere e saper applicare la legge di Proust
Lavoisier, la legge di Proust e la teoria atomica
di Dalton.
Teoria atomica di Dalton
Laboratorio:
Verifica sperimentale della legge di Lavoisier
(legge della conservazione della massa).
Unità didattica 2: La struttura atomica e le proprietà periodiche
Ore
18
Periodo
Gennaio - marzo
Obiettivi specifici
Conoscere le particelle subatomiche, la loro massa e
carica relativa, il numero atomico Z e di massa A.
Conoscere il concetto di isotopo e di ione.
Saper risolvere semplici esercizi su Z, A, isotopi e ioni.
Conoscere , a grandi linee, il modello atomico
moderno.
Scrivere la configurazione elettronica totale e
semplificata dei primi 20 elementi della Tavola
Periodica.
Conoscere e saper scrivere i simboli (formule) di
Lewis.
Conoscere la struttura della Tavola Periodica.
Argomenti
Teoria:
Descrizione di elettrone, protone, neutrone.
Definizione di numero atomico, numero di
massa, isotopo e ione.
Distribuzione delle particelle nell’atomo.
Distribuzione degli elettroni nei livelli energetici.
Configurazione elettronica dei primi 20 elementi
e Tavola Periodica.
Struttura della tavola periodica e proprietà
periodiche (energia di ionizzazione ed
elettronegatività).
Page 4 of 6
Programmazione didattica
SCIENZE INTEGRATE: Chimica e Laboratorio Classe 1ACa
Saper identificare nella Tavola Periodica l’elemento in
base a Z e riconoscerne il periodo ed il gruppo di
appartenenza.
Conoscere energia di ionizzazione, elettronegatività
ed il loro andamento nei periodi e gruppi.
Riconoscere alcuni elementi chimici dalla radiazione
emessa alla fiamma.
Laboratorio:
Analisi chimica qualitativa: saggio alla fiamma.
Identificazione di alcuni elementi chimici
mediante saggio alla fiamma.
Verifiche: modalità e descrizione
Prove strutturate e/o semistrutturate. Eventuali verifiche orali.
UDA 4: I legami chimici
Unità didattica 1: I legami chimici intramolecolari – geometria e polarità
Ore
12
Periodo
Aprile - maggio
Obiettivi specifici
Conoscere le caratteristiche dei vari tipi di legame che
uniscono gli atomi.
Saper collegare la differenza di elettronegatività degli
atomi al tipo di legame che li unisce.
Saper scrivere la formula di struttura di semplici
molecole.
Conoscere la teoria VSEPR per arrivare a conoscere
la geometria delle molecole.
Saper stabilire la geometria di semplici molecole a
partire dalle formule di Lewis , secondo il metodo
VSEPR e definirne la polarità.
Osservare e descrivere il comportamento di alcune
sostanze in presenza di un campo elettrico.
Argomenti
Teoria:
I legami intramolecolari: legame ionico,
covalente (puro, polare e dativo), metallico.
La teoria VSEPR
Geometria di semplici molecole
Polarità determinata attraverso il tipo di legame
intramolecolare e la geometria molecolare
Laboratorio:
Prove di polarità di alcune sostanze con
costruzione, mediante modelli molecolari, delle
loro formule di struttura.
Unità didattica 2: I legami chimici intermolecolari
Ore
10
Periodo
Maggio - giugno
Obiettivi specifici
Conoscere e distinguere i vari legami che intercorrono
tra molecole.
Comprendere il modo con cui il tipo di legami presenti
e le interazioni tra le particelle determinano i vari stati
fisici.
Saper collegare la polarità delle molecole al loro
Argomenti
Teoria:
Legami intermolecolari: forze dipolo-dipolo,
forze di Van der Waals e legami a idrogeno.
Collegamento tra legami intermolecolari e stati
fisici delle sostanze.
Page 5 of 6
Programmazione didattica
SCIENZE INTEGRATE: Chimica e Laboratorio Classe 1ACa
comportamento in presenza di un campo elettrico ed
a prove di miscibilità e solubilità.
Saper classificare gli elettroliti in base alla capacità di
condurre la corrente elettrica in soluzione.
Laboratorio:
Prove di miscibilità reciproca di due liquidi e
prove di solubilità di solidi in liquidi.
Prove di conducibilità elettrica: elettroliti forti,
elettroliti deboli, non elettroliti.
Verifiche: modalità e descrizione
Prove strutturate e/o semistrutturate. Eventuali verifiche orali.
Metodologie
Lezione frontale
Risoluzione di esercizi alla LIM e in gruppi
Esperienze pratiche di laboratorio sia dimostrative a cattedra che di lavoro in gruppo
Compilazione schede di raccolta e rielaborazione dati con discussione dei risultati
Proiezione di filmati
Verifiche: tipologia e numero prove
Verifiche basate su : domande aperte, test a risposta multipla, quesiti vero/falso, a
completamento, corrispondenze, risoluzione di problemi ,interrogazioni orali
Minimo 2 verifiche nel trimestre e 3 nel pentamestre.
Page 6 of 6