ALLEGATO I
CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE
CARATTERISTICHE DEL PRODOTTO PRESENTATO DALL’EMEA
CONCLUSIONI SCIENTIFICHE
RIASSUNTO GENERALE DELLA VALUTAZIONE SCIENTIFICA di Floxyfral e denominazioni
associate
Problemi di qualità
Non è stato riscontrato alcun problema rilevante che riguardasse la qualità.
Le informazioni farmaceutiche del riassunto delle caratteristiche del prodotto sono state armonizzate,
ad eccezione delle sezioni che devono essere introdotte a livello nazionale dagli Stati membri quando
si applicano i riassunti delle caratteristiche del prodotto armonizzati (sezioni 6.1, 6.3, 6.4 e 6.5).
Problemi di efficacia
La fluvoxamina è un inibitore selettivo della ricaptazione della serotonina (SSRI). Questo composto è
indicato per la depressione grave e/o il disturbo ossessivo compulsivo (DOC). In tutti gli Stati membri
dell’UE (tranne due) è stata concessa l’indicazione per l’uso della fluvoxamina nel DOC negli adulti.
In tre Stati membri dell’UE questo composto è autorizzato nell’indicazione del DOC nei bambini e in
altri Stati membri è consigliato per l’impiego in pediatria nella sezione Posologia (4.2).
Il fascicolo presentato dimostra che la fluvoxamina è stata testata nella popolazione di pazienti che
hanno manifestato un episodio depressivo grave. In questa popolazione l’efficacia a breve termine è
stata dimostrata nell’intervallo posologico di 100-300 mg/die in uno studio di svezzamento controllato
con placebo con una dose di 100 mg. Si è dimostrato che nel breve termine l’effetto persiste. Gli
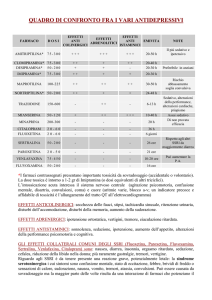
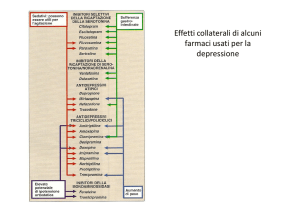
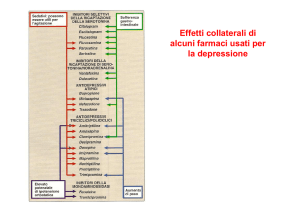
eventi avversi provocati dalla fluvoxamina sono i ben noti eventi avversi degli SSRI (cefalea, nausea,
insonnia, sonnolenza, xerostomia ed altri sintomi).
La fluvoxamina è stata testata correttamente nel trattamento a breve termine nella popolazione di
pazienti adulti affetti da DOC. In questa popolazione si è dimostrata l’efficacia a breve termine con un
effetto di modesta entità nell’intervallo posologico di 100-300 mg, mentre l’efficacia della
fluvoxamina non è stata dimostrata sul lungo termine. Gli eventi avversi della fluvoxamina sono i ben
noti eventi avversi degli SSRI (cefalea, nausea, insonnia, sonnolenza, xerostomia ed altri sintomi).
Pertanto, il fascicolo inviato dal titolare dell’autorizzazione all’immissione in commercio (AIC)
conferma l’impiego della fluvoxamina in adulti con DOC. Il comitato per le specialità medicinali
(CPMP) raccomanda, quindi, che questa indicazione sia autorizzata in tutti gli Stati membri dell’UE.
In una sperimentazione controllata con placebo della durata di 10 settimane condotta su 120 pazienti
con DOC di età compresa fra 8 e 17 anni è stato osservato un miglioramento statisticamente
significativo nella popolazione totale a favore della fluvoxamina a 10 settimane, anche se la rilevanza
clinica di questo risultato è modesta. Un’altra analisi di sottogruppi ha mostrato un miglioramento
sulla scala di classificazione clinica (C-YBOCS) nei bambini, mentre non è stato osservato alcun
effetto nell’adolescente. La dose media era rispettivamente di 158 mg e di 168 mg/die. La dose
iniziale è di 25 mg al giorno che deve essere aumentata ogni 3-4 giorni con incrementi di 25 mg fino a
quando si ottiene una dose efficace. La dose massima nei bambini non deve superare i 200 mg/die.
Tenendo conto dell’efficacia dimostrata nella sottopopolazione pediatrica, della pratica medica attuale
e dell’uso attuale della fluvoxamina sia nei bambini sia negli adolescenti, vi è ragione di includere le
informazioni posologiche nei bambini e negli adolescenti per questa indicazione nella sezione
Posologia del riassunto delle caratteristiche del prodotto e i dati relativi ai risultati di uno studio clinico
in questa popolazione devono essere menzionati nella sezione 5.1 del riassunto delle caratteristiche del
prodotto.
Le proprietà farmacocinetiche della fluvoxamina sono ben descritte nel riassunto delle caratteristiche
del prodotto. Alcuni dati menzionati sono tratti da fonti bibliografiche. Piccole modifiche sono state
apportate al riassunto delle caratteristiche del prodotto in relazione al CYP 2D6 e alla farmacocinetica
nei bambini.
Problemi di sicurezza
La maggior parte degli eventi avversi osservati con la fluvoxamina è comune alla classe degli SSRI e
spesso non è di natura grave. Gli eventi avversi più gravi, anche se non segnalati di frequente, devono
essere tenuti sotto attento monitoraggio, come per esempio i seguenti: ipertensione, sincope, dispnea,
flatulenza, vertigini, modesto aumento della creatinina, diminuzione della conta piastrinica. È stata
osservata la sindrome neurolettica maligna che, quindi, deve essere inclusa nella sezione 4.4 “Speciali
avvertenze e precauzioni per l’uso” del riassunto delle caratteristiche del prodotto armonizzato. Nella
sperimentazione di 10 settimane controllata con placebo condotta su bambini e adolescenti con DOC,
gli eventi avversi osservati con maggior frequenza rispetto a quanto riscontrato con il placebo sono
stati: insonnia, astenia, agitazione, ipercinesia, sonnolenza e dispepsia. Gli eventi avversi gravi
riscontrati in questa sperimentazione comprendevano: agitazione e ipomania. Durante l’impiego al di
fuori delle sperimentazioni cliniche sono state segnalate delle convulsioni nei bambini e negli
adolescenti. Poiché mancano dati controllati relativi al trattamento a lungo termine del DOC in
bambini e adolescenti, il CPMP ritiene necessario un ulteriore studio accurato su questi problemi
(specialmente in relazione alla crescita, alla funzione sessuale, allo sviluppo educativo/cognitivo e agli
effetti sul comportamento).
Non sembra che la fluvoxamina aumenti il rischio teratogeno quando viene impiegata alle dosi
raccomandate. La fluvoxamina viene escreta nel latte umano e, quindi, non deve essere usata da donne
che allattano.
Considerazioni di carattere amministrativo
Le altre sezioni del riassunto delle caratteristiche del prodotto che non erano armonizzate e che devono
essere introdotte a livello nazionale dagli Stati membri, quando applicano il riassunto delle
caratteristiche del prodotto armonizzato, sono le seguenti: titolare dell’AIC, numero di AIC, data della
prima autorizzazione/rinnovo dell’autorizzazione, data di revisione del testo.
Considerazioni sul rapporto benefici/rischi
In base alla documentazione fornita dal titolare dell’AIC e a seguito della discussione scientifica
all’interno della ditta, il Comitato per le specialità medicinali ha ritenuto che il rapporto benefici/rischi
della fluvoxamina sia favorevole in caso di: 1) episodio depressivo grave, 2) disturbo ossessivo
compulsivo (DOC), purché siano soddisfatte le condizioni indicate nell’Allegato IV.
MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
Considerato che,
lo scopo del deferimento era di armonizzare il riassunto delle caratteristiche del prodotto, il riassunto
delle caratteristiche del prodotto proposto dai titolari dell’autorizzazione all’immissione in commercio
è stato valutato in base alla documentazione presentata e alla discussione scientifica in seno al
comitato,
il CPMP ha raccomandato di modificare le autorizzazioni all’immissione in commercio per le quali il
riassunto delle caratteristiche del prodotto è riportato nell’allegato III e alle condizioni indicate
nell’allegato IV. Le grosse divergenze riscontrate all’inizio del deferimento sono state risolte,
segnatamente è stata approvata l’indicazione “Disturbo Ossessivo Compulsivo”(DOC) per gli adulti e
il problema del trattamento del DOC nella popolazione pediatrica è stato risolto con l’aggiunta delle
informazioni nella sezione riguardante la Posologia.
ALLEGATO II
ELENCO DEI NOMI DEL MEDICINALE, DELLE FORME FARMACEUTICHE, DEI
DOSAGGI, DELLA VIA DI SOMMINISTRAZIONE, DEI TITOLARI DELLE
AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO, DEI CONTENITORI E DEI
CONTENUTI DELLE CONFEZIONI NEGLI STATI MEMBRI
ALLEGATO II
Stato membro
Titolari dell’autorizzazione Nomi di
all’immissione in commercio fantasia:
Dosaggio
Forma
farmaceutica
Austria
SOLVAY PHARMA
Ges.m.b.H.
Donaustraße 106
A-3400 Klosterneuburg
AUSTRIA
FLOXYFRAL
50 mg
100 mg
Compresse film- Uso orale
rivestite rompibili
SOLVAY PHARMA & Cie.,
S.N.C.-V.O.F
Bd. Em. Bockstaellaan 122
1020 BRUXELLES
BELGIO
FLOXYFRAL
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister (PVC/PVDC)
20, 30 e 60
Confezione da
100 (DU) per
ospedali
SOLVAY PHARMA & Cie.,
S.N.C.-V.O.F
Bd. Em. Bockstaellaan 122
1020 BRUXELLES
BELGIO
DUMIROX
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister (PVC/PVDC)
30 e 60
Confezione da
100 (DU) per
ospedali
SOLVAY PHARMA & Cie.,
S.N.C.-V.O.F
Bd. Em. Bockstaellaan 122
1020 BRUXELLES
BELGIO
MALEATE DE 100 mg
FLUVOXAMIN
E 100 mg
SOLVAY
PHARMA
Compresse film- Uso orale
rivestite rompibili
Blister (PVC/PVDC)
30 e 60
Confezione da
100 (DU) per
ospedali
Solvay Pharmaceuticals B.V.
C.J. van Houtenlaan 36
1381 CP Weesp
Paesi Bassi
FEVARIN
Compresse
Blister (PVC/PVDC)
30, 60 e 90
Belgio
Danimarca
Via di
somministraz.
Contenitore
Contenuto
Blister (PVC/PVDC)
50 mg - 5, 30 e 60
100 mg – 15 e 30
50 mg
100 mg
Uso orale
Finlandia
Francia
Germania
Grecia
Irlanda
Solvay Pharmaceuticals B.V.
C.J. van Houtenlaan 36
1381 CP Weesp
Paesi Bassi
SOLVAY PHARMA
Ges.m.b.H.
42, rue Rouget de Lisle
BP 22
92151 SURESNES
FRANCIA
FEVARIN
50 mg
100 mg
Compresse filmrivestite
Uso orale
FLOXYFRAL
50 mg
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister
20, 30 e 50
(PVC/PVDC/Alluminio) Confezione da
100 per ospedali
Solvay Arzneimittel GmbH
Hans-Boeckler-Allee 20
30173 Hannover
Germania
FEVARIN
50 mg
100 mg
Compresse filmrivestite
Uso orale
Blister (PVC/PVDC)
20, 50 e 100
Confezione da
250 (5x50) per
ospedali
Solvay Arzneimittel GmbH
Hans-Boeckler-Allee 20
30173 Hannover
Germania
FEVARIN
TABS
50 mg
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister (PVC/PVDC)
20, 50 e 100
Confezione da
250 (5x50) per
ospedali
Solvay Pharma M.E.P.E.
Ag. Dimitriou 63, 17456
Alimos
Grecia
DUMYROX
50 mg
100 mg
Blister (PVC/PVDC)
30
Famar A.B.E.
P. Marinopoulou 7, 17456
Alimos,
Grecia
LUVOX
50 mg
100 mg
Compresse film- Uso orale
rivestite
e compresse
resistenti ai succhi
gastrici
Uso orale
Compresse
resistenti ai succhi
gastrici
Blister (PVC/PVDC)
30
Solvay Healthcare Limited
Mansbridge Road, West End
Southampton, SO18 3JD
UK
50 mg
FAVERIN
TABLETS 50 100 mg
mg
e
FAVERIN
TABLETS 100
mg
Compresse
rivestite
Strip blister
50mg - 60
100 mg - 30
Uso orale
Blister (PVC/PVDC)
30, 60 e 90
Solvay Pharmaceuticals B.V.
C.J. van Houtenlaan 36
1381 CP Weesp
Paesi Bassi
FEVARIN
50 mg
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister
15 e 30
(PVC/PVDC/Alluminio
opaco)
Solvay Pharma SpA
Via della Libertà 30
10095 Grugliasco (TO)
Italia
Farmades SpA
Via di Tor Cervara 282
00155 Roma
Italia
DUMIROX
50 mg
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister
30
(PVC/PVDC/Alluminio
opaco)
MAVERAL
50 mg
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister
30
(PVC/PVDC/Alluminio
opaco)
SOLVAY PHARMA & Cie.,
S.N.C.-V.O.F
Bd. Em. Bockstaellaan 122
1020 BRUXELLES
BELGIO
SOLVAY PHARMA & Cie.,
S.N.C.-V.O.F
Bd. Em. Bockstaellaan 122
1020 BRUXELLES
BELGIO
FLOXYFRAL
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister (PVC/PVDC)
20, 30 e 60
Confezione da
100 (DU) per
ospedali
DUMIROX
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister (PVC/PVDC)
30 e 60
Confezione da
100 (DU) per
ospedali
Paesi Bassi
Solvay Pharmaceuticals B.V.
C.J. van Houtenlaan 36
1381 CP Weesp
Paesi Bassi
FEVARIN
50 mg
100 mg
Compresse filmrivestite
Uso orale
Blister (PVC/PVDC)
50 mg – 30, 50 e
60
100 mg – 30 e 50
Norvegia
Solvay Pharmaceuticals B.V.
C.J. van Houtenlaan 36
1381 CP Weesp
Paesi Bassi
FEVARIN
50 mg
100 mg
Compresse filmrivestite
Uso orale
Blister (PVC/PVDC)
30 e 90
Italia
Lussemburgo
Portogallo
DUMYROX
SOLVAYFARMA, LDA.
Av. Marechal Gomes da Costa,
33 - 1800
255 Lisboa
Portogallo
Spagna
Svezia
Regno Unito
50 mg
100 mg
Compresse film- Uso orale
rivestite rompibili
Blister
50 mg – 20 e 60
(PVC/PVDC/Alluminio) 100 mg - 30
SOLVAY PHARMA S.A.
Av. Diagonal 507
08029 BARCELLONA
Spagna
DUMIROX 50 50 mg
e
100 mg
DUMIROX 100
Compresse film- Uso orale
rivestite rompibili
Blister (PVC/PVDC)
30
Solvay Pharmaceuticals B.V.
C.J. van Houtenlaan 36
1381 CP Weesp
Paesi Bassi
Solvay Healthcare Limited
Mansbridge Road, West End,
Southampton, SO18 3JD
UK
FEVARIN
Compresse filmrivestite
Uso orale
Blister (PVC/PVDC)
30, 60 e 90
Compresse
rivestite
Uso orale
Strip blister
50 mg – 60
100 mg - 30
50 mg
100 mg
50 mg
FAVERIN
TABLETS 50 100 mg
mg
e
FAVERIN
TABLETS 100
mg
ALLEGATO III
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
1.
DENOMINAZIONE DEL MEDICINALE
Floxyfral e nomi associati (Vedere Allegato II)
2.
COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Principio attivo: fluvoxamina maleato.
Una compressa contiene 50 mg o 100 mg di fluvoxamina maleato.
Per gli eccipienti vedere 6.1.
3.
FORMA FARMACEUTICA
(Vedere Allegato II)
4.
4.1
INFORMAZIONI CLINICHE
Indicazioni terapeutiche
Episodio depressivo maggiore.
Disturbo ossessivo compulsivo (DOC).
4.2
Posologia e modo di somministrazione
Depressione
Si raccomanda un dosaggio iniziale di 50 o 100 mg in un’unica somministrazione serale. Si
raccomanda di aumentare la dose gradualmente fino al raggiungimento della dose terapeutica.
La dose terapeutica giornaliera è generalmente di 100 mg e deve essere aggiustata sulla base della
risposta individuale. Sono stati somministrati dosaggi fino a 300 mg al giorno. Dosaggi superiori a 150
mg devono essere suddivisi in più somministrazioni.
In accordo con la dichiarazione di consenso della Organizzazione Mondiale della Sanità, il trattamento
antidepressivo deve essere continuato per almeno 6 mesi dopo la risoluzione di un episodio
depressivo. Un dosaggio di 100 mg al giorno può essere sufficiente per questo utilizzo.
DISTURBO OSSESSIVO COMPULSIVO
Si raccomanda un dosaggio iniziale di 50 mg al giorno per 3-4 giorni. La dose terapeutica è
generalmente compresa tra i 100 e i 300 mg al giorno.
Il dosaggio deve essere gradualmente incrementato fino al raggiungimento della dose terapeutica, fino
ad un massimo di 300 mg al giorno negli adulti.
Dosi fino a 150 mg possono essere assunte in un’unica somministrazione, preferibilmente alla sera. Si
consiglia di suddividere una dose totale giornaliera superiore a 150 mg in 2 o 3 somministrazioni.
Se si ottiene una buona risposta terapeutica, il trattamento può continuare ad una dose aggiustata su
base individuale.
Se non viene rilevato alcun miglioramento entro 10 settimane, il trattamento con fluvoxamina deve
essere riconsiderato.
Anche se non sussistono studi sistematici che possano stabilire la durata del trattamento con
fluvoxamina, in considerazione del carattere cronico del disturbo ossessivo compulsivo, è
consigliabile proseguire il trattamento oltre le 10 settimane nei pazienti che hanno risposto. In tali casi
il dosaggio va accuratamente modulato per consentire al paziente di ricevere la dose minima efficace.
La necessità di continuare il trattamento deve essere rivalutata periodicamente.
Nei pazienti che rispondono al trattamento con fluvoxamina alcuni clinici considerano di aiuto la
terapia comportamentale.
Nei bambini sopra gli 8 anni e negli adolescenti sono disponibili dati limitati ad un dosaggio fino a
100 mg due volte al giorno per 10 settimane. La dose iniziale è di 25 mg al giorno. Aumentare il
dosaggio di 25 mg ogni 3-4 giorni finchè si raggiunge un dosaggio efficace. La dose massima nei
bambini non dovrebbe superare i 200 mg/die. (Per ulteriori dettagli vedere 5.1)
I pazienti affetti da insufficienza epatica o renale devono iniziare con una dose bassa ed essere
attentamente monitorati.
Le compresse di fluvoxamina devono essere inghiottite con acqua e non masticate.
4.3
Controindicazioni
Marchio registrato® compresse non deve essere somministrato in associazione con inibitori della
monoaminossidasi (IMAO).
Il trattamento con fluvoxamina può essere iniziato:
- due settimane dopo la sospensione di un IMAO irreversibile o
- il giorno successivo alla sospensione di un IMAO reversibile (ad es. la moclobemide).
Tra la sospensione di fluvoxamina e l’inizio della terapia con qualsiasi IMAO deve intercorrere
almeno una settimana.
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti.
4.4
Avvertenze speciali e opportune precauzioni d'impiego
Il rischio di un tentativo di suicidio è possibile nei pazienti affetti da episodi depressivi e può
persistere fino al raggiungimento di una significativa remissione della malattia. I pazienti devono
essere attentamente monitorati.
I pazienti affetti da insufficienza epatica o renale devono iniziare con una dose bassa ed essere
attentamente monitorati.
Il trattamento con fluvoxamina è stato raramente associato ad un aumento degli enzimi epatici,
generalmente accompagnato da sintomi clinici. In tali casi il trattamento deve essere interrotto.
Il controllo glicemico può essere modificato, in particolare nelle prime fasi del trattamento. Può
risultare necessario un aggiustamento del dosaggio dei farmaci antidiabetici.
Sebbene la fluvoxamina non abbia dimostrato in studi su animali di possedere proprietà proconvulsive,
è raccomandabile usare cautela nel trattamento di pazienti con storia di convulsioni. Si deve evitare la
somministrazione della fluvoxamina nei pazienti con epilessia instabile e i pazienti con epilessia
controllata devono essere attentamente monitorati. In caso di insorgenza di convulsioni o se aumenta
la frequenza delle convulsioni, il trattamento con fluvoxamina va interrotto.
Raramente è stata segnalata l’insorgenza di una sindrome serotoninergica o di eventi tipo sindrome
neurolettica maligna associati al trattamento con fluvoxamina, specialmente quando la fluvoxamina è
data in combinazione con altri farmaci serotoninergici e/o neurolettici. Poiché queste sindromi
possono portare ad un potenziale rischio per la vita, alla comparsa di tali eventi (caratterizzati da una
serie di sintomi quali ipertermia, rigidità, mioclono, instabilità autonomica con possibili rapide
fluttuazioni dei segni vitali, cambiamenti dello stato mentale tra cui confusione, irritabilità, agitazione
estrema con progressione fino a delirio e coma) il trattamento con fluvoxamina deve essere interrotto
ed iniziato un trattamento sintomatico di supporto.
Come con altri SSRI, sono stati raramente segnalati casi di iponatremia che è risultata revesibile dopo
la sospensione della fluvoxamina. Alcuni casi possono essere stati causati dalla sindrome da
inappropriata secrezione dell’ormone antidiuretico. La maggior parte delle segnalazioni proviene da
pazienti anziani.
Sono stati segnalati casi di emorragie cutanee, come ecchimosi e porpora in pazienti che assumevano
SSRI. Si consiglia cautela nei pazienti che assumano, oltre agli SSRI, farmaci noti per influenzare la
funzione piastrinica (ad es. gli antipsicotici atipici e le fenotiazine, la maggior parte degli
antidepressivi triciclici, l’aspirina, i FANS) così come nei pazienti con precedenti di sanguinamento o
disordini della coagulazione.
La fluvoxamina deve essere impiegata con cautela in pazienti con storia di mania/ipomania. La
fluvoxamina deve essere sospesa in ogni paziente in cui insorge una fase maniacale.
In caso di cosomministrazione con fluvoxamina, le concentrazioni plasmatiche di terfenadina,
astemizolo o cisapride possono risultare aumentate con un conseguente aumento del rischio di
prolungamento del tratto QT/Torsione di punta. Pertanto, la fluvoxamina non deve essere
somministrata insieme a questi farmaci.
A causa della mancanza di esperienza clinica, si raccomanda un’attenzione particolare nella fase postacuta di infarto del miocardio.
Poiché l’esperienza clinica di cosomministrazione di fluvoxamina e ECT è limitata, si raccomanda
cautela.
I dati nei soggetti anziani non suggeriscono differenze significative dal punto di vista clinico nei
dosaggi giornalieri normali rispetto ai soggetti più giovani. Tuttavia, l’incremento del dosaggio deve
avvenire più lentamente negli anziani e il dosaggio deve sempre essere stabilito con cautela.
A causa della mancanza di esperienza clinica, non può essere raccomandato l’impiego clinico della
fluvoxamina per il trattamento della depressione nei bambini.
Non sono disponibili dati di sicurezza a lungo termine nei bambini e negli adolescenti in particolare
relativamente alla crescita, alla funzionalità sessuale e allo sviluppo cognitivo e comportamentale. Si
raccomanda, pertanto, un attento monitoraggio in questa popolazione di pazienti.
4.5
Interazioni con altri medicinali ed altre forme d’interazione
La fluvoxamina non deve essere somministrata in associazione con IMAO (vedere anche
controindicazioni).
La fluvoxamina è un potente inibitore del CYP1A2 e, in minor misura, del CYP2C e del CYP3A4.
Farmaci che sono ampiamente metabolizzati tramite questi isoenzimi sono eliminati più lentamente e
possono raggiungere livelli plasmatici più elevati, quando somministrati in associazione con la
fluvoxamina. Ciò è particolarmente rilevante per i farmaci con un ristretto indice terapeutico. I
pazienti devono essere monitorati attentamente e, se necessario, si raccomanda un aggiustamento del
dosaggio di questi farmaci.
La fluvoxamina ha effetti inibitori marginali sul CYP2D6 e sembra non influenzare il metabolismo
non ossidativo o l’escrezione renale.
CYP1A2
E’ stato rilevato un incremento dei livelli plasmatici, precedentemente stabili, degli antidepressivi
triciclici (come clomipramina, imipramina e amitriptilina) e dei neurolettici (come clozapina e
olanzapina) che sono ampiamente metabolizzati dal citocromo P450 1A2, quando somministrati in
associazione alla fluvoxamina. Se si inizia un trattamento con la fluvoxamina, deve essere presa in
considerazione una diminuzione del dosaggio di questi farmaci. Pazienti che assumano
contemporaneamente fluvoxamina e farmaci metabolizzati tramite il CYP1A2 con un ristretto indice
terapeutico (come tacrina, teofillina, metadone e mexiletina) devono essere monitorati attentamente e,
se necessario, si raccomanda un aggiustamento del dosaggio di questi farmaci.
In cosomministrazione con fluvoxamina, la concentrazione plasmatica di warfarin aumenta
significativamente e il tempo di protrombina si allunga.
Sono stati segnalati isolati casi di tossicità cardiaca, quando la fluvoxamina era utilizzata in
combinazione con la tioridazina.
Può rendersi necessario ridurre la dose di propranololo, quando esso è utilizzato in combinazione con
la fluvoxamina, poiché i livelli plasmatici di propranololo aumentano.
E’ probabile che i livelli plasmatici di caffeina aumentino durante la cosomministrazione con
fluvoxamina. Pertanto i pazienti che assumono notevoli quantità di bevande contenenti caffeina
dovrebbero ridurne il consumo, quando sono trattati con fluvoxamina e compaiono reazione avverse
da caffeina (come tremore, palpitazioni, nausea, irrequietezza, insonnia).
Poiché le concentrazioni plasmatiche di ropinirolo possono aumentare in associazione con la
fluvoxamina aumentando quindi il rischio di overdose, può essere necessario sorvegliare e ridurre la
posologia del ropinirolo durante il trattamento con la fluvoxamina e dopo la sua sospensione.
CYP2C
Pazienti che assumano contemporaneamente fluvoxamina e farmaci metabolizzati tramite il CYP2C
con un ristretto indice terapeutico (come la fenitoina) devono essere monitorati attentamente e, se
necessario, si raccomanda un aggiustamento del dosaggio di questi farmaci.
CYP3A4
Terfenadina, astemizolo, cisapride: vedere anche le avvertenze speciali e opportune precauzioni
d'impiego.
Pazienti che assumano contemporaneamente fluvoxamina e farmaci metabolizzati tramite il CYP3A4
con un ristretto indice terapeutico (come carbamazepina e ciclosporina) devono essere monitorati
attentamente e, se necessario, si raccomanda un aggiustamento del dosaggio di questi farmaci.
I livelli plasmatici delle benzodiazepine metabolizzate mediante ossidazione (come triazolam,
midazolam, alprazolam e diazepam) possono aumentare quando questi farmaci vengono somministrati
contemporaneamente a fluvoxamina. Il dosaggio di queste benzodiazepine deve essere ridotto durante
la cosomministrazione con la fluvoxamina.
Glucuronidazione
La fluvoxamina non influenza le concentrazioni plasmatiche di digossina.
Escrezione renale
La fluvoxamina non influenza le concentrazioni plasmatiche di atenololo.
Interazioni farmacodinamiche
Gli effetti serotoninergici della fluvoxamina possono aumentare quando essa è utilizzata in
combinazione con altri farmaci ad azione serotoninergica (triptani, tramodolo, SSRI e preparati a base
di erba di S. Giovanni) (vedere anche le avvertenze speciali e opportune precauzioni d'impiego).
La fluvoxamina è stata utilizzata in associazione al litio nel trattamento di pazienti con depressione
grave, resistente al trattamento. Va comunque tenuto presente che il litio (e forse anche il triptofano)
aumenta l’effetto serotoninergico della fluvoxamina. Occorre perciò cautela nell’uso di tale
associazione in pazienti con depressione grave, resistente al trattamento.
Nei pazienti che assumono anticoagulanti orali e fluvoxamina, il rischio di emorragia può aumentare e
pertanto questi pazienti devono essere monitorati strettamente.
Come per altri farmaci psicotropi, i pazienti devono essere avvertiti di non assumere alcool mentre
sono in trattamento con fluvoxamina.
4.6
Gravidanza ed allattamento
I dati ottenuti da un limitato numero di gravidanze esposte all’uso del farmaco non evidenziano effetti
avversi della fluvoxamina sulla gravidanza. Attualmente, nessun altro dato epidemiologico rilevante è
disponibile.
Studi sulla riproduzione in animali sottoposti ad alte dosi non hanno messo in evidenza alcuna
diminuzione nella fertilità, nella capacità riproduttiva o effetti teratogenici nella prole.
Deve essere esercitata cautela quando si prescrive il farmaco in gravidanza.
Sono stati descritti casi isolati di sintomi da sospensione in neonati in seguito all’impiego della
fluvoxamina alla fine della gravidanza.
La fluvoxamina viene escreta nel latte materno in piccole quantità, pertanto il farmaco non va
somministrato a donne che allattino al seno.
4.7
Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
La fluvoxamina fino a 150 mg ha dimostrato in volontari sani di non avere effetti sulle capacità
psicomotorie necessarie per guidare e usare macchinari. Essa ha dimostrato in volontari sani di non
avere effetti sulle capacità psicomotorie necessarie per guidare ed usare macchinari. Comunque poichè
durante il trattamento con fluvoxamina può comparire sonnolenza, si raccomanda cautela finchè non
viene accertata la risposta individuale al farmaco.
4.8
Effetti indesiderati
Il più frequente sintomo associato all’assunzione di fluvoxamina, che di norma diminuisce entro le
prime due settimane di trattamento, è la nausea in qualche caso accompagnata da vomito.
Altri eventi avversi, osservati in studi clinici all’incidenza sotto descritta, sono spesso associati alla
malattia e non sono necessariamente correlati al trattamento.
Comuni (incidenza 1-10%):
Somatici: astenia, cefalea, malessere
Cardiovascolari: palpitazioni/tachicardia
Apparato digerente: dolore addominale, anoressia, stipsi, diarrea, secchezza delle fauci, dispepsia
Sistema nervoso centrale: Agitazione, ansia, vertigini, insonnia, nervosismo, sonnolenza, tremore
Cute: Sudorazione
Non comuni (incidenza <1%):
Cardiovascolari: Ipotensione (posturale)
Apparato muscoloscheletrico: artralgia, mialgia
Sistema nervoso centrale: atassia, confusione, sintomi extrapiramidali, allucinazioni
Apparato urogenitale: Eiaculazione anormale (ritardata)
Cute: reazioni di ipersensibilità cutanea (compresi rash, prurito, angioedema)
Rari (incidenza <0,1%):
Apparato digerente: alterazioni della funzionalità epatica
Sistema nervoso centrale: convulsioni, mania
Apparato urogenitale: galattorrea
Cute: fotosensibilizzazione
Altri eventi avversi osservati durante la commercializzazione del farmaco
Sono stati riportati casi di aumento o perdita di peso.
Sono stati raramente riportati sindrome serotoninergica, eventi tipo sindrome neurolettica maligna,
iponatremia e SIADH (vedere anche avvertenze speciali e opportune precauzioni d’impiego).
E’ possibile che si verifichino reazioni da sospensione quando si sospende la terapia con la
fluvoxamina, sebbene le evidenze precliniche e cliniche disponibili non suggeriscano che questo
trattamento causi dipendenza. Alla sospensione del farmaco sono stati osservati i seguenti sintomi:
vertigini, parestesia, cefalea, nausea e ansia. La maggior parte delle reazioni da sospensione è di grado
lieve e di completa risoluzione.
Quando si decide di interrompere il trattamento, le dosi devono essere ridotte in modo graduale.
Emorragie: (vedere anche avvertenze speciali e opportune precauzioni d’impiego).
Sono state osservate molto raramente parestesia, anorgasmia e modifiche del gusto.
In uno studio controllato con placebo, della durata di 10 settimane, in bambini e adolescenti affetti da
DOC, sono stati osservati i seguenti eventi avversi con un’incidenza superiore al placebo: insonnia,
astenia, agitazione, ipercinesia, sonnolenza e dispepsia. Eventi avversi seri in questo studio
includevano: agitazione e ipomania. Sono state osservate convulsioni nei bambini e negli adolescenti
in corso di utilizzo del farmaco al di fuori degli studi clinici.
4.9
Sovradosaggio
Sintomi
I più comuni sintomi da sovradosaggio comprendono disturbi gastro-intestinali (nausea, vomito,
diarrea), sonnolenza e vertigini. Sono inoltre stati osservati casi di eventi di tipo cardiaco (tachicardia,
bradicardia, ipotensione), alterazioni della funzionalità epatica, convulsioni e coma.
La fluvoxamina ha un ampio margine di sicurezza in caso di sovradosaggio. Dall’immissione in
commercio le segnalazioni di morte attribuite ad un sovradosaggio di sola fluvoxamina sono state
estremamente rare. La più alta dose documentata di fluvoxamina ingerita da un paziente è di 12
grammi: questo paziente è guarito completamente. Raramente sono state osservate complicazioni più
gravi in caso di deliberato sovradosaggio di fluvoxamina in combinazione con altri farmaci.
Trattamento
Non è disponibile alcun antidoto specifico della fluvoxamina.
In caso di sovradosaggio è opportuno procedere il più presto possibile a svuotamento dello stomaco ed
instaurare un adatto trattamento sintomatico. E’ anche consigliabile l’uso ripetuto di carbone
medicinale, se necessario accompagnato da un lassativo osmotico.
E’ improbabile che la diuresi forzata e la dialisi siano efficaci.
5.
5.1
PROPRIETÀ FARMACOLOGICHE
Proprietà farmacodinamiche
Categoria farmacoterapeutica: Antidepressivi, Inibitori selettivi del reuptake della serotonona.
Codice ATC: N06AB08
Il meccanismo d’azione della fluvoxamina è correlato all’inibizione specifica del reuptake della
serotonina a livello dei neuroni cerebrali, mentre ha solo un effetto assai modesto sul sistema
noradrenergico. Inoltre studi di legame recettoriale hanno dimostrato che la sua affinità per i recettori
alfa-adrenergici, beta-adrenergici, istaminergici, muscarinici, dopaminergici e serotoninergici è
trascurabile.
In uno studio controllato con placebo su 120 pazienti affetti da DOC, di età compresa tra 8 e 17 anni,
alla decima settimana è stato osservato un miglioramento statisticamente significativo nella
popolazione totale a favore della fluvoxamina. Un’ulteriore analisi a sottogruppi ha evidenziato un
miglioramento alla scala C-YBOCS nei bambini ma non negli adolescenti. Il dosaggio medio era,
rispettivamente, di 158 e 168 mg/die.
5.2
Proprietà farmacocinetiche
Assorbimento
La fluvoxamina è completamente assorbita dopo somministrazione orale. La massima concentrazione
plasmatica si verifica entro 3-8 ore dalla somministrazione. La biodisponibilità media assoluta è del
53%, dovuta al metabolismo di primo passaggio.
La farmacocinetica di Marchio registrato® non è influenzata dalla concomitante assunzione di cibo.
Distribuzione
In vitro, il legame con le proteine plasmatiche è dell’80%. Il volume di distribuzione nell’uomo è di 25
l/kg.
Metabolismo
La fluvoxamina va incontro ad un ampio metabolismo epatico. Sebbene in vitro il CYP2D6 sia il
principale isoenzima coinvolto nel metabolismo della fluvoxamina, le concentrazioni plasmatiche
della fluvoxamina nei soggetti metabolizzatori lenti non sono molto più alte di quelle dei soggetti con
ampio metabolismo.
L’emivita plasmatica media è di circa 13-15 ore dopo somministrazione singola e leggermente più
lunga (17-22 ore) dopo somministrazioni ripetute, mentre lo steady-state è generalmente raggiunto
entro 10-14 giorni.
La fluvoxamina viene ampiamente trasformata a livello epatico, principalmente attraverso
demetilazione ossidativa, con formazione di almeno nove metaboliti eliminati per via renale. I due
principali metaboliti sono risultati privi di attività farmacologica. Gli altri metaboliti non dovrebbero
essere farmacologicamente attivi. La fluvoxamina è un potente inibitore del CYP1A2 e un moderato
inibitore del CYP2C e del CYP3A4, con effetti inibitori solo marginali sul CYP2D6. La fluvoxamina
mostra una farmacocinetica lineare in seguito a singola somministrazione. Le concentrazioni allo
steady-state sono più alte di quelle calcolate dopo singola somministrazione e, alle più alte dosi
giornaliere, non sono proporzionalmente più alte.
Gruppi speciali di pazienti
La farmacocinetica della fluvoxamina è simile negli adulti sani, negli anziani e nei pazienti con
insufficienza renale. Il metabolismo della fluvoxamina è ridotto nei pazienti con patologia epatica.
Le concentrazioni plasmatiche allo steady-state della fluvoxamina sono due volte più elevate nei
bambini (di età compresa tra 6 e 11 anni) rispetto agli adolescenti (età 12-17). Le concentrazioni
plasmatiche degli adolescenti sono simili a quelle degli adulti.
5.3
Dati preclinici di sicurezza
Non vi è evidenza di effetti carcinogenetici, mutageni o sulla fertilità da parte della fluvoxamina.
Studi sulla riproduzione in animali sottoposti ad alte dosi non hanno messo in evidenza alcuna
diminuzione nella fertilità, nella capacità riproduttiva o effetti teratogenici nella prole.
La potenzialità per l’instaurarsi di abuso, tolleranza e dipendenza fisica è stata studiata in modelli di
primati non umani. Non è stato evidenziato alcun fenomeno di dipendenza.
6.
INFORMAZIONI FARMACEUTICHE
6.1
Elenco degli eccipienti
6.2
Incompatibilità
Non pertinente.
6.3
Periodo di validità
6.4
Speciali precauzioni per la conservazione
6.5
Natura e contenuto del contenitore
Vedere Allegato II.
E’ possibile che non tutte le confezioni siano commercializzate.
6.6
Istruzioni per l'impiego e la manipolazione
Nessuna istruzione particolare.
7.
TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO
Vedere Allegato II
8.
NUMERO DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
9.
DATA DELLA PRIMA AUTORIZZAZIONE/ RINNOVO DELL’AUTORIZZAZIONE
10.
DATA DI REVISIONE DEL TESTO
ALLEGATO IV
CONDIZIONI DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
Condizioni dell’autorizzazione all’immissione in commercio
Requisiti del CPMP relativi al follow-up della popolazione pediatrica
Devono essere forniti altri dati di sicurezza relativi al trattamento a lungo termine del DOC nei
bambini e negli adolescenti, specialmente per quanto riguarda crescita, funzione sessuale,
educazione/sviluppo cognitivo ed effetti sul comportamento.
Il titolare dell’autorizzazione all’immissione in commercio deve collaborare con il gruppo di lavoro
Farmacovigilanza per discutere sul progetto inteso a chiarire la strategia per adempiere all’impegno e
successivamente deve attuare il programma accordato.