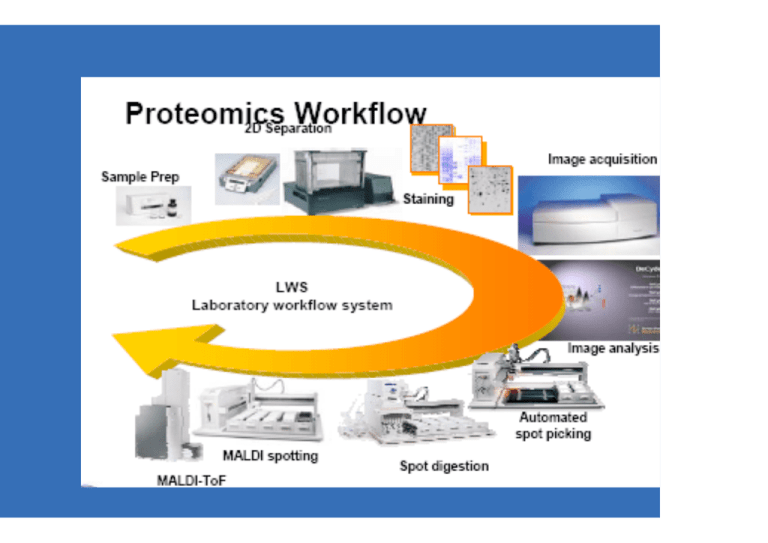
METODI DI SEPARAZIONE IN PROTEOMICA
ELETTROFORESI DI PROTEINE INTATTE
•MONODIMENSIONALE
•BIDIMENSIONALE
CROMATOGRAFIA MONODIMENSIONALE DI PROTEINE INTATTE
•GEL FILTRAZIONE
•AFFINITA’
CROMATOGRAFIA MONO o BIDIMENSIONALE DI PEPTIDI
•SCAMBIO IONICO
•FASE INVERSA
SHOT GUN
PROTEOMICS
Elettroforesi bidimensionale (2-D)
nica analitica che consente di frazionare le proteine sulla base di due loro proprietà chimico-fisic
punto isoelettrico (pI)
peso molecolare (MW)
Nella prima dimensione ovvero nel corso dell’isoelectrofocusing (IEF) le proteine , in un grad
i pH ed in condizioni denaturanti, migrano, sotto l’azione di un campo elettrico, fino alla posizion
n cui il pH eguaglia il loro pI.
Nella seconda dimensione ovvero nel corso dell’SDS-PAGE, le proteine, legate alle molecole di un
etergente anionico, quale l’SDS, migrano, sotto l’azione di un campo elettrico, attraverso le mag
el gel in base al loro solo peso molecolare.
• Proteine, polipeptidi e peptidi sono biopolimeri aventi come unità
monomeriche 20 tipi di alfa amino acidi (aa).
• La carica netta di una proteina o di un peptide dipende dal suo
contenuto di amminoacidi e dal pH della soluzione in cui la molecola
è immersa.
LA CHIMICA DEGLI
AMMINOACIDI
• Gli amminoacidi (aa) sono molecole organiche che
hanno almeno una funzione acida (-COOH) ed una
basica (-NH2).
• Di particolare importanza sono
gli
α−aa,
poiché
sono
i
monomeri costituitivi delle
proteine. Ad eccezione della
prolina, essi presentano legato
al carbonio C-α tetraedrico, un
H e una catena laterale R.
Struttura amminoacidi
Gli aa hanno diversa affinità per l’acqua (idrofilicità) che
dipende dalla natura del gruppo R.
Equilibri degli amminoacidi in soluzioni acquose
Catione
pH acido
Ione dipolare
(zwitterione)
pH neutro
Anione
pH basico
A questi equilibri vanno ovviamente aggiunti quelli relativi al gruppo R
qualora esso presenti gruppi ionizzabili.
PUNTO ISOELETTRICO
Ka
HA
A- + H+
Ka=[H+][A-]
[HA]
• Il pKa corrisponde al pH in cui la concentrazione della specie
protonata è uguale a quella dissociata: [HA]=[A-]
• Quindi la carica netta di un composto acido/base e quindi di un
aa è influenzata dal pH della soluzione in cui è immerso.
• Il pH al quale la carica netta di un aa (o di una proteina) è
uguale a zero viene definito punto isoelettrico .
• La specie molecolare con carica netta=0 è detta zwitterione.
Il pI di una proteina Ë il valore di pH a cui la
proteina assume una carica elettrica pari a 0
(ovvero Ë priva di carica).
Table of pKa and pI values
•The pKa values and the isoelectronic point, pI, are
given below for the 20 _-amino acids.
•pKa1= _-carboxyl group, pKa2 = α-ammonium ion,
and pKa3 = side chain group.
Amino acid
pKa1 pKa2 pKa3 pI
Glycine
2.34
9.60
---
5.97
Alanine
2.34
9.69
---
6.00
Valine 2.32
9.62
---
5.96
Leucine
2.36
9.60
---
5.98
Isoleucine
2.36
9.60
---
6.02
Methionine
2.28
9.21
---
5.74
Proline 1.99
10.60 ---
Fattori che influenzano il valore
del pI di una proteina:
Composizione amminoacidica
6.30
Phenylalanine 1.83
9.13
---
5.48
Tryptophan
2.83
9.39
---
5.89
Asparagine
2.02
8.80
---
5.41
Glutamine
2.17
9.13
---
5.65
Serine 2.21
9.15
---
5.68
Threonine
2.09
9.10
---
5.60
Tyrosine
2.20
9.11
---
5.66
Cysteine
1.96
8.18
---
5.07
Aspartic acid 1.88
9.60
3.65
2.77
Glutamic acid 2.19
9.67
4.25
3.22
Lysine 2.18
8.95
10.53 9.74
Arginine
2.17
9.04
12.48 10.76
Histidine
1.82
9.17
6.00
7.59
Struttura tridimensionale
Modifiche post-traduzionali che
introducono e/o alterano gruppi
acidi o basici
Composizione amminoacidica
PROTEINE ACIDE E PROTEINE BASICHE
(Σlys + Σarg + Σhis) / (Σasp + Σglu ) >1
sono basiche
alti pI
(Σlys + Σarg + Σhis) / (Σasp + Σglu ) <1
sono acide
bassi pI
Struttura tridimensionale
Il pH locale influenza i pKa e di conseguenza anche i pI
Modifiche post-traduzionali
Alcune PTMs che modificano i pKa delle catene laterali
Ser, Thr, Tyr
Fosforilazione
Ser, Thr
O-glicosilazione
Lys, Arg
Metilazione
Lys
Ubiquitinilazione
Lys e N-terminale
/
/
Acetilazione
-
Asn, Gln
Deammidazione
-
Asn
N-glicosilazione
/
RUN 2-DE, STEP BY STEP
RUN 2-DE STEP BY STEP
RUN 2-DE STEP BY STEP
RUN 2-DE STEP BY STEP
Step 1: Preparazione del campione
Generalmente, una procedura efficace di preparazione del campione deve includere:
•La solubilizzazione riproducibile di tutte le classi proteiche , incluse quelle
idrofobiche.
•La denaturazione delle proteine.
• La prevenzione dell’aggregazione proteica ed il mantenimento della solubilità delle
proteine durante l’IEF.
•La prevenzione di modifiche chimiche ed enzimatiche delle proteine possibili con il
processo di loro estrazione.
•La rimozione di altre macromolecole che possono interferire nel corso dell’IEF.
La solubilizzazione e la denaturazione delle proteine si ottiene
mediante trattamenti specifici che utilizzano:
Urea (e tiourea)(denaturanti)
Tioli (riducenti)
Detergenti
Inibitori di proteasi.
Denaturazione
Induce ogni singola proteina in un’unica conformazione
facendo in modo che abbia un unico pI.
(Se una stessa proteina assume conformazioni diverse,
ciascuna di esse presenterà pI diversi perchè influenzati
dal particolare intorno chimico delle catene laterali).
Inoltre, l’azione denaturante aiuta a solubilizzare e ad
inibire eventuali attività enzimatiche
presenti in soluzione.
UREA
L’urea è solitamente l’agente caotropico più utilizzato, ma nel caso
di proteine difficili da solubilizzare, si utilizza in miscela con la
TIOUREA .
Urea e tiourea rompono i ponti idrogeno intra e inter-molecolari.
Normalmente, si utilizzano soluzioni di urea 8M, ma anche miscele
di urea 5-8M e tiourea 2M.
In genere vengono utilizzati detergenti non carichi (NP-40,
Triton X100, etc) o zwitterionici (CHAPS, etc).
Il CHAPS è un detergente zwitterionico
utilizzato per aumentare la solubilità
delle proteine idrofobiche.
L’SDS è una molecola carica negativamente e
legandosi
alle
proteine
forma
micelle
detergente-proteine
non
consentendo
una
corretta focalizzazione in quanto maschera i
pI.
Tuttavia, esso risulta compatibile con l’IEF
qualora sia presente nel campione finale ad una
concentrazione minore dello 0,25% e si trovi in
rapporto <1/8 con detergenti
non ionici o
zwitterionici.
NP-40 e Triton X100 sono blandi detergenti
non ionici.
Occorre
fare
attenzione
alle
attività
enzimatiche che vengono mantenute (proteasi
Degradazione
Inibitori di Proteasi:
Anche se le condizioni utilizzate per la
preparazione
del
campione
sono
denaturanti, alcuni enzimi proteolitici
riescono a rimanere attivi degradando le
proteine durante le fasi che precedono la
corsa elettroforetica.
A tale scopo è utile includere nel
tampone di estrazione / preparazione del
campione degli inibitori di proteasi.
Solitamente questi inibitori vengono
venduti sotto forma di cocktails pronti
all’uso.
Inibitori di Fosfatasi:
1 mM NaF
1 mM Na3VO4
Solubilizzazione
Denaturazione di proteine contenenti ponti disolfurici
AGENTI RIDUCENTI
Per rompere i ponti disolfurici, si utilizzano
ditiotreitolo (DTT) o tributil-fosfina (TBP).
Per la maggiorparte dei casi, è sufficiente una
soluzione di DTT 50mM, mentre per casi difficili
è preferibile usare la TBP.
AGENTE ALCHILANTE
IODOACETAMMIDE
Piccole molecole organiche polimeriche provviste della presenza
contemporanea di gruppi basici e acidi, altamente solubili e anfoteriche
con un pI determinato dai suddetti gruppi ed un alto potere tamponante
al loro valore di pI.
Aumentano la solubilità delle proteine e prevengono interazioni proteinegel. Le miscele di anfoliti sono scelte
opportunamente a seconda dell’intervallo di
pH usato per l’isolettrofocusing
B
B
B
A
B
H3C
CH3
A
A
B
B
A
A: gruppo acidico
B: gruppo basico
B
PRECIPITAZIONE
Sostanze che interferiscono con l’analisi in prima dimensione (IEF):
1) DNA
2) Lipidi
3) Sali
4) detergenti
5) polisaccaridi
Disturbano il processo di IEF e quello di colorazione del gel.
Le procedure di precipitazione rendono possibile separare la componente proteica (che
precipita) dagli inquinanti (che rimangono in soluzione).
Dove possibile è preferibile non adottare alcuna procedura di precipitazione poichè:
1)
non è detto che l’efficienza di precipitazione sia uguale per tutte le proteine =>
alterazione del campione
2)
Non è detto che tutte le proteine precipitate siano facilmente riportabili in soluzione
=> alterazione del campione.
Vale sempre la regola generale secondo la quale:
Tabella delle metodiche di precipitazione
Chloroform-methanol
precipitation: Suggested for
low concentrated protein
mixture
Proteins are precipitated as pellet at the
interface of a methanol-chloroform and
water mixture, and then recovered after
washings and centrifugation steps
Because of pellet presence at the double
phase interface, it could be difficult to
recover with a low loss
PRECIPITAZIONE CON SOLVENTI ORGANICI
Le proteine nella loro forma nativa presentano una superficie con un carattere prevalentemente
idrofilico e un interno prevalentemente idrofobico. In un tampone fisiologico esse rimangono in
soluzione grazie all’acqua che forma legami idrogeno con i residui presenti sulla loro superficie.
Sostituendo alla soluzione fisiologica un solvente organico apolare e
preservando la loro struttura terziaria (basse temperature), si fa in
modo che le porzioni idrofiliche delle proteine si aggreghino e
contemporaneamente
vengano
esposte
quelle
idrofobiche.
Sostanzialmente si ha un effetto opposto all’effetto idrofobico durante
la strutturazione delle proteine.
MEZZO APOLARE
AGGREGAZIONE
RUN 2-DE STEP BY STEP
IL PRINCIPIO DELL’IEF
pH<pI
pH>pI
+
Charge Charge
Towards catode
Towards anode
ddp
pI = 7.4 0
pI = 8.4 0
+
+
0
+
0
pH10
pH3
pH = 7.4
pH = 8.4
Una proteina dispersa in un gradiente di pH, si troverà ad avere carica netta positiva, netta negativa oppure (se si
trova già ad un pH pari al suo pI) nulla. Sottoposta all’azione di un campo elettrico opportunamente orientato, essa si
muoverà, a seconda della sua carica verso l’elettrodo di segno opposto, fino a raggiungere il pH pari al suo pI. In
questo punto, essa assume carica netta nulla e non è più sottoposta all’azione del campo elettrico. Se si allontana dalla
regione dove pH=pI, essa assume un’opportuna carica e viene nuovamente focalizzata. => Questo conferisce alta
risoluzione all’IEF.
Più una proteina è lontana dal suo pI (in termini di pH), maggiore sarà la sua carica e dunque
anche la sua mobilità elettroforetica: mano a mano che essa si avvicina al pH pari al suo pI, la sua
carica netta diminuisce e di conseguenza diminuisce anche la sua mobilità elettroforetica =>per
questo il processo di focalizzazione è un processo che solitamente richiede tempi lunghi!
L’isoelettrofocalizzazione
Prima …
e dopo…
IL potere risolutivo dipende dal gradiente di pH.
Anfoliti
Possono essere generati da:
Derivati dell’acrilammide (IPG strip
Questi derivati dell’acrilammide sono noti come
Immobilines. I gruppi R possono essere gruppi
carbossilici o amminici (pKa da 0.8 a 4.6 / pKa
da 6.2 a 12).
mposti contenenti un numero variabile di
uppi amminici e carbossilici. Ciascuna
olecola ha un suo pI ed un’alta capacità
mponante al suo pI. Sottoposte all’azione di
campo elettrico migrano a seconda della
opria carica netta generando un gradiente
pH.
SVANTAGGI
gradiente non è stabile durante l’analisi ed
influenzabile dalle molecole che vengono
alizzate.
s. acida
s. basica
-
VANTAGGI
- La chimica delle IPG è più controllabile.
-Essendo prodotte industrialmente (GMP), sono m
suscettibili a variabilità.
-Sono facili da maneggiare e, grazie al fatto che s
immobilizzati, i gradienti di pH sono costanti durante l’I
-Con le IPG, si possono caricare alti quantitativi
proteine e se ne riducono le perdite durante l’equilibra
nell’SDS buffer.
Le IPG strips possono avere diverse lunghezze e diversi e ristretti range di pH.
nsentono risoluzioni dell’ordine di 0,001 unità di pH incrementando così di oltre il 30% il numero di spots
ualizzabili.
Apparecchio per IEF ( focalizzazione isoelettrica)
Caricamento del campione
radienti di pH immobilizzati (IPG strips) sono di solito
idratati e devono essere reidratati in opportune
ndizioni.
luzione di reidratazione
M Urea (o in alternativa la composizione usata per il
is buffer), 4-0,5 % CHAPS, 0,2 % DTT (o altri agenti
ucenti), 0,5% (fino a 2% nel caso di strip da 24 cm) IPG
ffer, 10% glicerolo.
Rehydration loading
campione che si trova in lysis buffer viene diluito in
ehydration buffer e lasciato 1h ad equilibrare.
uccessivamente viene caricato nello strip holder
contenitore delle stesse dimensioni della strip). Il gel
iene applicato a testa in giù in modo che si stabilisca
n contatto con gli elettrodi e la soluzione di
eidratazione e viene lasciato in queste condizioni per
2 h con applicata una ddp di 50 V. In queste
ondizioni il gel che in origine era secco si rigonfia e
ello stesso tempo le proteine, presenti in soluzione,
engono “aspirate” assieme al liquido. Il voltaggio
avorisce l’entrata delle proteine nel gel. La strip
iene coperta con un apposito olio (cover fluid) per
are in modo che durante la corsa il campione non
vapori.
Cup loading
Il gel viene reidratato senza campione
seguendo una procedura analoga a quella
utilizzata
per
il
caricamento
a
reidratazione (rehydration loading). Al
termine della reidratazione, il gel viene
posizionato verso l’alto in un’apposita
vaschetta. Sul gel, in una determinata
posizione
(a
seconda
che
sia
un
caricamento anodico o catodico) viene
collocata un apposito applicatore dentro il
quale viene caricato il campione. Dopo il
caricamento del campione, con il gel così
posizionato, viene effettuata la corsa di
IEF.
Incrementi dei voltaggi per isoelettrofocalizzazione
Rehydratation loading
Cup loading
Il voltaggio può essere aumentato sia in modo lineare (ramping) che in modo brusco
(step and hold) a seconda che si sia effettuato un cup o rehydration loading. Importante
è impostare un amperaggio massimo per ciascuna strip (1 strip => 50 µA max - 2 strip =>
100 µA max - ecc). Alla fine della corsa si applica solitamente per 15 minuti il massimo
voltaggio in modo da rifocalizzare le proteine che possono essere diffuse lateralmente.
Al termine della focalizzazione
a)
Possono essere subito trattate per la seconda dimensione.
b)
Possono essere congelate (-80 °C) dopo lavaggi in acqua ed opportuna asciugatura su
carta assorbente. La seconda dimensione può essere corsa in un secondo momento.
E’ IMPORTANTE ESEGUIRE IN CONTEMPORANEA LE STESSE OPERAZIONI
PER TUTTE LE STRIP DA CONFRONTARE!












