10 - Obiettivi finali che il Progetto si propone di raggiungere (max 8000)
Testo italiano (7534)
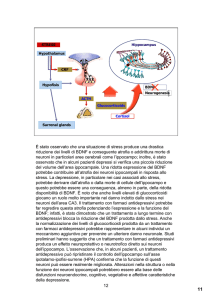
L’obiettivo generale di questo progetto è chiarire i meccanismi molecolari e cellulari che
sottendono le azioni di BDNF nel cervello, al fine di fornire una base per lo sviluppo di nuove
terapie per le malattie neuro-psichiatriche. Questo obiettivo verrà perseguito attraverso le 10
linee di ricerca descritte sotto, ciascuna condotta da una Unità di Ricerca (UR) con la
collaborazione di altre, come descritto in dettaglio nei modelli B.
1) Analisi e regolazione farmacologica delle varianti di splicing del BDNF (UR1-UniTS, in
collaborazione con UR6-UniMI, UR7-CNR, UR8-UniFE).
Analizzeremo il ruolo di diverse varianti di splicing di BDNF in condizioni fisiologiche e
patologiche, nelle varie fasi della neurogenesi dei neuroni del giro dentato (DG)
dell'ippocampo. Sfrutteremo il codice spaziale delle varianti di BDNF per la progettazione di
strategie farmacologiche volte a stimolare la produzione di BDNF solo in specifiche regioni
dell'ippocampo. A questo fine, andrà chiarito il ruolo delle varianti di BDNF nell’integrazione
dei neuroni neonati, il profilo farmacologico della traduzione delle varianti di BDNF, il profilo
farmacologico del traffico dell’mRNA di BDNF. Ci proponiamo anche di determinare
l'espressione e la localizzazione delle isoforme nel cervello di modelli animali di malattie
neurologiche.
2) BDNF e controllo della maturazione e dell’integrazione funzionale di neuroni neo-generati
nel cervello adulto (UR2-UniBO).
Studieremo i requisiti essenziali per l’integrazione e la sopravvivenza dei neuroni neogenerati. Ci concentreremo sul ruolo di TrkB e p75NTR nella connettività dei neuroni neogenerati dell’ippocampo e del bulbo olfattivo adulto, e studieremo: 1) ruolo dei recettori di
BDNF nella morfogenesi; 2) regolazione epigenetica dell’espressione di TrkB e p75 durante il
differenziamento neuronale; 3) ruolo di TrkB nella generazione e integrazione di nuovi
neuroni nel cervello adulto; 4) ruolo di TrkB nel rendere i neuroni neo-generati sensibili
all’attività neuronale dei circuiti pre-esistenti; 5) reclutamento funzionale dei neuroni neogenerati nei circuiti nervosi.
3) Analisi del ruolo delle sinapsine (SYNs) e di BDNF sulla neurogenesi dell’ippocampo (UR3UniGE, con UR2-UniBO e UR8-UniFE).
La neurogenesi nell’adulto a livello dell’ippocampo è regolata da vari fattori, come BDNF,
SYNs ed epilessia. Le SYNs sono una famiglia di fosfoproteine associate alle vescicole
sinaptiche e le loro mutazioni sono implicate anche nell’epilettogenesi. Gli scopi principali di
questa parte del progetto sono l’analisi del ruolo delle SYNs nella neurogenesi, la
caratterizzazione degli effetti delle crisi epilettiche sulla neurogenesi nei topi SYNs KO e
l’analisi degli effetti di BDNF sulla neurogenesi dei topi SYNs KO prima e dopo l’insorgenza
delle crisi.
4) Studi strutturali e funzionali di BDNF e proBDNF, e loro interazioni con TrkB, p75 e
sortilina (UR4-SNS).
proBDNF e il BDNF maturo saranno caratterizzati dal punto di vista biochimico e biofisico
usando tecniche di spettroscopia (Dicroismo Circolare; Spettroscopia al Sincrotrone NMR) per
analizzare la struttura secondaria; analitiche (EI MS; HPLC) per analizzare la struttura
terziaria; biochimiche (SEC, PAGE) per studiare lo stato di oligomerizzazione delle proteine;
biofisiche (diffusione dinamica della luce) per studiare lo stato di polidispersione delle
proteine.
5) Aumento transgenico dell’espressione di BDNF (UR4-SNS).
N. Furzeri (un pesce a vita breve) può essere usato come modello genetico per studiare il
BDNF. Lo scopo qui è di modificare geneticamente N. Furzeri per sovraesperimere BDNF.
Questo modello sarà usato per studiare gli effetti di BDNF sull’invecchiamento.
6) BDNF e sindrome di Rett, RTT (UR4-SNS, con UR8-UniFE).
Il fenotipo RTT può essere migliorato nei topi MeCp2-/Y dalla sovraespressione di BDNF.
Tuttavia, la somministrazione diretta di BDNF può avere effetti collaterali quali crisi
epilettiche. Per questo motivo, la UR4-SNS produrrà il mutante R100 di BDNF, sulla base di
studi recenti sul mutante R100 dell’NGF, legato alla neuropatia HSAN V. BDNF sarà
somministrato a modelli murini di RTT, i topi MeCP2-/Y e FoxG1+/-, tramite
somministrazione intranasale o attraverso la somministrazione di mesangioblasti (MABs,
cellule staminali mesodermiche multipotenti) ingegnerizzati a secernere BDNF. L’espressione
di FOXG1 e BDNF sarà analizzata tramite western blot o ELISA, e sarà valutato l’effetto sul
fenotipo Rett.
7) Ruolo neuroprotettivo di BDNF nella malattia di Alzheimer, AD (UR5-UniAQ, con UR1UniTS, UR6-UniMI, UR4-SNS).
Utilizzeremo vari approcci per aumentare l’espressione endogena di BDNF e/o la sua attività
in modelli di AD. In particolare, miriamo a dimostrare che 1) BDNF controlla la funzione
sinaptica nella corteccia entorinale (EC); 2) BDNF previene la disfunzione sinaptica Abetadipendente nella EC; 3) trattamenti non invasivi basati sul BDNF migliorano i deficit cognitivi
in modelli di AD. Nei vari modelli sperimentali, studieremo gli effetti di BDNF nell’AD, i suoi
meccanismi molecolari, metodi per somministrare in modo efficace e sicuro BDNF nelle aree
bersaglio, nuove molecole con attività simile a BDNF.
8) Analisi epigenetica di un modello animale gene-ambiente per malattie neuropsichiatriche
basato sul polimorfismo umano Val66Met di BDNF (UR6-UniMI, con UR1-UniTS).
Obiettivo principale sarà condurre un'analisi genome-wide di modificazioni epigenetiche
differenziali (screening epigenetico mediante ChiP-Seq) in topi transgenici adulti
BDNFMet/Met e BDNFVal/Val. Inoltre, valuteremo le modificazioni epigenetiche indotte nei
topi BDNFMet/Met da stress psicosociale cronico, CSC (Slattery et al., 2011). Principale
obiettivo dello studio è l'identificazione di: 1) geni attivati/repressi dalla presenza del
polimorfismo umano di BDNF o 2) dal CSC nel contesto di vulnerabilità genetica del topo
BDNFMet/Met; 3) conseguenze morfologiche e funzionali delle modificazioni epigenetiche,
che permetteranno di identificare biomarcatori di patologia e bersagli farmacologici.
9) Ruolo di BDNF nello sviluppo del sistema GABAergico nei topi En2-/-, modello murino di
disordini dello spettro autistic, DSA (UR7-CNR, con UR1-UniTS).
L’obiettivo è capire il ruolo di BDNF nella patogenesi dei DSA. 1) Studieremo il ruolo di BDNF
nella maturazione degli interneuroni GABAeregici nel cervello dei topi En2-/-. I nostri studi
suggeriscono che i difetti del sistema GABAergico osservati nei topi En2-/- possano essere
dovuti ad una alterata sintesi/funzione di BDNF. 2) Studi funzionali saranno condotti per
capire se la sovraespressione di BDNF a partire dalle prime fasi di vita postnatale è in grado di
recuperare i difetti nei circuiti GABA ed i comportamenti “autistici” nei topi En2-/-.
10) Coinvolgimento di BDNF nelle epilessie focali e sviluppo di strategie per un delivery
selettivo nelle aree epilettogene (UR8-UniFE, con UR1-UniTS, UR2-UniBO e UR3-SNS).
Al fine di sviluppare una terapia per l’epilessia basata su BDNF, è essenziale 1) capire il
coinvolgimento di BDNF nell’ epilettogenesi e 2) migliorare le strategie di delivery. In
relazione al primo aspetto, analizzeremo le varianti di splicing, il signaling TrkB e il sito
d'azione. In relazione al secondo, esploreremo l'uso di MAB ingegnerizzati per produrre BDNF
iniettati perifericamente (che dovrebbero attraversare la barriera emato-encefalica e
raggiungere selettivamente le aree epilettogene lesionate) e di cellule staminali pluripotenti
indotte (iPS) trapiantate nella zona di lesione da sole o con BDNF.
Testo inglese (7881)
The final objective of this project is to clarify the molecular and cellular mechanisms
underlining the actions of BDNF in the brain, with the goal to pave the way to the
development of new therapeutic strategies for major neurological disorders. The final
objective will be pursued by the following ten research lines, each directed by one Research
Unit (RU) with the collaboration of others, as detailed in the parts B of this proposal.
1) Analisis and pharmacological regulation of BDNF mRNA splice variants (RU1-UniTS, in
collaboration with RU6-UniMI, RU7-CNR, RU8-UniFE).
We will test the role of different BDNF splice variants under physiological and pathological
conditions, in various stages of the neurogenesis of hippocampal neurons in the dentate gyrus
(DG). We also aim at exploiting the BDNF variants’ spatial code for the rational design of
pharmacological strategies designed to selectively stimulate the production of BDNF in
specific regions of the hippocampus. To pursue this aim, we will clarify the role of BDNF
variants in the wiring of newborn DG neurons; the pharmacological profile of BDNF variants
translation; the pharmacological profile of BDNF mRNA trafficking. We will also determine
the expression and localization of BDNF isoforms in the brain of animal models of
neurological diseases.
2) Mechanisms implicating BDNF activity in the control of maturation and functional
integration of newly generated neurons in the adult brain (RU2-UniBO).
We will investigate the key requirements for a newly generated neuron to integrate and
survive. These studies may provide cues to ameliorate functional deficits caused by
neurodegenerative and psychiatric diseases. We will focus on the role of TrkB and p75NTR on
newborn neurons connectivity in the adult hippocampus and olfactory bulb, by investigating
1) the role of BDNF receptors in the acquisition of newborn neurons morphology; 2)
epigenetic regulation of TrkB and p75 gene expression during neuronal differentiation; 3) the
role of TrkB signaling on generation and integration of newborn neurons in adults; 4) the role
of TrkB in enabling newborn neurons to sense neuronal activity of the pre-existing network;
5) functional recruitment of newborn neurons into behaviourally relevant circuits.
3) Clarification of the role of SYNs and BDNF on hippocampal neurogenesis, by using SYN
knock-out (KO) mice (RU3-UniGE, with RU2-UniBO and RU8-UniFE).
Adult neurogenesis in the hippocampus is regulated by several factors, including BDNF, SYNs
and epilepsy. SYNs are a family of phosphoprotein associated with synaptic vesicles and their
mutations have been implicated also in epileptogenesis. The main aims of this part of the
project are the analysis of the role of SYNs on the neurogenesis processes in the adult brain,
the characterization of the effects of epileptic seizure on neurogenesis in SYNs KO mice and
the analysis of the effects of BDNF on neurogenesis in SYNs KO mice before and after the
outset of the epileptic seizures.
4) Structural and functional studies of BDNF and proBDNF and their interactions with TrkB,
p75 and sortilin (RU4-SNS).
proBDNF and BDNF mature will be biochemically and biophysically characterized by means
of spectroscopy (Circular Dichroism; Syncrotron spectroscopy; NMR) to probe secondary
structure; analytically (EI MS; HPLC) to have insight on the tertiary structure; biochemically
(SEC, PAGE) for the study of the oligomerization state of the proteins; biophysically (dynamic
light scattering), to study the polydispersion state of the proteins.
5) Transgenic manipulations of BDNF in the short-lived fish N. Furzeri (RU4-SNS).
N. Furzeri (a short-lived fish) can be used as a genetic model to manipulate BDNF. The main
aim of this part of the project will be the genetic modification of N. Furzeri to overexpress
BDNF. Once obtained the models, the effects of the overexpression of BDNF on life-history
traits will be studied.
6) BDNF and Rett Syndrome (RU4-SNS, with RU7-CNR, RU8-UniFE)
It has been reported that the RTT phenotype can be rescued in mice obtained crossing
MeCP2-/Y with BDNF overexpressing mice, stating a direct involvement of BDNF in RTT.
However, direct administration of BDNF generates potential side effects such as epilepsy. For
this reason we will generate the mutein BDNF R100, inspired by recent work of our group on
NGF HSAN V R100 mutant. BDNF will be administered in two RTT murine models, MeCP2 -/Y
and FoxG1+/- by means of intranasal delivery or by mesoangioblasts (MABs, multipotent
mesodermal stem cells) engineered to produce BDNF. The expression of FOXG1 and BDNF
will be evaluated in different brain areas, together with the rescue of the RTT phenotype.
7) Neuroprotection by BDNF in Alzheimer disease (RU5-UniAQ, with RU1-UniTS, RU6- UniMI,
RU4-SNS).
We will use different approaches to increase the endogenous expression of BDNF and/or its
activity in models of Alzheimer disease (AD). In particular, using a combined molecular,
electrophysiological and behavioral approach we aim at showing that 1) BDNF controls
synaptic function in the enthorinal cortex (EC); 2) BDNF prevents Abeta-dependent synaptic
dysfunction in EC; 3) non-invasive BDNF-based treatments rescue cognitive deficits in AD
models. We will afford critical issues on experimental models to study BDNF effects in AD,
molecular pathways underlying BDNF effects, methods for achieving effective and safe BDNF
delivery into the target areas, new molecules characterized by BDNF-like activity.
8) Epigenetic analysis of a gene-environment animal model of neuropsychiatric disorders
carrying the human val66met human polymorphism (RU6-UniMI, in collaboration with RU1UniTS).
Main goal of this RU will be to perform a genome-wide analysis of differential epigenetic
changes (ChIP-Seq epigenetic screen) in adult BDNFMet/Met transgenic mice and
BDNFVal/Val mice. Moreover, we will assess epigenetic changes in BDNFMet/Met mice with
CSC chronic psychosocial stress (Slattery et al., 2011). Aim of the study is the identification of:
1) genes activated/repressed by the presence of the human BDNF polymorphism or 2) by CSC
in the context of genetic vulnerability of BDNFMet/Met mice; 3) morphological and functional
consequences of epigenetic changes (with RU1-UniTS), allowing to identify possible
biomarkers of human pathology and putative drug targets.
9) Development of the GABAergic system in En2-/- mice, a model for Autism Spectrum
Disorders (ASD), and role of BDNF in this process (RU7-CNR, in collaboration with RU1UniTS).
We aim to understand the role of BDNF in the pathogenesis of ASD. 1) We will investigate the
role of BDNF in the maturation of GABAergic interneurons in the brain of En2-/- mice. Our
studies suggest that the GABAergic system defects observed in En2-/- mice may be due to an
altered synthesis/function of BDNF. 2) Functional studies will be performed to understand
whether BDNF overexpression during early postnatal development can restore a normal
GABAergic circuitry and rescue ASD-like behaviours in En2-/- mice.
10) Implication of BDNF in focal epilepsies and development of delivery strategies for its
selective delivery in the epileptogenic area (RU8-UniFE, in collaboration with RU1-UniTS,
RU2-UniBO and RU3-SNS).
To develop a BDNF based therapy for epilepsy, it is essential 1) to refine our understanding of
the implication of BDNF in epileptogenesis and 2) to improve the delivery strategies. In the
first respect, we will analyze the splice variants, the TrkB signaling pathway, the site of action.
In the second, we will explore the use of peripherally injected MABs engineered to produce
BDNF (peripherally administered MABs are expeted to cross the blood-brain barrier and
selectively home in the lesioned, epileptogenic areas) and of induced pluripotent stem cells
(iPS) transplanted in the lesion area alone or together with BDNF.