Bergamo,
OGGETTO: FARMACOVIGILANZA
- Resoconto semestrale della segnalazione spontanea – Anno 2006
- Nimesulide ed epatotossicità
- Note informative AIFA ed EMEA su Magnevist® (acido gadopentetico, sale
dimegluminico) e sui medicinali contenenti Piroxicam
- Nota informativa AIFA sulle incompatibilità chimico-fisiche di Ceftriaxone
- Aggiornamento farmaci soggetti a monitoraggio intensivo ai fini di
Farmacovigilanza.
PAROLE CHIAVE:
- Andamento delle segnalazioni di reazioni avverse ai farmaci nelle regioni aderenti al
GIF – Anno 2006
- Informative di Farmacovigilanza, provenienti dalle Agenzie Regolatorie
- Monitoraggio intensivo
ABSTRACT- NOVITA’ DI RILIEVO:
- Resoconto semestrale: nel documento vengono analizzate le segnalazioni
pervenute nel corso del 2006 nelle regioni aderenti al GIF (Gruppo Interregionale di
Farmacovigilanza). Per la prima volta dal 2001 è in aumento il numero delle
segnalazioni relative ai farmaci (vaccini esclusi) e la Lombardia è al primo posto per
numero di segnalazioni. Vengono commentati i ”segnali” evidenziati nel 2° semestre
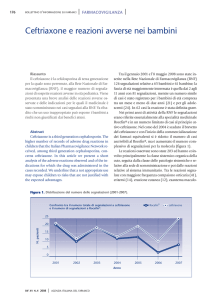
2006, tra questi: Acido ranelico e insonnia; Ceftriaxone e vasculite, Contraccettivi orali
ed adenoma epatico, Glitazoni e miopatia, Ibuprofene e CID (Coagulazione Intravasale
Disseminata), Infliximab e reazioni avverse cardiache,
Inibitori di pompa
(omeprazolo, lansoprazolo) e reazioni anafilattiche, Levofloxacina (e altri
fluorochinoloni) e disturbi visivi, Moxifloxacina (e altri fluorochinoloni) e shock
anafilattico, Nimesulide e balanopostite, Oxcarbazepina e diminuzione del T4,
Prulifloxacina e rottura del tendine, Rabeprazolo e reazioni psichiatriche, Sartani e
impotenza, Ticlopidina e reazioni epatiche, Tiocolchicoside e shock anafilattico.
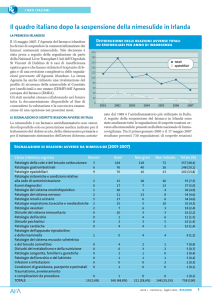
- Nimesulide: con riferimento ai provvedimenti di sospensione della
commercializzazione dei farmaci a base di Nimesulide, adottati dall’Agenzia del
Farmaco Irlandese, l’AIFA ha diffuso un articolo di approfondimento sul profilo di
sicurezza di detti farmaci. I dati nazionali confermano per la Nimesulide un profilo di
maggiore epatotossicità, rispetto agli altri antinfiammatori, anche se si tratta di
reazioni molto rare.
- Magnevist® (acido gadopentetico, sale dimegluminico): viene confermato, come
già segnalato per i mezzi di contrasto a base di gadolinio, il potenziale rischio di
insorgenza di Fibrosi Sistemica Nefrogenica (NSF) in pazienti con grave insufficienza
renale, sottoposti a somministrazione di Magnevist®, mezzo di contrasto per
Risonanza Magnetica.
- Piroxicam: l’EMEA ha raccomandato restrizioni sull’uso dei medicinali contenenti
Piroxicam a causa del rischio di effetti indesiderati gastrointestinali e gravi reazioni
cutanee.
- Ceftriaxone: è stato evidenziato che Ceftriaxone, (cefalosporina di terza
generazione) , somministrato per via endovenosa e in concomitanza con gluconato di
calcio, a causa del rischio di precipitazione di sali di calcio, può causare : gravi e
persino letali reazioni in neonati e prematuri oltre che litiasi renale e biliare, in modo
particolare in età infantile. E’ stato pertanto, modificato il Riassunto delle
Caratteristiche del Prodotto dei medicinali a base di Ceftriaxone, al fine di rafforzare le
speciali avvertenze e precauzioni d’uso.
- Farmaci soggetti a monitoraggio intensivo: si trasmette l’ottavo
aggiornamento dei farmaci sottoposti a monitoraggio intensivo. L’elenco comprende
i farmaci di più recente commercializzazione per i quali è opportuno continuare a
raccogliere e valutare tutte le eventuali reazioni avverse che potrebbero verificarsi
nelle reali condizioni d’uso, considerato che la sperimentazione clinica, che dovrebbe
fornire indicazioni sulla loro sicurezza d’uso, presenta limiti legati al ridotto numero
dei pazienti trattati, alla loro selezione ed al limitato periodo di trattamento.
ADEMPIMENTI:
Nimesulide: non deve essere prescritta a pazienti con controindicazioni quali:
pregresse epatiti, storia di abuso di alcool, uso concomitante di farmaci epatotossici.
Magnevist®: gli aggiornamenti delle informazioni di sicurezza d’uso del prodotto
prevedono, fra l’altro, la rilevazione in tutti i pazienti e in particolare in quelli di età
superiore a 65 anni, di eventuali disfunzioni renali, attraverso la raccolta dell’anamnesi
e/o l’esecuzione di esami di laboratorio. Particolare attenzione deve anche essere
prestata in caso di somministrazione del prodotto in neonati e bambini fino ad 1 anno
di età, a causa di una funzionalità renale non ancora matura.
Piroxicam: la terapia con Piroxicam deve sempre essere iniziata da un medico con
esperienza nel trattamento dei pazienti con malattia reumatica infiammatoria o
degenerativa. Il trattamento deve essere effettuato alla più bassa dose (non più di 20
mg al giorno) e per la più breve durata possibile. In ogni caso il trattamento deve
essere rivisto dopo i primi 14 giorni di terapia.
Ceftriaxone: la somministrazione endovenosa di farmaci a base di Ceftriaxone è
controindicata nei prematuri e nati a termine iperbilirubinemici o che richiedono una
supplementazione di calcio; inoltre in generale, i medicinali a base di Ceftriaxone non
devono essere miscelati con soluzioni contenenti calcio.
Farmaci soggetti a monitoraggio intensivo: per i farmaci soggetti a monitoraggio
intensivo e per tutti i vaccini, devono essere segnalate, oltre alle sospette reazioni
avverse gravi e inattese, anche le reazioni non gravi e/o già note.
Medici, Farmacisti e gli altri operatori sanitari devono inviare le segnalazioni al
Responsabile di Farmacovigilanza della Struttura Sanitaria di appartenenza che, per
l’ASL di Bergamo è: Dr.ssa Laura Spoldi – Via Borgo Palazzo 130, Bergamo – tel.
035/2270304, fax: 035/270035.
E’ consigliabile la consultazione dei seguenti documenti:
- Resoconto semestrale sulla segnalazione spontanea - Anno 2006 - a cura del GIF –
pubblicato a maggio 2007
- Articolo di approfondimento sul profilo di sicurezza dei farmaci a base di Nimesulide,
a cura dell’AIFA;
- Nota informativa importante - AIFA ed EMEA - relativa a Magnevist® e Fibrosi
Sistemica Nefrogenica;
- Comunicato stampa dell’EMEA del giugno 2007, sulla sicurezza d’uso dei farmaci a
base di Piroxicam;
- Nota informativa importante – AIFA – sulle incompatibilità chimico-ficiche di
Ceftriaxone con soluzioni o prodotti contenenti calcio;
- Aggiornamento n. 8 - Giugno 2007 – Farmaci sottoposti a monitoraggio intensivo
IL DIRETTORE DEL DIPARTIMENTO CURE PRIMARIE E CONTINUITA’
ASSISTENZIALE:
Dr.ssa Laura Perego
RESPONSABILE DEL PROCEDIMENTO: Dr.ssa Laura Spoldi tel 035.2270304
Per informazioni rivolgersi a:
FARMACISTA DELEGATA PER LA FARMACOVIGILANZA: Dr.ssa Maria Pia Orsi tel
035.2270763