Trasformazione isotermica (T = costante)
TRASFORMAZIONE ISOTERMICA
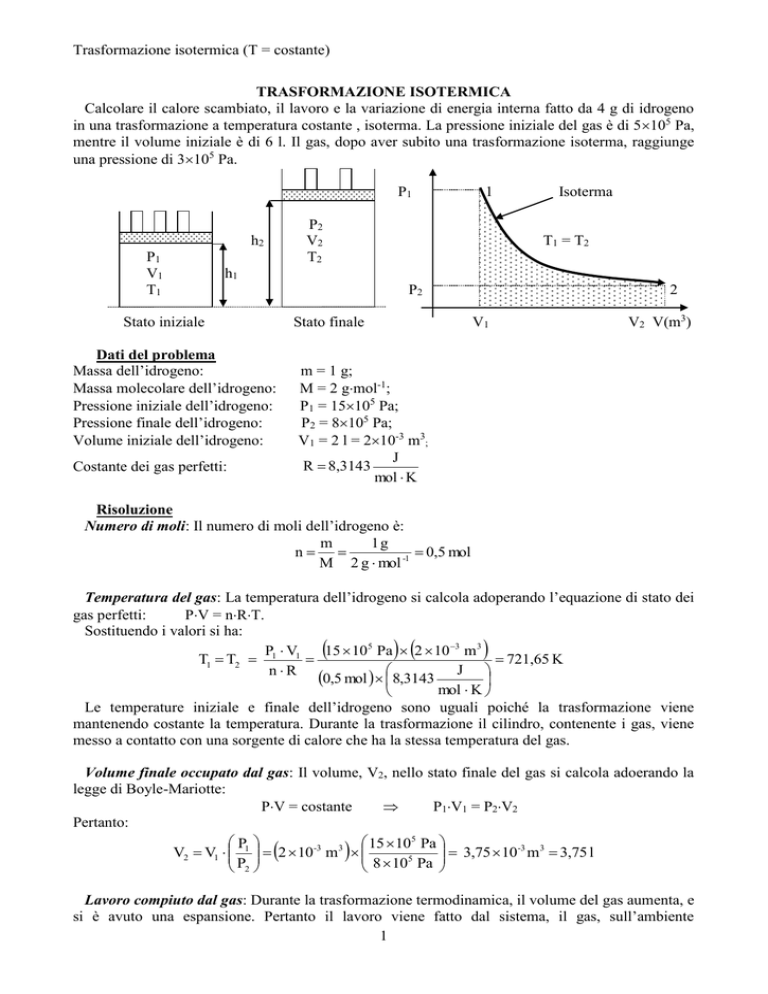
Calcolare il calore scambiato, il lavoro e la variazione di energia interna fatto da 4 g di idrogeno
in una trasformazione a temperatura costante , isoterma. La pressione iniziale del gas è di 5105 Pa,
mentre il volume iniziale è di 6 l. Il gas, dopo aver subito una trasformazione isoterma, raggiunge
una pressione di 3105 Pa.
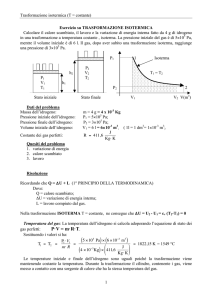
P1
P2
V2
T2
h2
P1
V1
T1
1
Isoterma
T1 = T2
h1
P2
Stato iniziale
Stato finale
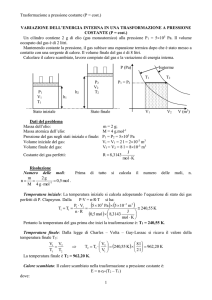
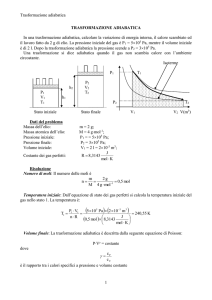
Dati del problema
Massa dell’idrogeno:
Massa molecolare dell’idrogeno:
Pressione iniziale dell’idrogeno:
Pressione finale dell’idrogeno:
Volume iniziale dell’idrogeno:
Costante dei gas perfetti:
2
V1
V2 V(m3)
m = 1 g;
M = 2 gmol-1;
P1 = 15105 Pa;
P2 = 8105 Pa;
V1 = 2 l = 210-3 m3;
J
R 8,3143
mol K
Risoluzione
Numero di moli: Il numero di moli dell’idrogeno è:
m
1g
n
0,5 mol
M 2 g mol -1
Temperatura del gas: La temperatura dell’idrogeno si calcola adoperando l’equazione di stato dei
gas perfetti:
PV = nRT.
Sostituendo i valori si ha:
P V
15 105 Pa 2 10 3 m 3
T1 T2 1 1
721,65 K
J
nR
0,5 mol 8,3143
mol K
Le temperature iniziale e finale dell’idrogeno sono uguali poiché la trasformazione viene
mantenendo costante la temperatura. Durante la trasformazione il cilindro, contenente i gas, viene
messo a contatto con una sorgente di calore che ha la stessa temperatura del gas.
Volume finale occupato dal gas: Il volume, V2, nello stato finale del gas si calcola adoerando la
legge di Boyle-Mariotte:
PV = costante
P1V1 = P2V2
Pertanto:
P
15 105 Pa
3,75 10-3 m3 3,75 l
V2 V1 1 2 10-3 m3
5
P
8
10
Pa
2
Lavoro compiuto dal gas: Durante la trasformazione termodinamica, il volume del gas aumenta, e
si è avuto una espansione. Pertanto il lavoro viene fatto dal sistema, il gas, sull’ambiente
1
Trasformazione isotermica (T = costante)
circostante, innalzamento del pistone. Il valore del lavoro compiuto dal gas nel passare adllo stato 1
allo stato 2 è:
V
P
L12 n R T1 ln 2 n R T1 ln 1
V1
P2
15 105 Pa
J
1885,826 J
L12 0,5 mol 8,3143
721,65K ln
5
mol K
8 10 Pa
La parte tratteggiata sotto la curva, che indica la isoterma, rappresenta il lavoro compiuto.
Calore scambiato: Il calore scambiato fra il gas e la sorgente di calore viene calcolato adoperando
il primo principio della termodinamica. Tale principio rappresenta il principio di conservazione
dell’energia e si scrive:
E = U + L
Dove:
E = calore scambiato;
U = variazione di energia interna;
L = lavoro compiuto dal gas.
In una trasformazione isoterma l’energia interna non cambia (U = 0), pertanto si ha:
E=L
quindi
E12 = L12 = + 1885,826 J
Il calore scambiato è positivo, ciò significa che la sorgente di calore cede energia al gas che si sta
espandendo a temperatura costante.
Da quest’ultima affermazione si può sottolineare come il calore e la temperatura siano due
concetti diversi tra di loro e di come non ci sia sempre una corrispondenza automatica tra
assorbimento di calore ed innalzamento della temperatura.
2