CORSO DI
CARDIOCHIRURGIA
SCIENZE INFERMIERISTICHE
SCUOLA INFERMIERI
OSPEDALE S. CAMILLO - ROMA
DOCENTE: GIUSEPPE ANGELICA
CARDIOCHIRURGO OSPEDALE SAN CAMILLO –
ROMA
E-mail: [email protected]
Anno accademico 2016-2017
CENNI DI
ANATOMIA
CARDIACA
La struttura e l’organizzazione
del cuore
VIA DI ACCESSO IN
CARDIOCHIRURGIA
STERNOTOMIA MEDIANA
SINTESI STERNALE
TORACOTOMIA
ANTERO-LATERALE
TORACOTOMIA
POSTERO-LATERALE
ACCESSI MINIINVASIVI
Cardiochirurgia
mini-invasiva
Vantaggi
• Minore dolore nel post-operatorio
• Ridotta degenza in terapia intensiva
ed ospedaliera
• Recupero post-operatorio più rapido
Beneficio paziente
Costi ridotti
Chirurgia totalmente endoscopica
Vantaggi
Invasività minima
Minimo dolore nel postoperatorio
Rischio ridotto di complicanze di ferita
Mantenimento dell’integrità del torace
Recupero più rapido
Eccellente risultato estetico
PRINCIPI GENERALI DELLA
CIRCOLAZIONE
EXTRACORPOREA (C.E.C.) E
PROTEZIONE MIOCARDICA
Giuseppe Angelica
La circolazione extra-corporea è una
tecnica che consente la temporanea
sostituzione del cuore e dei polmoni
con una macchina che ne sostituisce le
funzioni permettendo di isolare il cuore
dalla circolazione e quindi consentire
di eseguire gli interventi “a cuore
aperto” con le camere cardiache
esangui.
PRINCIPI GENERALI DELLA CIRCOLAZIONE
EXTRACORPOREA (CEC) O BYPASS
CARDIOPOLMONARE (1)
L’UTILIZZO DELLA CIRCOLAZIONE EXTRACORPOREA
IN CARDIOCHIRURGIA, E’ MIRATO A SOSTITUIRE LA
NORMALE CIRCOLAZIONE DEL SANGUE ( CUORE) E
LO SCAMBIO DEI GAS (POLMONI), CON LA
MACCHINA “CUORE – POLMONI ”
PRINCIPI GENERALI ( 2 )
LA MAGGIOR PARTE DEGLI INTERVENTI DI
CARDIOCHIRURGIA, VENGONO ESEGUITI IN
CIRCOLAZIONE EXTRACORPOREA ( CEC ),
CON L’AIUTO DI ALTRE TECNICHE AGGIUNTIVE:
Ipotermia
Arresto di circolo
Bypass parziale
cardioplegia
Nella circolazione extra-corporea, o
macchina cuore-polmone, il sangue venoso
viene prelevato dalle vene cave o
direttamente dall’atrio destro, passa in un
dispositivo chiamato ossigenatore, in cui il
sangue venoso viene ossigenato mediante
l’esposizione ad un flusso di ossigeno, e
viene quindi pompato nel sistema arterioso
del paziente
Nella circolazione extra-corporea, o
macchina cuore-polmone, il sangue venoso
viene prelevato dalle vene cave o
direttamente dall’atrio destro, passa in un
dispositivo chiamato ossigenatore, in cui il
sangue venoso viene ossigenato mediante
l’esposizione ad un flusso di ossigeno, e
viene quindi pompato nel sistema arterioso
del paziente
Il circuito viene completato con uno
scambiatore di calore, e con pompe che
aspirano il sangue refluo dal campo
operatorio. Vi è inoltre un sistema di
perfusione del miocardio per mantenere
vitale il cuore durante il periodo
dell’intervento, durante il quale non viene
perfuso fisiologicamente con sangue
ossigenato attraverso le arterie coronarie
CENNI STORICI DELLA CIRCOLAZIONE
EXTRACORPOREA
1812 LE GALLIOS, perfuse il cervello di coniglio
attraverso le arterie carotidi.
1934 GIBBON, disegnò una pompa atraumatica, che
modificò nel 1937.
1951 DENNIS, effettuò la CEC in una bimba di 6 anni
affetta da CAV.
1953 GIBBON, utilizzò la CEC nella correzione di un
DIA.
1954 SENNING, asportò un mixoma atriale sinistro
in CEC.
ELOLUZIONE
Negli anni le macchine “cuore – polmone”,
hanno subito una continua evoluzione di
ricerca, tali da renderli sempre più affidabili e
maneggevoli, avvalendosi anche dell’utilizzo
di nuovi dispositivi.
PROBLEMATICHE DELLA
CIRCOLAZIONE EXTRACORPOREA
Sebbene le nuove apparecchiature sono molto
affibabili, la conduzione della Circolazione
extracorporea è complessa, perchè deve tenere
conto di molti fattori:
Interazione perfusione artificiale-paziente
Controllo dei flussi nei vari distretti vascolari (
cervello-rene-fegato)
Interazione fra conduzione della CEC e tecniche
anestesiologiche
Metabolismo dei farmaci alle diverse temperature
ELEMENTI PRINCIPALI DI UNA MACCHINA
PER LA CIRCOLAZIONE EXTRACORPOREA
Pompe
Scambiatore di calore
Ossigenatore
Cardiotomo ( raccoglie e filtra il sangue proveniente
dal campo operatorio )
Linea di ritorno venoso
Linea di reinfusione arteriosa
Vent ( linea particolare usata per la decompressione
del ventricolo sinistro ).
Filtro arterioso
MODIFICAZIONE DI ALCUNI PARAMETRI
FISIOLOGICI DURANTE LA CEC
(1)
Il sague scorre in condotti artificiali che non
corrispondono ai requisiti fisiologici dei
condotti del corpo umano e di conseguenza
subisce:
alterazioni con attivazione di componeneti micro e
macro-molecolari.
È necessario sommisnistare a dosaggi calcolati
EPARINA per impedire la coagulazione del sangue.
(2)
Il contatto aria-sangue, all’interno
dell’ossigenatore, non perfettamente
fisiologico come i polmoni, determina:
a.
b.
c.
d.
e.
Denaturazione proteica.
Liberazione di diversi polipeptidi
Distruzione di piastrine e fattori della
coagulazione.
Danno alla membrana cellulare con emolisi
Deficienza del sistema immnitario
LA PROTEZIONE
MIOCARDICA IN
CARDIOCHIRURGIA
Giuseppe Angelica
DEFINIZIONE
Con il termine di “protezione miocardica “ ,
in cardiochirurgia, si intende il
prolungamento del periodo di tolleranza di
tutto il miocardio all’ischemia totale per
prevenire le complicanze post-operatorie
dopo interventi chirurgici a cuore aperto,
quali:
1.
2.
Sindrome da bassa gittata.
Aritmie.
DANNO MIOCARDICO DURANTE LA
CIRCOLAZIONE EXTRACORPOREA
(CEC)
1. DA ISCHEMIA
EDEMA intracellulare
Depressione della
funzionalità cardiaca
Necrosi cellulare
Contrattura ischemica
(processo reversibile)
DA RIPERFUSIONE
1. Edema interstiziale
2. Stone
Heart(irreversibile):
dovuto all’ingresso
massivo di calcio nel
citoplasma attraverso il
sarcolemma e
mancanza di ATP con
liberazione di
catecolamine endogene.
CARDIOPLEGIA
“finalità e composiszione”
Le finalità della cardioplegia
farmacologica, è di eliminare le
conseguenze dell’ischemia,
producendo un idoneo “ambiente”, nel
quale vengono ridotte le richieste
energetiche del miocardio e
contemporaneamente viene prodotta
energia, per soddisfare le esigenze
richieste.
OBIETTIVI DELLA
CARDIOPLEGIA
1. Arrestare il cuore senza danni
2. Creare un “ambiente” in cui continua
la produzione di energia
3. Contrastare gli effetti deleteri
dell’ischemia
TRATTAMENTO CHIRURGICO
DELLA CARDIOPATIA
ISCHEMICA
CARDIOPATIA ISCHEMICA
E’ il risultato di un insufficiente apporto di
sangue arterioso al muscolo cardiaco in
rapporto al suo fabbisogno di ossigeno e di
sostanze nutritive da parte del miocardio.
Tale condizione può manifestarsi:
Dolore
anginoso
IMA con insufficienza VS
Alterazioni dell’ECG e mataboliche.
Arresto cardiaco
DEFINIZIONE
Si tratta di una condizione in cui si verifica una
discrepanza tra il consumo e l’apporto di ossigeno al
miocardio che può avvenire in presenza di un aumento
della richiesta miocardica di ossigeno o di una riduzione
del flusso coronarico
CONDIZIONI CHE
AUMENTANO IL CONSUMO DI
OSSIGENO
CONDIZIONI CHE RIDUCONO
L’APPORTO DI OSSIGENO
ESERCIZIO
SPASMO CORONARICO
STRESS
RESTRINGIMENTO
CORONARICO
Il consumo miocardico di ossigeno
(mvo2)
Il cuore è un organo aerobio, dunque il fabbisogno
miocardico di O2 fornisce un indice accurato del suo
metabolismo.
I principali determinanti del consumo miocardico di
ossigeno sono:
• Frequenza cardiaca
• Contrattilità
• Stress parietale
Stress o tensione di parete di una cavità,
o postcarico, è dipendente da 2 fattori:
• Pressione sviluppata al suo interno
• Raggio medio della cavità
L’ischemia miocardica è il
risultato dello squilibrio tra
domanda di O2 da parte del
tessuto miocardico ed offerta
dello stesso attraverso il circolo
coronarico.
DOMANDA
DI O2
OFFERTA
DI O2
Fisiopatologia
Due sono i fattori che intervengono nella
genesi dell’ischemia miocardica:
La riduzione del flusso coronarico
L’aumento del consumo miocardico di
ossigeno (MVO2)
Fattori di rischio (1)
Rischi biologici:
• ipertensione
arteriosa
• obesità
• diabete mellito
• ipercolesterolemia
Stile di vita
• esercizio
fisico
• dieta
• fumo
• condizioni socio-economiche
a
Quadri clinici della cardiopatia ischemica
Sindromi coronariche stabili:
angina da sforzo
angina a riposo
angina mista
Sindromi coronariche acute (instabili):
angina instabile
infarto intramurale (non Q)
infarto transmurale (Q)
angina variante (vasospastica) di Prinzmetal
CENNI di ANATOMIA
Le coronarie sono le arterie che
vascolarizzano il cuore. Originano dai
seni di Valsalva (bulbo aortico),
decorrono nell’epicardio per
approfondirsi nel miocardio.
Sono arterie terminali.
Nella quasi totalità dei casi sono due
(destra e sinistra) e, con i loro rami
collaterali, ricoprono il fabbisogno di O2
di tutte le strutture cardiache
Il “restringimento” coronarico può essere
causato da
Placche aterosclerotiche
Trombosi
Embolia
Spasmo muscolare
il grado di ostruzione varia dalla
lieve stenosi senza implicazione
emodinamica, e quindi senza
ischemia miocardica, alla completa
ostruzione del lume vasale con
necrosi del tessuto a valle
FISIOPATOLOGIA
apporto di O2 al miocardio, o comunque il suo
mancato aumento con l’aumento del suo
fabbisogno (sforzo fisico o stress emotivo)
ISCHEMIA LESIONE NECROSI
del miocardio nella porzione vascolarizzata dal ramo
coronarico coinvolto
ANGINA
STABILE
Da sforzo fisico o stress
emotivo (mancato aumento
dell’apporto con
l’aumentato fabbisogno)
INSTABILE
Diminuito apporto senza
relazione con l’aumento del
fabbisogno
• A riposo
• Ingravescente
• Di recente comparsa
• Post-infartuale
• Ischemia silente
quando l’ischemia miocardica causa la
necrosi dei miociti, clinicamente si ha un
INFARTO MIOCARDICO ACUTO
Angor prolungato non responsivo alla
terapia con vasodilatatori s.l. spesso
acompagnato ad un senso di morte
imminente
DIAGNOSI
l’unico esame che permette una
valutazione delle lesioni coronariche è la
CORONAROGRAFIA
esame fondamentale per eseguire la
rivascolarizzazione
LA RIVASCOLARIZZAZIONE
MIOCARDICA
è la terapia di scelta nella patologia coronarica
con ischemia miocardica refrattaria alla
terapia medica e, quando possibile, deve
essere attuata prima che si instauri una
necrosi della cellula miocardica
RIVASCOLARIZZAZIONE
MIOCARDICA
MEDIANTE PTCA
MEDIANTE
INTERVENTO
CHIRURGICO
Non esistono
CONTROINDICAZIONI
ASSOLUTE alla PTCA, ovvero
tutte le lesioni coronariche
potrebbero essere sottoposte alla
procedura anche se con rischio
diverso
RIVASCOLARIZZAZIONE MIOCARDICA
CHIRURGICA
BYPASS
AORTO-CORONARICO
con l’obiettivo di normalizzare il flusso ematico nelle
zone in cui la coronaropatia l’ha ridotto
“pontando” l’ostruzione
INDICAZIONI
al trattamento chirurgico
Angina instabile
Stenosi significativa del TC o lesioni
equivalenti
Malattia tri- o plurivasale
PTCA fallita, complicata o comunque non
indicata
Sulla base della valutazione
coronarografica si considerano a
indicazione chirurgica le coronaropatie
mono o plurivasali non suscettibili di
angioplastica in cui le lesioni coronariche
siano CRITICHE ovvero di RILEVANZA
EMODINAMICA ( superiori al 60-70%)
OBIETTIVI
del trattamento chirurgico
Miglioramento della sintomatologia
Riduzione del rischio di eventi
infartuali futuri
Miglioramento della aspettativa di
vita a lungo termine
Tecnicamente consiste
nell’interposizione di un “graft” tra
l’aorta e la coronaria a valle della
stenosi.
Ovviamente questa porzione di vaso
dovrà essere privo di lesioni
emodinamicamente significative
TECNICA CHIRURGICA
la via di accesso di scelta per la chirurgia
coronarica è la
STERNOTOMIA MEDIANA
con l’apertura e la sospensione del sacco
pericardico si ha una perfetta
esposizione del cuore che può essere
raggiunto con estrema comodità
L’intervento di rivascolarizzazione miocardica
mediante bypass aorto-coronarico si può
eseguire:
con l’ausilio della
Circolazione
ExtraCorporea
(in C.E.C.)
senza l’ausilio della
Circolazione
ExtraCorporea
(off-pump)
a cuore battente
Off-pump
• Arteriotomia e confezionamento di anastomosi
distali a cuore battente
• Inserimento di shunt intracoronarici per
assicurare la continuità di flusso ematico e per
mantenere un campo esangue
• Campo operatorio poco stabile (utilizzo di
stabilizzatori) e possibilità di instabilità
emodinamica durante la procedura
• Evita i danni conseguenti la CEC
è indicata pertanto in pazienti con anatomia e parete
coronarica favorevoli e, comunque, in tutti i pazienti in
cui è controindicata la CEC (IRC, patologia carotidea…)
TIPI di GRAFT
Non sono utilizzabili vasi artificiali per l’esiguo
calibro delle coronarie.
Si usano pertanto vasi nativi del paziente
GRAFT VENOSI
GRAFT ARTERIOSI
GRAFT VENOSI
Sono rappresentati nella grande maggioranza dei
casi dalla
VENA SAFENA INTERNA
che decorre sulla superficie mediale dell’arto
inferiore dal malleolo mediale al traingolo dello
Scarpa.
Viene esposta, isolata, prelevata e lavata in
soluzione fisiologica e utilizzata in senso “inverso” a
causa della presenza al suo interno di valvole
antireflusso
GRAFT ARTERIOSI
Sono rappresentati nella maggioranza dei casi
dalla
ARTERIA MAMMARIA INTERNA
destra e/o sinistra, dall’ARTERIA RADIALE
e, più raramente dall’ARTERIA
GASTROEPIPLOICA
L’ Arteria Mammaria Interna (AMI) origina
dall’arteria succlavia, decorre ai lati dello
sterno (emettendo rami collaterali
intercostali) e termina sfioccandosi in rami
che confluiscono nell’arteria epigastrica
superficiale
Viene isolata e prelevata, dopo legatura dei
rami collaterali, viene sezionato il suo capo
distale mentre si mantiene l’intergrità
anatomica del suo capo prossimale
ARTERIA MAMMARIA INTERNA (preparazione)
AMI rappresenta il condotto "ideale"
per:
•
•
•
•
•
sede anatomica
struttura istologica (parete a
predominanza elastica)
calibro
lunghezza
flusso
ARTERIA RADIALE
Ha una parete molto spessa e ricca in cellule
muscolari (facilmente va incontro a vasospasmo)
Necessita pertanto di trattamento
farmacologico con Ca-antagonisti per attenuare
la contrazione delle cellule muscolari.
Il suo prelievo va eseguito con accurata
dissezione dei piani muscolari dell’avambraccio
Presenta ottimi risultati a breve medio termine
Il suo prelievo non ha importanti ripercussioni
su avambraccio e mano
Fondamentale testare la funzionalità
dell’arteria ulnare
ARTERIA GASTROEPIPLOICA
Costituisce una branca del tronco celiaco e
decorre sulla grande curvatura gastrica.
Il suo isolamento richiede una accurata
emostasi.
I risultati a breve-medio termine sono buoni
e non si è presentato alcun problema
gastrico (vascolare)
Richiede una laparatomia
Spesso presenta vasospasmo e/o piccolo
calibro
CONFRONTO TRA GRAFT ARTERIOSO
E GRAFT VENOSO
GRAFT VENOSO
GRAFT ARTERIOSO
rispetto alla coronaria
• Non adatto a flusso
arterioso pulsatile, quindi
suscettibile a degenerazione
parietale
• Utilizzabile per tutti i vasi
coronarici
• Percentuale di pervietà a 10
aa 50-60%
di calibro ( 2 mm ca.)
• Non va incontro a processi di
degenerazione parietale
• Percentuale di pervietà a 10
aa 90%
• Non può essere utilizzato per
tutti i vasi coronarici
(lunghezza limitata)
• Sproporzione di calibro
• Graft ideale per proporzione
La rivascolarizzazione viene ottenuta
anastomizzando il condotto selezionato
sulla coronaria patologica, a valle della
stenosi critica; l’apporto di sangue viene
garantito ponendo in continuità l’altro
capo del condotto con la aorta
ascendente (continuità già presente
all’estremo prossimale della AMI, che si
origina dalla arteria succlavia e che può
essere lasciata in situ)
ricordiamo che
Nel caso di condotti venosi e dell’
arteria radiale si dovrà procedere poi al
confezionamento anche di una
anastomosi prossimale sull’aorta
ascendente
Nel caso dell’ arteria mammaria interna
e della arteria gastroepiploica ciò non è
necessario in quanto viene mantenuta
l’integrità anatomica della sua origine
Approccio convenzionale
• Sternotomia mediana
(incisione 30 cm circa)
• Circolazione extracorporea
• Protezione miocardica
VARIABILI GENERALI CHE POSSONO
INFLUENZARE IL RISCHIO CHIRURGICO
A) gravità delle lesioni e grado di ischemia
prima del by-pass
B) anatomia dei vasi coronarici(entità del
processo aterosclerotico)
C) funzionalità del VS
D) condizioni generali del paziente:
età
sesso
malattie concomitanti
Condotti venosi
Occlusione precoce
8 – 12% dopo 1 settimana
12 – 20% dopo 1 anno
Occlusione a distanza
25 – 30% dopo 5 anni
40 – 50% dopo 10 anni
LA PATOLOGIA
DELL’AORTA
TORACICA
PATOLOGIA DELL’AORTA TORACICA
ANEURISMI DELL’AORTA TORACICA
DISSEZIONE DELL’AORTA TORACICA
*ACUTA
*CRONICA
tipo A
tipo B
Definizione di aneurisma
• Dilatazione permanente e
localizzata di un’arteria con un
aumento del diametro trasverso di
oltre il 50% rispetto al diametro
normale previsto (si può fare
riferimento al segmento
direttamente a monte del tratto
dilatato)
Aneurismi dell’aorta
Aorta addominale
75%
Aorta toraco-addominale
5%
Aorta toracica ascendente
Arco aortico
Aorta toracica
discendente
20%
ANEURISMA TORACICO
DILATAZIONE DELL’AORTA TORACICA
CHE PUO’ INTERESSARE:
AORTA ASCENDENTE
ARCO AORTICO
AORTA DISCENDENTE (compreso il tratto
addominale)
NB diametro > 5cm indicazione a terapia chirurgica in
particolare per l’aorta ascendente
EZIOLOGIA
Aterosclerosi
Disordini del tess.connettivo o necrosi cistica della
media (S. di Marfan,S. di Ehlers-Danlos)
Malattie infiammatorie (granulomatosi,arterite a
cellule giganti,arterite di Takayasu)
Sifilide
Dissezione aortica
Trauma aortico
Infezioni
Gravidanza
SINTOMI
40% ASINTOMATICI
SINTOMI più comuni:
-dolore toracico/dorsale
-disfonia
-disfagia
-tosse,dispnea
-angina
-pletora e edema
-ictus,ischemie delle
estremità,infarti renali,
ischemia mesenterica
TRATTAMENTO
FARMACOLOGICO
BETA-BLOCCANTI
CHIRURGICO
sostituzione con PROTESI SINTETICHE
Uso di ENDOPROTESI
Indication for operation
–Symptoms
–5.0-6.0 cm size in Ascending
Aorta
–5.5-6.0 size cm in Aortic Arch
–5.0-6.0 cm size in Descending
Aorta
–Marfans >5.0-5.5cm
–Growth > 1 cm per year
ESAMI CLINICO-STRUMENTALI
CARATTERISTICA DEL DOLORE
TORACICO(presente della dissezione)
ANGIO-TAC
ECO TRANSTORACICO O
TRANSESOFAGEO
RMN
TRATTAMENTO CHIRURGICO (1)
LA TECNICA CHIRURGICA E’ DIFFERENTE SE E’
INTERESSATA:
AORTA ASCENDENTE E/O LA VALVOLA AORTICA
ARCO AORTICO
AORTA DISCENDENTE
AORTA TORACO-ADDOMINALE
TRATTAMENTO CHIRURGICO (2)
CEC
STERNOTOMIA MEDIANA (se
interessata l’ao/asc e l’arco
TORACOTOMIA LAT SN ( se interessata
l’ao/disc)
IPOTERMIA PROFONDA
CANNULAZIONE ART. FEM. O
ASCELLARE
COMPLICANZE
Danno
cerebrale
Paresi e Paraplegia
Disfunzione e Insufficienza
renale
Disfunzione polmonare
Reintervento
CAUSE DI MORTE
PRECOCI
-Infarto
miocardico
-Scompenso
cardiaco
-Emorragia
-Disfunzione
neurologica
TARDIVE
-Scompenso
cardiaco
-Rottura di un
nuovo
aneurisma
-Insufficienza
renale
-insufficienza
DISSEZIONE AORTICA
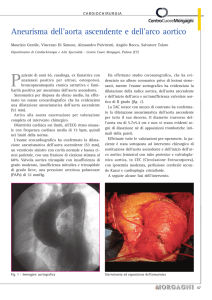
DISSEZIONE ACUTA DELL’AORTA
TORACICA
LA LACERAZIONE PRIMARIA INTERESSA L’INTIMA DELLA
PARETE AORTICA. VIENE CLASSIFICATA IN
DISSEZIONE TIPO A
DISSEZIONE TIPO B
ANEURISMA VERO
Dilatazione localizzata patologica
permanente del lume arterioso con
alterata struttura parietale che
interessa tutte le tre tonache della
parete vascolare
(a differenza dell’ECTASIA in cui la
parete arteriosa dilatata è normale)
DISSEZIONE
Dilatazione localizzata della parete
arteriosa con formazione di
“falso lume”
(EMATOMA INTRAMURALE)
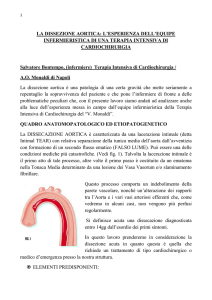
DISSEZIONE ACUTA DELL’AORTA
E’ un evento “catastrofico” relativamente
frequente.
Il termine EMATOMA DISSECANTE descrive
l’affezione più propriamente di quello
comunemente usato di ANEURISMA
DISSECANTE.
Attualmente si parla più comunemente di
DISSECAZIONE o DISSEZIONE AORTICA
CAUSA
IMPROVVISA LACERAZIONE INTIMALE
La lacerazione intimale apre la strada a una
colonna di sangue spinto dalla forza della
pressione arteriosa nello spessore della parete
con:
DISTRUZIONE DELLA TONACA MEDIA
SCOLLAMENTO TRA INTIMA ED
AVVENTIZIA
DISTRUZIONE DELLA TONACA MEDIA
+
SCOLLAMENTO TRA INTIMA ED
AVVENTIZIA
Formazione di un falso lume
(occupa in genere 1/2 o 2/3 della circonferenza;
più raramente l’intera circonferenza)
EVOLUZIONE DEL FALSO LUME
• può estendersi in senso prossimale o distale
• può aprirsi in una cavità contigua (rottura in
pericardio, in pleura, in peritoneo
• può aprirsi verso il lume vero (“rientro”: cioè il falso
lume si ricollega distalmente con il vero lume
• può parzialmente trombizzarsi (raramente)
• anche se non si verifica rottura del falso lume si può
avere uno stravaso ematico con formazione di
ematoma mediastinico o pericardico
In pochi secondi la dissezione della media e la
formazione del falso lume possono interessare i vari
collaterali dell’aorta:
• arteria anonima
• arteria carotide sinistra
• arteria succlavia sinistra
• arteria renali
• arterie mesenteriche
che possono essere
A) OCCLUSE DALLA DISSEZIONE
B) IN COMUNICAZIONE CON IL FALSO LUME
C) IN COMUNICAZIONE CON IL LUME VERO
MECCANISMI PROPOSTI PER SPIEGARE
L’INIZIO DELLA DISSEZIONE
A
Primo evento: lacerazione dell’intima
Sangue che entra nella media
Distruzione della media
Scollamento tra intima e
avventizia
MECCANISMI PROPOSTI PER SPIEGARE
L’INIZIO DELLA DISSEZIONE
B
Primo evento: emorragia nella media
Rottura dell’intima soprastante
Distruzione della media
Scollamento tra intima e
avventizia
EZIOPATOGENESI
Se è vero che la rottura intimale
rappresenta la causa iniziale della
dissezione, è altrettanto vero che la
base patologica per lo sviluppo di
una dissezione è rappresentato
dalla:
DEGENERAZIONE DELLA
TONACA MEDIA
DEGENERAZIONE DELLA TONACA MEDIA
Degenerazione del collagene
Degenerazione del tessuto elastico
Formazione di cisti
=
MEDIONECROSI CISTICA
Un certo grado di medionecrosi
cistica si può considerare parte
del processo di senescenza
dell’aorta
La MEDIONECROSI CISTICA è nella
maggior parte dei casi il risultato di
una
azione traumatizzante cronica
contro la parete aortica
Ipertensione arteriosa di lunga data
Altre situazioni in cui si ha
MEDIONECROSI CISTICA
difetti ereditari del tessuto
connettivo
Sindrome di Marfan
Sindrome di
Frequente, dal 20% al 40% dei
Ehler-Danlos
pazienti con S. di Marfan
sviluppano una dissezione
ALTRE CAUSE DI DISSEZIONE AORTICA
• Aterosclerosi
Perforazione della placca
ateromatosa intimale
• Coartazione aortica
Per l’ipertensione arteriosa nel
distretto brachio-cefalico
• Valvola aortica bicuspide
Frequente associazione
con dissezione aortica
acuta
possibile elevata incidenza di anomalie
della parete nei pazienti con valvola
aortica bicuspide
RIBADIAMO
CLASSIFICAZIONE
Quasi tutti gli schemi di classificazione
della dissezione aortica si basano sul
fatto che nel 95% dei casi l’origine
della dissezione è a livello dell’aorta
ascendente o discendente
CLASSIFICAZIONE
di Stanford
Tipo A
90%
la dissezione interessa
aorta ascendente e/o arco
(tipo 1 e 2 di De Bakey)
Tipo B
10%
la dissezione interessa
aorta discendente con o
senza estensione distale
(tipo 3 di De bakey)
QUADRO CLINICO DELLA
DISSEZIONE AORTICA ACUTA
Epidemiologia:
colpisce più frequentemente gli uomini
(rapporto M/F 2/1) con incidenza massima tra i
50 e i 70 anni
1) Esordio improvviso con dolore toracico violento, lacerante,
continuo, migrante (precordiale, cervicale, interscapolare).
Il dolore è più intenso all’esordio che successivamente
(diagnosi differenziale con IMA). Talora il dolore è l’unico
sintomo.
2) Al dolore può far seguito la morte improvvisa per rottura del falso
lume in pleura, pericardio, peritoneo.
3) Shock:
ipovolemico per emorragia interna
per tamponamento cardiaco
per IAo acuta (35% - 60% dei casi)
QUADRO CLINICO DELLA
DISSEZIONE AORTICA ACUTA
4) Sintomi correlati alla compromissione dei collaterali dell’aorta:
- segni di ischemia cerebrale (stroke nel 10% dei casi)
- segni di ischemia midollare (paraplegia nel 2% - 5%)
- segni di ischemia renale (oligo-anuria)
- segni di ischemia agli arti (solitamente arto inferiore
sinistro)
- segni di ischemia viscerale
DIAGNOSI CLINICA
Esame obiettivo del paziente
• Anomalie dei polsi
- assenti
- iposfigmici
(assenza per compressione del
lume o estensione della
dissezione)
• Insufficienza valvolare aortica
• Segni neurologici
- turbe della coscienza
- neuropatie periferiche
- paraparesi
DIAGNOSI STRUMENTALE
• Rx torace
- slargamento del mediastino
• ECG
- ipertrofia ventricolare sinistra con assenza in
genere di segni di ischemia (dd con
IMA)
• Ecocardiografia
- transtoracica
- transesofagea (TEE)
indagine non invasiva utile soprattutto
per valutare la presenza di “flap”
intimali, la funzione del ventricolo
sinistro, la continenza della valvola
aortica.
• Angio TAC
DIAGNOSI STRUMENTALE
• Angio TAC
• RNM
• Aortografia - metodo convenzionale in pazienti con
sospetto di dissezione aortica acuta, soprattutto
in previsione di intervento. Permette di
visualizzare il falso lume e l’origine delle
grandi arterie collaterali dell’aorta. Inoltre
consente una valutazione delle arterie
coronarie.
- oggi molte scuole privilegiano le altre diagnostiche
(TEE, TAC) meno invasive, ritenendole meno
rischiose e altrettanto affidabili.
EVOLUZIONE
Mortalità precoce più elevata nel tipo A
Possibilità di cronicizzazione nel tipo B
TERAPIA MEDICA
Si basa sull’utilizzo di farmaci anti-ipertensivi per
evitare la progressione della dissezione; i valori
pressori vengono mantenuti intorno a 100-120
mm/Hg di PA sistolica.
I farmaci utinlizzati sono:
• Nitroprussiato di sodio
• Nifedipina
• Beta-Bloccanti
TERAPIA MEDICA
Il trattamento medico è indicato:
• Dissezioni tipo B (o tipo 3) non complicate
• Dissezioni croniche cioè dissezioni non
complicate che si presentano due settimane o
più dopo l’insorgenza
TERAPIA CHIRURGICA
TIPO A (1 - 2)
URGENZA/EMERGENZA
TIPO B (3)
POSSIBILE
CRONICIZZAZIONE
TERAPIA CHIRURGICA
L’intervento consiste nella sostituzione del tratto di
aorta interessato dalla dissezione con eventuale
reimpianto dei tronchi sopra aortici (in caso di
interessamento dell’arco) e correzione della
eventuale insufficienza valvolare aortica.