RIPASSO
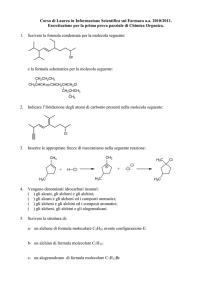
Chimica
organica
Gruppi Funzionali Contenenti Legami Multipli CarbonioCarbonio
Gruppo
Funzionale
Nome
Esempio
Nome IUPAC
Nome
Comune
Alchene
H2C=CH2
Etene
Etilene
Alchino
HC@CH
Etino
Acetilene
Arene
C6H6
Benzene
Gruppi Funzionali Contenenti un Atomo Elettronegativo Legato al
Carbonio con un Legame Singolo
Gruppo
Funzionale
Nome
Esempio
Nome IUPAC
Nome Comune
Alogenuro
H3C-I
Iodometano
Ioduro di metile
Alcol
CH3CH2OH
Etanolo
Alcol Etilico
Etere
CH3CH2OCH2CH3
Dietil etere
Etere
Ammina
H3C-NH2
Amminometano
Metilammina
Nitro Composto
H3C-NO2
Nitrometano
Tiolo
H3C-SH
Metantiolo
Solfuro
H3C-S-CH3
Dimetil solfuro
Metil mercaptano
Gruppo
Funzionale
Nome
Esempio
Nome IUPAC
Nome Comune
H3C-CN
Etanonitrile
Acetonitrile
Nitrile
Aldeide
H3CCHO
Etanale
Aldeide acetica
Acido carbossilico
H3CCOCH3
Propanone
Acetone
Estere
H3CCO2H
Acido Etanoico
Acido acetico
Cloruro acilico
H3CCO2CH2CH3
Etil etanoato
Acetato di etile
Ammide
H3CCOCl
Etanoil cloruro
Cloruro di acetile
H3CCON(CH3)2
N,NDimetiletanammide
N,N-Dimetilacetammide
(H3CCO)2O
Anidride Etanoica
Anidride acetica
Chetone
Anidride acilica
Alcani lineari
Gli alcani noti anche come idrocarburi
saturi sono molecole organiche
costituite solo da carbonio e idrogeno
con esclusivamente legami singoli.
•Formula molecolare CnH2n + 2
•Ibridazione sp3 del carbonio
•E’ una serie omologa
Nomenclatura alcani lineari
I nomi degli alcani semplici non ramificati sono costituiti da una radice
che indica il numero di carboni che costituisce la catena e dalla
desinenza ano (definita anche suffisso) che indica la classe di
appartenenza. La tabella seguente riporta i nomi degli alcani lineari
semplici.
Radicali alchilici
Rimuovendo un idrogeno da una catena alchilica si ottiene un radicale
alchilico.
Il nome di un radicale alchilico si ottiene sostituendo il suffisso ano dell’alcano
corrispondente con il suffisso ile.
Il nome dei radicali alchilici è molto importante per la nomenclatura degli alcani
ramificati.
Nomenclatura d’uso di sostituenti ramificati
Per sostituenti ramificati costituiti da una catena principale a 2, 3, 4 e 5 atomi di
carbonio è possibile utilizzare nomi d’uso.
I principali nomi d’uso che possono essere usati nella nomenclatura IUPAC sono
riportati nell’immagine a lato e ricordano le unità strutturali iso e neo oppure il tipo
di carbonio sostituito (sec per secondario e tert per terziario).
Isomeri di struttura
Esistono 2 possibili strutture che possiamo scrivere per un alcano a
4 C (formula molecolare C4H10): una struttura lineare e una
ramificata.
Butano e isobutano sono isomeri di struttura.
Per un alcano di formula C5H12 possiamo scrivere 3 possibili
strutture. Ancora una volta una lineare, il pentano, e due ramificate.
Cicloalcani
Ciclopropano
Molecola piana. Forte tensione angolare degli atomi ibridati sp3
(60°)
Ciclobutano
Molecola non piana. Forte tensione angolare, angolo di legame 88°.
Ciclopentano
Molecola non piana. Angolo di legame 105°. Più stabile perché
l’angolo di legame si avvicina a quella dell’ibrido sp3. Presenti
stereoisomeri configurazionali (cis-trans) se vi sono sostituenti
alchilici.
Cicloesano
Molecola non piana. Gli H sono legati ai C mediante legami
equatoriali (sul piano dei C) o assiali (sopra o sotto il piano dei C).
Gli isomeri assumono 2 conformazioni “a sedia” per rotazione degli
H che da assiali diventano equatoriali e vice versa. I sostituenti
voluminosi vengono legati preferenzialmente in posizione
equatoriale a causa della repulsione sterica con gli altri H assiali.
Conformazione meno stabile è “a barca”, sempre a causa
dell’ingombro sterico degli H.
Alcheni
Ogni atomo di C che forma un doppio legame è detto trigonale, in quanto
legato a 3 atomi e non a 4.
La rotazione attorno al doppio legame è impedita.
Gli atomi di C del doppio legame e gli H ad essi legati si trovano sullo
stesso piano. L’angolo di legame del C trigonale è di 120°. Il legame è più
corto (1,34 Å vs 1.54 Å).
Solo 3 dei 4 orbitali del C vengono ibridati a formare ibridi sp2 che
giacciono su un piano a formare un triangolo equilatero. Il quarto
elettrone si trova su un orbitale non ibridato (sp2 perché è 1 orbitale s e
2 orbitali p) perpendicolare al piano dei tre orbitali ibridi.
Il doppio legame è dato dal legame σ tra due orbitali ibridati ed un
legame π dell’orbitale non ibridato. Questo spiega perché il doppio legame
non può ruotare.
Addizione di acidi
Gli acidi alogenidrici (H-X) attaccano gli
alcheni fornendo un alogeno alcano (alogenuro
alchilico)
H
H
H
H3C C CH2 + H Cl
H3C C CH2
C C
H+
Cl
H
H
+
C C
C C
Cl-
Cl
Le reazioni di addizione elettrofila avvengono
in posizione trans
12
Regola di Markovnikov
Nell’addizione di elettrofili asimmetrici agli
alcheni:
Si forma sempre l’isomero che deriva dal catione
intermedio più stabile, cioè quello più sostituito
In pratica l’anione si lega al carbonio più
sostituito
Anche l’alchene deve essere asimmetrico
H3C H
CH3
C C+
H3C
CH3
H3C
CH3
C C
H3C
CH3
H3C
C+
H3C
CH3
C
H CH3
13
Addizione di acqua (meccanismo)
L’acqua non è un elettrofilo sufficientemente
forte da attaccare il doppio legame in tempi brevi
(anzi è un nucleofilo)
È necessario utilizzare un catalizzatore acido
(H+)
CH3
H
H
H3C C C CH3 H3C C C CH3
H CH3
H+
1a fase: attacco del protone
al doppietto
+
2a fase: formazione del
carbocatione più stabile
(terziario)
H
H
O
H +
H3C C C CH3
H CH3
3a fase: entra il nucleofilo
14
Benzene e composti aromatici
Il rapporto tra C e H del C6H6 fa pensare ad una struttura altamente
insatura. Se confrontata all’esano (C6H14) ed al cicloesano (C6H12).
Il benzene, però, non si comporta come un composto insaturo (non
decolora le soluzioni di bromo come gli alcheni e gli alchini e non viene
facilmente ossidato dal permanganato di potassio, né subisce le reazioni
di addizione degli alcheni ed alchini. Al contrario dà soprattutto reazioni
di sostituzione analogamente agli alcani.
A differenza del cicloesano la struttura del benzene è piana e gli atomi di
C sono ibridati sp2, quindi due di questi obitali sono impegnati a fare un
legame con i C adiacenti ed il terzo a fare un legame con H.
L’orbitale p non ibridato di ciascun C è perpendicolare al piano dei
carboni; gli orbitali p si sovrappongono lateralmente a formare orbitali
che danno origine ad una nuvola elettronica al di sopra ed al di sotto del
piano dell’anello benzenico.
STEREOCHIMICA
ISOMERI DI STRUTTURA
Sono composti che hanno la stessa formula molecolare,
ma diversa formula di struttura
Gli atomi sono legati tra loro in successione differente
STEREOISOMERI
sono composti che hanno la stessa formula
molecolare,
gli atomi sono reciprocamente legati nello stesso
ordine (o sequenza)
gli atomi sono disposti in maniera
diversa nello spazio
cioè hanno configurazioni
disposizioni spaziali diverse)
diverse (cioè
CICLOESANO:
conformazione a sedia e a barca
STEREOISOMERI
Se sono interconvertibili per rotazione intorno ad un
legame allora sono detti
ROTAMERI o CONFORMERI
Se sono interconvertibili solo per rottura e
riformazione dei legami allora sono detti
ISOMERI CONFIGURAZIONALI
ISOMERIA GEOMETRICA (CIS-TRANS)
è un fenomeno proprio
di alcuni cicloalcani,
delle molecole
organiche contenenti
due atomi
asimmetricamente
sostituiti e legati tra
loro con un doppio
legame.
ENANTIOMERI
Si definiscono enantiomeri due molecole
che hanno la stessa formula molecolare,
in cui gli atomi sono reciprocamente legati nello stesso
ordine
formano una coppia di immagini speculari non
sovrapponibili
GLI ENANTIOMERI
Differiscono per il fatto che
Hanno diversa reattività verso altri composti
“otticamente attivi”
un enantiomero fa ruotare a destra il piano della luce
polarizzata, mentre l’altro lo fa ruotare a sinistra
Dato un particolare enantiomero, come posso indicare
in modo univoco la sua configurazione e il suo nome?
Si ricorre alle regole di Cahn-Ingold-Prelog (CIP o
convenzione R-S) che permettono di descrivere la
configurazione di uno stereocentro definendola
rispettivamente
R (dal latino rectus, quindi destrorsa) o
S (dal latino sinister, quindi sinistrorsa)
in base all’ordine con cui i differenti sostituenti sono disposti
intorno allo stereocentro.
Regole di Cahn-Ingold-Prelog (convenzione R-S)
Stabilire l’ordine di priorità dei
quattro gruppi legati al centro
stereogeno
Guardare il centro stereogeno
dalla parte opposta a quella in cui
c’è il gruppo a priorità minore
Collegare i tre gruppi rimasti con
una freccia che va dal gruppo a
priorità maggiore a quello a
priorità minore
Freccia con senso orario la
configurazione è R
Freccia con senso antiorario la
configurazione è S
(R)-nome
(S)-nome
DIASTEREOISOMERI
Si definiscono diastereoisomeri i composti che sono
stereoisomeri, ma non sono enantiomeri, in quanto non sono
l’uno l’immagine speculare dell’altro
Sono sostanze chimiche completamente diverse tra di loro:
cioè hanno proprietà chimiche e fisiche diverse
Tra i 4 possibili stereoisomeri del 3-Bromo-2-butanolo quanti
diastereoisomeri si avranno?
1)
2)
3)
4)
1) e 3) sono diastereoisomeri
1) e 4) sono diastereoisomeri
2) e 3) sono diastereoisomeri
2) e 4) sono diastereoisomeri