TRATTAMENTO DEI TUMORI
T1 DEL TRATTO SUPERIORE:
AMPULLOMA VATERIANO
Prof. Paolo
Pederzoli
NEOPLASIE
DELLA REGIONE
CEFALOPANCREATICA
NEOPLASIE
DEL COLEDOCO TERMINALE
NEOPLASIE
DELLA PAPILLA DI VATER
NEOPLASIE
DELLA TESTA DEL PANCREAS
Ampulloma vateriano
Neoplasie della papilla di Vater che
derivano istologicamente dalla mucosa
dell’ampolla papillare e dalla mucosa
del tratto intra-duodenale della via
biliare principale o del tratto intraduodenale del dotto pancreatico
principale
Ampulloma vateriano
Epidemiologia
V-VIII decade
Maggiore interessamento del sesso maschile
0,04 - 0,2% riscontri autoptici
10 – 36% delle neoplasie pancreaticoduodenali
Fino al 50% delle neoplasie periampollari
Esperienza chirurgica 1990 – 2006
1010 duodenocefalopancreasectomie
Neoplasie papilla di Vater 17%
Altre cause 83%
Esperienza globale: 171 pazienti
1990 – 2006
(158 pazienti resecati)
Adenoma con displasia lieve/moderata (n=8)
Carcinoma in situ (n=21)
Carcinoma infiltrante (n=142)
129 interventi resettivi
7 interventi palliativi
6 pazienti non operati (M+)
Casistica personale: 171 pazienti
1990 – 2006
Ittero ostruttivo (65%)
Calo ponderale (40%)
Dolore addominale aspecifico (25%)
Astenia/anoressia (25%)
Vomito (7%)
Sanguinamento gastrointestinale (<5%)
Casistica personale: 171 pazienti
1990 – 2006
ATTENZIONE !
Sintomi spesso aspecifici per lungo tempo
Incremento degli indici di colestasi (fosfatasi
alcalina) come unico reperto
Associazione con litiasi colecisto-coledocica
Reperto occasionale alla EGDS
15% delle neoplasie maligne
Fino al 60% degli adenomi a displasia lieve
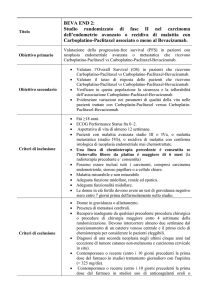
Diagnosi e staging
ECO addome ± mdc
TAC addome con mdc
EGDS e biopsia della papilla
EUS
Tecnica molto accurata per la valutazione
del T
Carcinoma ampollare
EGDS ± biopsia
Limiti:
Biopsie solo di “superficie”
Aspetto macroscopicamente
normale se la neoplasia è intraampollare
Impossibilità ad asportare
interamente la lesione (vs colon)
Accuratezza diagnostica 40-60%
Diagnosi e staging
Ecoendoscopia
Permette
Tecnica
di identificare la lesione
molto accurata per la
valutazione del T (estensione
della lesione)
Tumore ampollare – T1
Ecoendoscopia
Tumore ampollare – T4
Ecoendoscopia
Classificazione Istopatologica
T1
pT
T2
TNM 2002
neoplasia limitata alla papilla
o allo sfintere di Oddi
infiltrazione
del duodeno
T4
T3
infiltrazione
del pancreas
infiltrazione del tessuto adiposo,
di altri organi o strutture
Carcinoma ampollare
Il “problema” dell’ N
Inadeguato staging preoperatorio nel “predire” lo
status linfonodale
Quali sono le stazioni linfonodali sede di
metastasi?
Relazione T/N: i tumori T1 sono sempre N0 ?
La coperta rimane corta!
pN
ln piccola curva
ln grande curva
ln pilorici
ln dotto biliare
comune
ln pancreatico
-duodenali post.
ln mesenterici
ln margine
superiore testa
ln margine
superiore corpo
ln ilo
splenico
ln margine
inferiore corpo
ln pancreatico
-duodenali ant.
ln margine
inferiore testa
ln mesentere
intestinale
ln colon
DRENAGGIO
LINFATICO
Tumori T1 & N status
Roggin KK et al - Ann Surg Oncol 2005; 12: 971-980
“Limitations of ampullectomy in the treatment of
nonfamilial ampullary neoplasms”
• 99 DCP per neoplasie dell’ampolla di Vater (2% benigne)
• 12 pazienti con neoplasia T1
• 42% dei pazienti con neoplasia T1 presentavano
metastasi linfonodali (20% interessamento linfonodi VMS)
• Dato confermato da altre serie (Talamini et al, Monson et al, Yoon
et al) con T1N+ nel 10 – 50% dei casi
Adenoma ampollare
Rischio di degenerazione
Evidenza istopatologica di
microfocolai di carcinoma
nell’ambito di adenomi
Diversi gradi di displasia nella
stessa lesione
Pazienti con adenoma più
giovani (media 57 vs 62 anni)
Cosa fare ??
Secondo noi...
Adenoma con displasia lieve
EGDS - EUS ogni 3-6 mesi
Adenoma con displasia moderata
Ampullectomia
Carcinoma in situ
Carcinoma invasivo
Resezione
• Chirurgica (?)
• Endoscopica
Valutazione istologica
Duodenocefalopancreasectomia
+ linfoadenectomia
• Displasia grave
• Carcinoma
• Displasia lieve
• Displasia
moderata
Ampullectomia
Indicazioni “storiche”: adenoma, carcinoma in situ,
carcinoma invasivo T1
Morbidità e mortalità < DCP
Complicanze: pancreatite acuta severa, perforazione
e fistola duodenale
Adeguata ricostruzione della giunzione
biliopancreatica e valutazione dei margini
Successo legato all’esperienza del chirurgo
Beger et al. Arch Surg 1999;134:526-532
Rattner et al. Arch Surg 1996;131:366-371
Ampullectomia: limiti
Tumori T1: “sottostima” del fattore N
Procedura tecnicamente impegnativa
Elevata % di recidive nei carcinomi (fino al 75%)
Ampullectomia nel 2007, quando?
Adenomi
Età anagrafica / età biologica
Presenza di comorbidità maggiori
Roggin et al, Ann Surg Oncol 2005; 12:971-980
Yoon et al, Ann Surg 2005; 242: 92-100
Duodenocefalopancreasectomia
Trattamento chirurgico radicale
Mortalità < 2% nei centri di riferimento
Incidenza elevata di fistola pancreatica nelle
neoplasie papillari ( pancreas “soft” )
Importanza dell’estensione della resezione a
sinistra con linfadenectomia mesenterica e
ampia exeresi della lamina posteriore
L’area di rischio!
NO!
SI!
Margini di resezione
trancia
via biliare
trancia
pancreatica
Metastasi
Linfonodale
margine
retroperitoneale
Neoplasia
della papilla
negativo
Endoprotesi biliare
Frequentemente utilizzata preoperatoriamente
Si associa a fenomeni di pericoledocite
Aumenta il rischio di complicanze chirurgiche
Rende più difficile la valutazione intraoperatoria
del margine di resezione biliare
Da posizionare dopo essere giunti a una
diagnosi istologica di neoplasia della papilla
L’ittero è da drenare prima dell’intervento?
La “pericoledocite”
Il ruolo della linfoadenectomia
Lo status linfonodale come fattore prognostico:
N+ versus N0
N° di linfonodi asportati (> 16 linfonodi)
Biologia del tumore differente
dell’adenocarcinoma duttale del pancreas
Necessità di una linfoadenectomia sistematica
delle stazioni linfonodali locoregionali
Sakata et al, EJSO 2007; 33: 346-351
Yoon et al, Ann Surg 2005; 242: 92-100
Sakata et al, World J Surg 2006; 30: 985-991
Casistica personale: 129 carcinomi papillari
1990 – 2006
Sopravvivenza a 5 anni: 57%
Carcinoma ampollare: sopravvivenza
T1 – T2
P < 0.05
T3 – T4
Sopravvivenza a 5 anni tumori T1 - T2: 69%
Sopravvivenza a 5 anni tumori T3 - T4: 45%
Conclusioni
Prediligere la demolizione radicale anche nel
tumore T1
Importanza della linfoadenectomia anche a
distanza (stazione mesenterica)
Chirurgia su un pancreas “difficile”
Importanza della centralizzazione e
dell’esperienza del chirurgo