VADEMECUM PER LE SPERIMENTAZIONI NO PROFIT
E DOCUMENTAZIONE PER LA RICHIESTA DI VALUTAZIONE DI UNA SPERIMENTAZIONE
CLINICA NO PROFIT
Studi “no-profit” ex DM 17 dicembre 2004
TIPOLOGIE
Sperimentazioni finalizzate non a interesse privato o a fini di lucro, ma per interesse pubblico
Sperimentazioni connotabili come rilevanti per il miglioramento della pratica clinica e, come
tali, parte integrante dell’assistenza sanitaria
Sperimentazioni finalizzate non al medicinale in quanto tale o al suo sviluppo ma alle strategie
terapeutiche:
1. definire il miglior regime terapeutico (rischio/beneficio) di farmaci approvati
2. migliorare l’uso terapeutico dei farmaci, stabilendo migliori protocolli terapeutici, individuando
associazioni o usi sequenziali di farmaci o di farmaci più altri interventi – chirurgia,
radioterapia – più efficaci
Sperimentazioni rilevanti per la salute pubblica, con obiettivi:
1. di evidente beneficio per i pazienti e/o per il rapporto
2. costo/efficacia del sistema sanitario
3. in grado di fornire opportunità aggiuntive alle prospettive
4. terapeutiche e di salute ai pazienti
5. in grado di ottimizzare la qualità delle prestazioni assistenziali
Sperimentazioni in cui l’obiettivo di reale miglioramento della pratica clinica sia garantito da:
1. la rilevanza del protocollo
2. la particolarità della patologia
3. la tipologia del trattamento
***
Promotore della Sperimentazione1:
Una persona, società, istituzione oppure un organismo che si assume la responsabilità di avviare,
gestire e/o finanziare una sperimentazione clinica.
Per gli studi no-profit:
Il promotore non deve essere il proprietario del brevetto del farmaco in sperimentazione o il titolare
dell’autorizzazione all’immissione in commercio e che non abbia cointeressenze di tipo economico con
l’azienda produttrice del farmaco.
Il Promotore-sperimentatore riveste il ruolo delle seguenti figure2:
1
Decreto Ministeriale 17 dicembre 2004
Art. 1 Comma 2. …a) che il promotore … sia struttura o ente … non a fine di lucro; b) che il promotore non sia il
proprietario del brevetto del farmaco … e che non abbia cointeressenze di tipo economico; c) che la proprietà dei dati …
appartengano al promotore …; d) che la sperimentazione non sia finalizzata allo sviluppo industriale del farmaco … o a fini
di lucro; e) che sia finalizzata al miglioramento della pratica clinica. Art. 3 1. Nei casi di sperimentazioni multicentriche
…deve essere individuato …. un unico promotore, come referente e responsabile per i compiti di farmacovigilanza e di
comunicazione di inizio, termine, interruzione della sperimentazione … nonché per la presentazione della richiesta del
parere unico del comitato etico….
1
• Clinical Project Manager
• Clinical Monitor
• Site Manager
• Safety Review Committee
• External Lab Liaison
• Site Manager
• Safety Officer
• Database Designer
• Clinical Database Programmer
• Clinical Database Administrator
• Data Manager
• Data Entry Technicians
• Medical Coder
• Medical Writer
• SAS Programmer
Nella fase di “Pre” studio, il Promotore-Sperimentatore deve:
1. reclutare personale qualificato nella misura necessaria, durante tutte le fasi della
sperimentazione3;
2. adottare e mantenere sistemi di assicurazione e di controllo della qualità4;
3. pensare agli aspetti amministrativi dello studio5;
4. pensare ad aspetti tecnici dello studio6.
2
Borelli, 2006
Reclutare personale qualificato nella misura necessaria, durante tutte le fasi della sperimentazione
Art. 4.1.1 all’allegato 1 del DM 15 luglio 1997
“Lo sperimentatore deve essere qualificato per istruzione, formazione ed esperienza ad assumersi la responsabilità di una
adeguata conduzione dello studio….” Art. 4.1.5 “lo sperimentatore deve tenere aggiornato un elenco delle persone
idoneamente qualificate alle quali abbia delegato compiti significativi relativi allo studio”.
4
Adottare e mantenere sistemi di assicurazione e di controllo della qualità
[Assicurazione e Controllo di Qualità] Il controllo di qualità deve essere effettuato durante ogni fase della gestione dati al
fine di garantire l’attendibilità e la corretta elaborazione degli stessi..(GCP 5.1.3 DM 15 luglio 1997). Deve essere garantita
la riservatezza dei documenti che potrebbero identificare i soggetti, rispettando le regole di riservatezza e confidenzialità
previste dalle disposizioni normative applicabili. (GCP 2.11 DM 15 luglio 1997).
5
Pensare agli aspetti amministrativi dello studio quali:
1. FONDI
a. per studi no-profit ex art. 1 D.M. del 17/12/04:
a. spese medicinali con AIC sono a carico del¨ S.S.N.
b. spese aggiuntive sono a carico del¨ fondo di ricerca ad hoc ovvero del fondo aziendale
c. no pagamento spese per i CE
b. per studi no-profit ex art. 6 (= non migliorativi della pratica clinica) sono necessari fondi ad hoc per:
o spese per medicinali
o spese aggiuntive
o pagamento spese per i CE
2. ASSICURAZIONE
3. FARMACOVIGILANZA
4. RAPPORTI CON IL COMITATO ETICO/ CASE FARMACEUTICHE/AIFA/OSSC
3
6
Pensare ad aspetti tecnici dello studio:
1. Definizione del protocollo clinico:
2
“Durante” lo studio, il Promotore-Sperimentatore deve:
1° controllare
“Ogni informazione relativa allo studio deve essere registrata, trattata e conservata in modo tale
da consentire un accurato resoconto, interpretazione e verifica”
“Lo studio deve essere condotto in conformità al protocollo approvato dal CE”
“Un consenso Informato deve essere ottenuto da ciascun soggetto prima della partecipazione
allo studio”
“I prodotti in sperimentazione devono essere preparati, gestiti e conservati secondo GMP ed
impiegati secondo il protocollo”
“Mantenere gli accordi fatti nella fase pre”
Inoltre, il Promotore-Sperimentatore deve:
ottenere il numero EudraCT;
inserire nell’OsSC i dati sulla sperimentazione e sui centri partecipanti;
stampare copia della Domanda di Autorizzazione alle Autorità Competenti ed ai Comitati Etici
(questo documento dovrà essere completato manualmente ed inviato ai centri per la richiesta di
autorizzazione unitamente al resto della documentazione).
In particolare7 deve:
inoltrare la richiesta di Parere Unico al Comitato Etico del centro coordinatore
inoltrare la richiesta di parere ai Comitati Etici satelliti
Nel “Post studio”, il Promotore-Sperimentatore deve comunicare:
la conclusione, sospensione ed interruzione dello studio sia per singolo centro che in toto;
i risultati dello studio.
a.Informazioni di carattere generale; b. Background scientifico; c. Obiettivo e finalità dello studio; d. Disegno dello studio;
e. Selezione dei pazienti; f. Schema terapeutico; g. Valutazione dell’obiettivo; h. Valutazione della sicurezza; i. Aspetti etici
e amministrativi; l. Piano di Monitoraggio; m. Piano di gestione dati; n. Piano statistico; o. Consenso informato ed
informativa; 2. Aspetti Finanziari/Accordi; 3. Approvazioni Etiche/Regolatorie/Amministrative; 4. Istruzioni per la gestione
dei pazienti; 5. Gestione farmaco (Certificati di analisi); 6. Sistemi elettronici: a. Gestione rapporti con i pazienti/medici
curanti; b. Screening dei pazienti (interesse/eleggibilità); c. Gestione rapporti con le strutture coinvolte; d. Gestione prelievi
e trasferimento campioni; e. Gestione dati dai laboratori/equipments; f. Registrazione dati/record; g. Gestione dei rapporti
con il monitor; h. Gestione dei documenti originali; i. Gestione farmaco/rapporti con la farmacia.
7
Decreto Legislativo n. 211 del 24 giugno 2003: Art. 22 – Apparato sanzionatorio. 5. Il promotore della sperimentazione
che inizia la sperimentazione clinica senza aver ottenuto il parere favorevole del comitato etico competente o in presenza di
obiezioni motivate da parte delle autorità competenti è soggetto alla sanzione amministrativa pecuniaria del pagamento della
somma da euro 100.000 a euro 500.000.
3
Modello A
INFORMAZIONI DI CARATTERE GENERALE
TITOLO DEL PROTOCOLLO:
NUMERO DI IDENTIFICAZIONE DEL PROTOCOLLO (se presente):
DATA DELLA VERSIONE DEL DOCUMENTO:
NOME, QUALIFICA
RESPONSABILE:
E
RECAPITO
DELLO
SPERIMENTATORE
–PROMOTORE
INFORMAZIONI DI BASE
Descrizione del prodotto in sperimentazione/ della sperimentazione biomedica:
a) descrizione dettagliata del prodotto sperimentale/ della sperimentazione biomedica:
b) fase di sviluppo del farmaco/ metodologia utilizzata nella sperimentazione biomedica:
c) riassunto dei risultati degli studi pre-clinici e clinici rilevanti (riferimenti alla letteratura e ai dati che
forniscono il razionale per la sperimentazione):
1. premesse teoriche:
2. bisogni conoscitivi che lo studio si propone di soddisfare:
3. per la sola Fase IV, indicare le nuove informazioni che lo studio potrà fornire in aggiunta alle
conoscenze già disponibili:
d) riassunto degli eventuali rischi e benefici conosciuti e potenziali per l’uomo:
1. benefici per il singolo:
2. benefici per la collettività
3. rapporto rischi/benefici
4
OBIETTIVI E FINALITA’ DELLO STUDIO
PROGETTAZIONE DELLO STUDIO
Disegno dello studio
(Specificare:
modalità di assegnazione al trattamento;
tipologia del controllo;
esiti primari e secondari;
selezione dei soggetti;
criteri di inclusione e di esclusione dei soggetti;
criteri per il ritiro dei soggetti;
trattamento dei soggetti)
VALUTAZIONE DELL’EFFICACIA (per i soli studi farmacologici)
Specificare i parametri di efficacia, nonché i metodi ed i tempi per l’accertamento, la registrazione e
l’analisi dei parametri di efficacia.
VALUTAZIONE DELLA SICUREZZA
Specificare i parametri della sicurezza, nonché i metodi e i tempi per l’accertamento, la registrazione e
l’analisi dei parametri di sicurezza.
Per gli studi biomedici in questa sezione vanno specificate le modalità utilizzate per assicurare la
sicurezza di gestione dei dati genetici secondo le indicazioni dell’Autorizzazione del Garante del
22/2/2007.
PIANO STATISTICO (per gli studi farmacologici)
Specificare se trattasi di studio di superiorità, di equivalenza o di non inferiorità.
Quindi, definire quale sia la differenza tra i trattamenti che abbia / non abbia significatività clinica in
termini di efficacia/tollerabilità.
PROCEDURE DI CONTROLLO E DI SICUREZZA DELLA QUALITA’ (se disponibili)
Specificare le procedure di controllo della qualità.
GESTIONE DEI DATI E CONSERVAZIONE DELLA DOCUMENTAZIONE
Specificare anche il nome del responsabile della gestione dei dati.
ACCORDI FINANZIARI E ASSICURAZIONI (se disponibili)
Vanno specificati eventuali accordi con Aziende Farmaceutiche e va allegato il modulo sul conflitto di
interesse secondo il DM 17 dicembre 2004.
5
Lo Sperimentatore-Promotore deve presentare un prospetto informativo sui costi della sperimentazione,
rifacendosi a quanto disposto in materia dalla Direzione Generale per eventuali accertamenti
strumentali da dover disporre ai fini della sperimentazione.
CRITERI DI PUBBLICAZIONE (se disponibili)
Si ricorda che le informazioni ottenute dallo studio devono essere pubblicate.
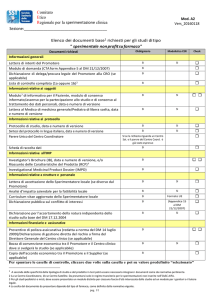
Al presente vanno allegati:
-lettera d’intenti dello Sperimentatore –Promotore;
-dossier sul farmaco (solo per gli studi farmacologici);
-informativa e modulo di consenso informato (se previsto dallo studio);
-informativa per il medico curante(se previsto dallo studio);
-curriculum vitae dello sperimentatore responsabile dello studio;
-scheda raccolta dati (se previsto dallo studio);
-dichiarazione sul conflitto d’interesse (se previsto dallo studio);
-eventuale lista dei centri afferenti allo studio (se previsto dallo studio).
-una lettera di presentazione a firma dello Sperimentatore Principale firmata e timbrata;
-una lettera a firma del Direttore del Dipartimento Assistenziale in cui in cui lo stesso dichiara di essere stato informato che verrà eseguita una Sperimentazione presso il suo Dipartimento firmata e
timbrata;
-una lettera a firma del Direttore del Dipartimento Universitario in cui in cui lo stesso dichiara di
essere stato informato che verrà eseguita una Sperimentazione presso il suo Dipartimento firmata e
timbrata;
-una lettera a firma del Direttore dell’U.O.C. firmata e timbrata in cui dovrà essere indicato quanto
in appresso:
“Il sottoscritto …………………… garantisce la disponibilità di adeguate risorse umane, strutturali
e strumentali per l’esecuzione del predetto protocollo, di cui ha una dettagliata conoscenza, ed è
disposto ad offrire la più ampia collaborazione per un’adeguata realizzazione della ricerca”.
6