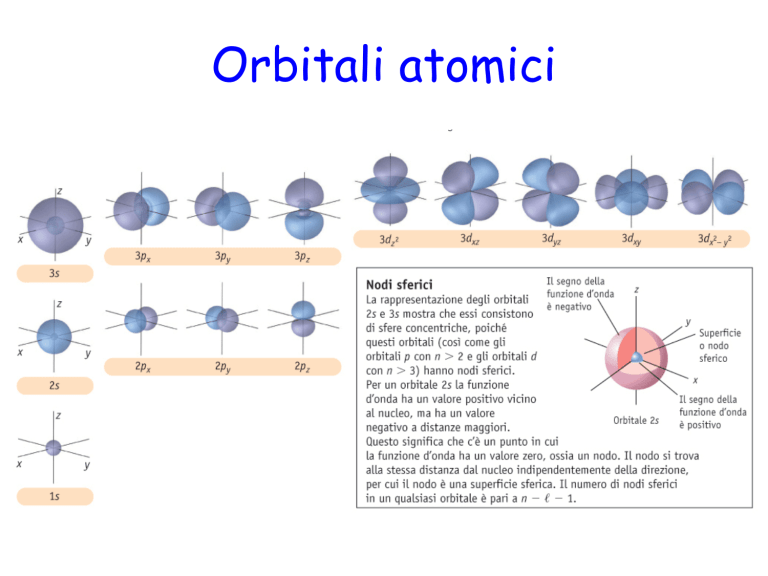
Orbitali atomici
Configurazione elettronica degli elementi con
numero atomico da 1 a 18
Il numero di elettroni
Consentiti per ciascun
livello energetico principale
è uguale a 2n2 dove n è il
numero quantico principale
n=1
2 elettroni
n=2
8 elettroni
n=3
18 elettroni
Il principio di AUFBAU
Aufbau: a ogni elettrone di un atomo si assegna un orbitale e si
costruisce la configurazione elettronica più stabile (a più bassa energia).
Si devono seguire alcune regole:
1. Un orbitale può contenere al massimo 2 elettroni, purchè abbiano spin
opposti (s = ± ½)
2. gli elettroni devono essere inseriti negli orbitali secondo un ordine di
energia crescente degli orbitali
3. tutti gli orbitali della stessa energia devono essere riempiti prima di
passare al riempimento degli orbitali ad energia maggiore.
4. quando si aggiungono elettroni in orbitali della stessa energia, prima di
accoppiare due elettroni in uno stesso orbitale, s’inserisce un elettrone
in ciascun orbitale, mantenendo gli spin paralleli (regola di Hund)
5. Non possono esistere in un atomo due elettroni con tutti e quattro i
numeri quantici uguali (principio di esclusione di Pauli)
Proprietà magnetiche degli atomi
• Se l’atomo ha elettroni spaiati con spin paralleli, possiede un
momento magnetico permanente proporzionale al numero di
elettroni spaiati. L’atomo viene attratto verso un campo
magnetico applicato dall’esterno. Tali atomi si dicono
paramagnetici (H, N, Na, O, Cr…)
• Se l’atomo ha tutti gli elettroni accoppiati con spin paralleli, ha
un comportamento opposto: non genera di per sé un campo
magnetico, ma la presenza di un campo magnetico esterno
induce un campo magnetico indotto che si oppone a quello
esterno. Tali atomi si dicono diamagnetici (He, Be…) e sono
quindi respinti da un campo magnetico applicato.
Schema a frecce diagonali
7s
7p
6s
6p
6d
5s
5p
5d
5f
4s
4p
4d
4f
3s
3p
3d
2s
2p
1s
Precessione degli orbitali
Ci sono delle inversioni della
successione degli orbitali
dovute alla alla forma complessa
degli orbitali
La Tavola periodica
Le proprietà periodiche e gli
elementi chimici
Tavola periodica di
Mendeleev
Mendeleev: Padre della Tavola
Come lavorò…
Mise gli elementi in righe
seguendo la massa
atomica crescente.
Mise gli elementi in
colonna in funzione di
come reagivano.
Problemi…
Lasciò delle caselle vuote
dicendo che esistevano
elementi non scoperti.
(Aveva ragione!)
Interruppe la sequenza di
masse crescenti per
mantenere elementi con
uguale reattività nella
stessa colonna [es.
Inversione di Te (MW
127,60) e I (MW126,90).
La forma attuale della tavola periodica
He
H
Li Be
B
C
N
O
F
Na Mg
Al Si
P
S
Cl Ar
gruppo
K Ca Sc Ti V
Ne
Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
periodo
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ra
Fr Ra Ac
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
• Periodi: Righe orizzontali - contengono elementi con numero atomico Z
progressivamente crescente
• Gruppi: Colonne verticali - contengono atomi con uguale configurazione
elettronica esterna e quindi stesso comportamento chimico
La forma attuale della tavola periodica
Ora gli elementi sono
messi in righe aumentando
il NUMERO ATOMICO Z !!
1-18
nuova
nomenclatura
IUPAC - 1985
I gruppi originariamente contenevano elementi con lo stesso comportamento
chimico ora contengono atomi con uguale configurazione elettronica esterna e
quindi stesso comportamento chimico
orbitali p
orbitali s
H
Li
orbitali d
Be
Na Mg
K
Ca Sc Ti
Rb Sr
Y
V
Cr Mn Fe Co Ni
He
B
C
N
O
F
Ne
Al Si
P
S
Cl
Ar
Cu Zn Ga Ge As Se Br Kr
Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi
I
Po At Ra
Fr Ra Ac
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa
orbitali f
Xe
U Np Pu Am Cm Bk Cf Es Fm Md No Lr
BLOCCO s: elementi dei primi due gruppi del sistema periodico;
gli elettroni riempiono gli orbitali s
BLOCCO p: elementi a destra della tavola periodica; gli
elettroni riempiono gli orbitali p
BLOCCO d: elementi di transizione della zona centrale della
tavola periodica; gli elettroni riempiono gli orbitali d
BLOCCO f: elementi di transizione interna formato da due serie
di 14 elementi elencati a parte nella tavola periodica e dalle
proprietà molto simili.
Gruppi… la Tavola periodica è
utile!!
• Gli elementi nello
stesso gruppo
hanno proprietà
chimiche e fisiche
simili!!
(Mendeleev aveva questo
scopo.)
Perchè??
• Hanno lo stesso
numero di elettroni
nell’ultimo livello
energetico.
• Formeranno lo stesso
numero di ioni.
• Le proprietà chimico fisiche degli
elementi sono determinate dal
numero di elettroni nell’ultimo livello
energetico!
Elementi che
appartengono
allo stesso gruppo
rappresentano una
“famiglia”
La tavola periodica degli elementi
7 file orizzontali (periodi) e 18 colonne verticali (gruppi)
Gruppo 1, con esclusione dell’H (Li, Na, K, Rb, Cs, Fr): metalli alcalini
Gruppo 2 (Be, Mg, Ca, Sr, Ba, Ra): metalli alcalino-terrosi
Gruppo 16 (O, S, Se, Te, Po): calcogeni
Gruppo 17 (F,Cl, Br, I, At): alogeni
Gruppo 18 (He, Ne, Ar, Kr, Xe, Rn): gas nobili (o rari)
Le famiglie di elementi
ELEMENTI RAPPRESENTATIVI: gruppi A, con i
sottolivelli s e p del livello esterno incompleti, cosiddetti
perché le loro proprietà sono rappresentative di quelle
di tutti gli altri elementi.
ELEMENTI DI TRANSIZIONE: gruppi B, tutti metalli con
i sottolivelli d incompleti.
ELEMENTI DI TRANSIZIONE INTERNA: Lantanoidi e
Attinoidi, differiscono solo per la configurazione interna
dei sottolivelli 4f e 5f rispettivamente.
I metalli sono caratterizzati da:
- basse energie di ionizzazione
- affinità elettroniche piccole o positive
- bassa elettronegatività
Come risultato tendono a perdere gli elettroni di valenza
formando cationi:
Na+
Ca2+
Al3+
I non-metalli sono caratterizzati da:
- elevate energie di ionizzazione
- affinità elettroniche negative e grandi
- elevata elettronegatività
Come risultato tendono ad acquistare elettroni formando anioni
monoatomici ed ossanioni:
Cl-
Br-
S2-
NO3-
SO42-
ClO4-
Sono esclusivamente metallici/non-metallici solo i gruppi
all’estrema sinistra/destra della tavola periodica.
I A
metalli alcalini
II A
metalli alcalino-terrosi
(VI A
VII A
O, S, Se; Te, Po)
alogeni
I gruppi IIIA-VA presentano elementi non-metallici all’inizio e
metallici alla fine.
Idrogeno
• L’idrogeno appartiene ad
una propria famiglia.
• Elemento più diffuso
nell’universo
• L’ idrogeno è diatomico
ed è molto reattivo.
• Forma composti con tutti
gli elementi della tavola
periodica
Metalli alcalini
Metalli alcalino
terrosi
• 1° colonna della tavola
periodica (1° Gruppo)
escluso l’idrogeno.
• Metalli molto reattivi,
sempre combinati con
elementi in natura (come
sali).
• Abbastanza morbidi da
essere tagliati con un
coltello
• Seconda colonna nella tavola
periodica. (2° Gruppo)
• Metalli reattivi, sono sempre
combinati con non metalli in
natura.
• Molti di questi elementi sono
importanti minerali nutrienti
(come Mg e Ca)
Metalli di Transizione
• Elementi dei gruppi 3-12
(IIIB-IIB)
• Meno reattivi dei metalli
dei primi gruppi
• Includono metalli usati in
gioielleria e costruzione.
• Alcuni sono essenziali
negli organismi viventi
Famiglia del Boro
• Elementi del gruppo
13° o IIIA
• Le caratteristiche
metalliche aumentano
dal Boro al Tallio
• Alluminio è un metallo
poco denso
Famiglia del Carbonio
• Elementi del gruppo 14°
o IVA
• Contiene elementi
importanti per la vita e i
computer.
• Il carbonio è la base di
una branca della chimica.
• Silicio e Germanio sono
importanti semiconduttori.
• Lo stagno e il piombo dei
sono metalli. Il piombo ha
una elevata densità
Famiglia dell’azoto
• Elementi del gruppo 15° o VA
• Azoto costituisce i ¾
dell’atmosfera.
• Azoto e fosforo sono entrambi
parte della chimica della vita.
• La maggior parte dell’azoto è
per lo più indisponibile per le
molecole biologiche.
Famiglia dell’Ossigeno
• Elementi del gruppo 16°
o VI A
• Ossigeno è necessario per
la respirazione.
• Molti composti della vita,
contengono zolfo (rosso
d’uovo, cipolle, i capelli
ecc.)
Alogeni
• Elementi del 17° gruppo
o VII A
• Molto reattivi, volatili,
diatomici, non metalli
• Sempre combinati con
altri elementi in natura.
• Usati come disinfettanti
e per rafforzare lo
smalto dei denti.
I Gas Nobili
• Elementi del 18° gruppo
o VIII A
• NON sono reattivi, gas
monoatomici
• Utlizzati nel luci al
“neon”
• Hanno un livello
energetico di valenza
pieno.
Configurazione elettronica e
periodicità
• Gli elementi che appartengono allo stesso gruppo nella
tavola periodica hanno la stessa configurazione
elettronica esterna
• A questa periodicità fa riscontro una periodicità nelle
proprietà fisiche e chimiche dei vari elementi (gli
elementi di uno stesso gruppo hanno proprietà simili)
• Quindi le proprietà degli elementi chimici dipendono
dagli elettroni più esterni (detti elettroni di valenza) e da
quanto questi sono legati al nucleo
Atomi polielettronici - effetto
schermante
• In un atomo polielettronico ogni elettrone è
sottoposto all’azione attrattiva del nucleo e a quella
repulsiva degli altri elettroni
• Tale effetto si traduce in un effetto schermante tra
nucleo ed elettrone considerato; è come se gli altri
elettroni diminuissero l’azione attrattiva della carica
nucleare e quindi come se l’elettrone considerato
sentisse una carica nucleare inferiore a quella reale
Proprietà periodiche
La carica nucleare effettiva cresce da
sinistra a destra lungo un periodo
• Gli elettroni di valenza sono legati in modo sempre più stretto
(l’energia degli orbitali diminuisce progressivamente)
• L’elettrone più esterno diventa sempre più difficile da asportare
• Gli atomi vanno incontro ad una contrazione
Il numero quantico principale cresce
scendendo lungo un gruppo
• La carica nucleare effettiva non varia apprezzabilmente
• Gli elettroni di valenza sono sempre più lontani dal nucleo, quindi
diventano via via più facilmente asportabili
• Gli atomi vanno incontro ad una espansione
Tavola periodica lato esterno
Tavola periodica lato interno
Proprietà fisiche e chimiche
Alcune proprietà degli elementi mostrano variazioni
graduali procedendo attraverso un periodo o gruppo
Conoscere queste tendenze permette di
comprendere le proprietà chimiche
Affinità elettronica
Energia di ionizzazione
Elettronegatività
Raggio atomico
Stato fisico, colore
Affinità elettronica
X + e-
X- (anione) + Eea (E emessa)
Affinità elettronica: è la quantità di energia rilasciata quando un
atomo neutro isolato in fase gassosa acquista un elettrone per
formare uno ione gassoso con una carica −1.
L’affinità elettronica è negativa (E<0). Questo significa che non
necessitano di energia per acquistare un elettrone; al contrario, la
rilasciano.
Gli atomi che propendono maggiormente all’acquisto di elettroni
hanno un’affinità più negativa.
Aumenta dal basso in alto in un gruppo
da sinistra a destra in un periodo.
L' Energia di ionizzazione (E.I.)
L’energia di ionizzazione (Ei) di un atomo rappresenta
l’energia necessaria per allontanare a distanza infinita dal
nucleo l’elettrone legato ad esso più debolmente. Si formerà
uno ione positivo:
X + Ei
Ei>0
X+ (catione) + e- (elettrone)
per convenzione
L’energia di II ionizzazione (Eii) è l’energia necessaria a
strappare un secondo elettrone. Eii > Ei
Aumenta dal basso in alto in un gruppo
da sinistra a destra in un periodo.
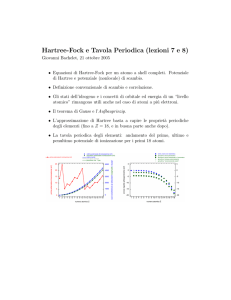
Andamento dell’energia di prima ionizzazione
Elettronegatività
• L’elettronegatività è la capacità degli atomi di
attrarre elettroni di legame.
• Questa proprietà permette di definire il tipo di
legame che l’elemento forma con un altro
elemento.
Aumenta dal basso in alto in un gruppo
da sinistra a destra in un periodo.
Scala di Pauling
E’ l’intrinseca tendenza di un atomo ad attrarre verso di sé
gli elettroni
Elettronegatività = Affinità elettronica + Energia di ionizzazione
2
0,7<E<4,0
L’elemento più elettronegativo della tavola periodica è il
Fluoro. Il suo valore di elettronegatività è 4,0
e l’elemento meno elettronegativo è della tavola periodica è
il Francio. Il suo valore di elettronegatività è 0,7
Perché gli atomi presentano quest’andamento
regolare nella variazione di queste proprietà?
Perchè l’andamento assume proprio quella
direzione?
• Perché gli atomi tendono ad acquisire o
perdere elettroni per raggiungere
configurazioni elettroniche stabili cioè con
livelli energetici pieni!
Raggio atomico
Le dimensioni di un atomo è
determinata dalla distanza
degli elettroni dal nucleo.
Questa grandezza viene
stimata assumendo che il
raggio di un atomo sia uguale
alla metà della distanza tra i
due nuclei adiacenti in un
solido.
Gli atomi diventano sempre
più grandi scendendo lungo le
colonne della tavola periodica.
Gli atomi diventano sempre
più piccoli muovendosi da
sinistra a destra lungo le righe
della tavola periodica
La variazione di alcune proprietà
Energia di ionizzazione
Elettronegatività
Raggio Atomico
Proprietà metalliche
Proprietà metalliche
Raggio Atomico
Elettronegatività
Energia di ionizzazione