CHIMICA, LEZIONE #3
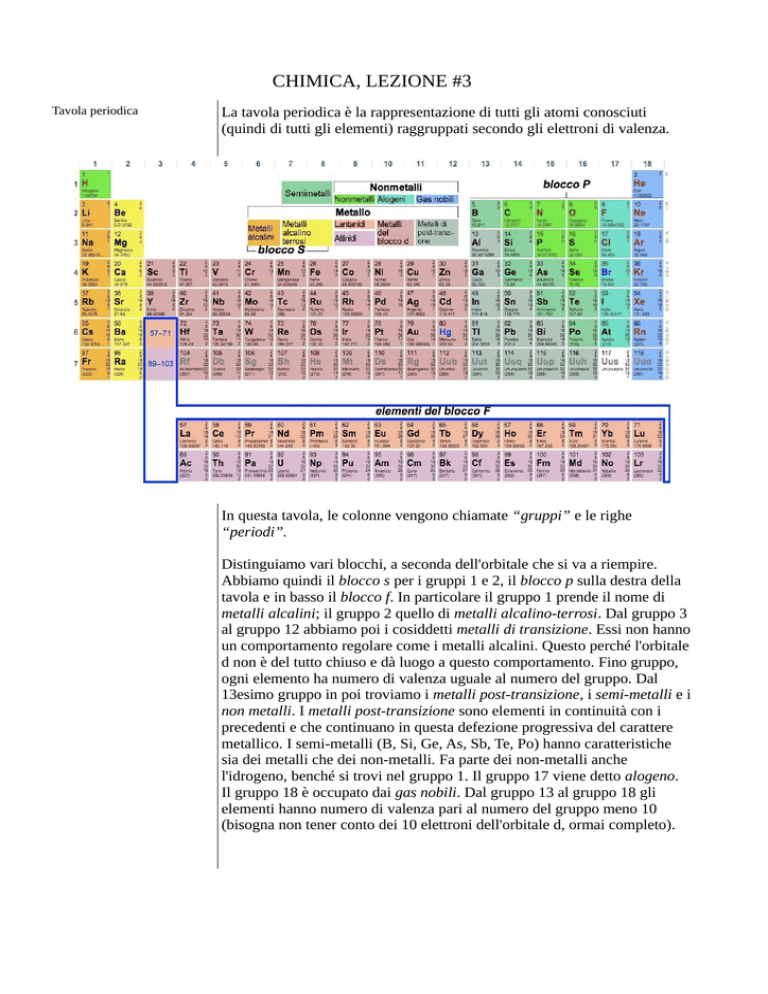
Tavola periodica
La tavola periodica è la rappresentazione di tutti gli atomi conosciuti
(quindi di tutti gli elementi) raggruppati secondo gli elettroni di valenza.
In questa tavola, le colonne vengono chiamate “gruppi” e le righe
“periodi”.
Distinguiamo vari blocchi, a seconda dell'orbitale che si va a riempire.
Abbiamo quindi il blocco s per i gruppi 1 e 2, il blocco p sulla destra della
tavola e in basso il blocco f. In particolare il gruppo 1 prende il nome di
metalli alcalini; il gruppo 2 quello di metalli alcalino-terrosi. Dal gruppo 3
al gruppo 12 abbiamo poi i cosiddetti metalli di transizione. Essi non hanno
un comportamento regolare come i metalli alcalini. Questo perché l'orbitale
d non è del tutto chiuso e dà luogo a questo comportamento. Fino gruppo,
ogni elemento ha numero di valenza uguale al numero del gruppo. Dal
13esimo gruppo in poi troviamo i metalli post-transizione, i semi-metalli e i
non metalli. I metalli post-transizione sono elementi in continuità con i
precedenti e che continuano in questa defezione progressiva del carattere
metallico. I semi-metalli (B, Si, Ge, As, Sb, Te, Po) hanno caratteristiche
sia dei metalli che dei non-metalli. Fa parte dei non-metalli anche
l'idrogeno, benché si trovi nel gruppo 1. Il gruppo 17 viene detto alogeno.
Il gruppo 18 è occupato dai gas nobili. Dal gruppo 13 al gruppo 18 gli
elementi hanno numero di valenza pari al numero del gruppo meno 10
(bisogna non tener conto dei 10 elettroni dell'orbitale d, ormai completo).
Caratteristiche periodiche.
La prima caratteristica periodica, che abbiamo già notato nella descrizione
della tavola periodica, è il carattere metallico, che diminuisce verso destra.
+ -------> Carica effettiva (o efficace)
La carica effettiva è l'attrazione effettiva fra il nucleo atomico e gli
elettroni. Essa è pari a: Zeff = Z – S, dove S è l'effetto schermo.
Aumenta nel periodo
Diminuisce
nel
gruppo
Raggio atomico
Diminuisce nel periodo
Aumenta
nel
gruppo
(Effetto aumento di n (più gusci))
Energia di ionizzazione
Energia che si deve fornire a un elemento in stato gassoso per sottrargli un
elettrone.
Aumenta nel periodo
(per effetto dell'aumento della carica efficace)
Diminuisce nel
gruppo (effetto aumento di n)
Distinguiamo poi l'energia di prima ionizzazione e quella di seconda
ionizzazione. Quest'ultima è favorita nei metalli alcalino-terrosi.
Affinità elettronica
Variazione di energia quando viene aggiunto un elettrone a un atomo in
stato gassoso. È un processo favorevole per gli alogeni.
Aumenta nel periodo
Diminuisce
nel gruppo
Elettronegatività
È la capacità di un atomo di attrarre a sé una coppia elettronica in un
composto.
Χ = A.E. + E.I.
2
Aumenta nel periodo
Diminuisce
nel gruppo
Legami
Un legame chimico si forma fra 2 atomi, perché c'è un guadagno di energia
passando da atomo a molecola.
E
A
B
A – B (stabilità maggiore)
Un legame può essere:
• A – B, legame semplice
• A = B, legame doppio
• A ≡ B, legame triplo
→ 2 elettroni di valenza
→ 4 elettroni di valenza
→ 6 elettroni di valenza
Distinguiamo poi:
Legame ionico
(con una differenza di elettronegatività elevata)
In questo legame l'elemento più elettronegativo sottrae la coppia di
elettroni. Gli atomi diventano ioni e, quindi, il legame si fonda su una forza
di natura elettrostatica (coulombiana).
Legame covalente
La coppia di elettroni è in completa condivisione fra i due atomi.
Se la differenza di elettronegatività è uguale a zero (atomi di uno stesso
elemento) allora la nube elettronica risulta equamente distribuita nello
spazio, e il legame prende il nome di legame covalente omopolare.
Se, invece, la differenza di elettronegatività è maggiore di 0, ma non
elevata al punto di avere un legame ionico, allora la nube elettronica tende
verso l'atomo più elettronegativo, formando un dipolo. Il legame si chiama
legame covalente eteropolare.












