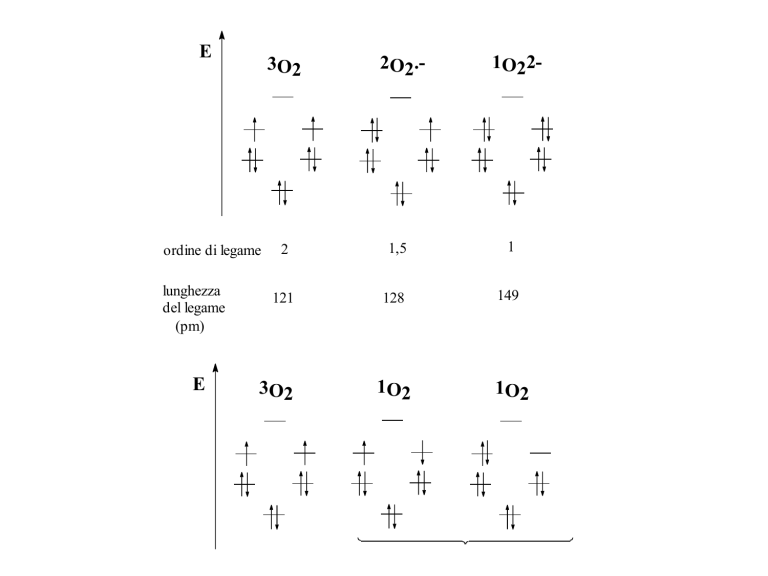
E
3O 2
ordine di legame
lunghezza
del legame
(pm)
E
2O2.-
1O22-
2
1,5
1
121
128
149
1O2
1O2
3O2
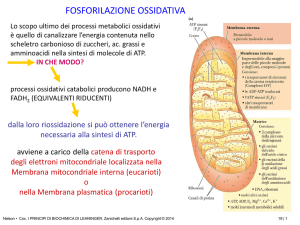
Reattività e tossicità dell’ossigeno e dei suoi derivati
Attivazione riduttiva
1O
energia
2
Reagisce
velocemente
con substrati
organici che
sono tutti nello
stato
fondamentale di
singoletto
e3O
2
2 O2 -. + 2H+
Reagisce velocemente
con radicali organici
(che hanno elettroni
spaiati) e con complessi
di metalli di transizione
paramagnetici
e-, 2H+
2O -.
2
H2O2
H2O2 + O2
Fe2+ + H2O2
Fe3+ + OH- + OH.
La tossicità dell’O2 si manifesta su lipidi, proteine e DNA. Un esempio è la
Perossidazione lipidica
Estrazione di un
atomo di idrogeno
dalla posizione
allilica
Radicale
centrato sul
carbonio
reagisce
velocemente
con O2
Perossi radicale può
estrarre un atomo di
idrogeno da un
secondo lipide
Variazioni irreversibili della
catena fosfolipidica
Sistemi di difesa contro il danno ossidativo
1) Relegare le reazioni ossidative in compartimenti cellulari
chiusi come i mitocondri e i cloroplasti
2) Sviluppare molecole capaci di catturare derivati tossici
dell’ossigeno
3) Sviluppare enzimi detossificanti
4) Sistemi che sequestrano ioni metallici con attività redox
5) Sviluppare sistemi che riparano i danni
Catturatori non enzimatici di specie ossidanti
Vitamina E è lipofila, sta nelle
membrane cellulari e protegge dalla
perossidazione lipidica
tocoferolo
acido
ascorbico
glutatione
Vitamina C e glutatione stanno nel
citosol
Sistemi che sequestrano ioni metallici con attività redox
Ferritina e transferrina sequestrano il ferro impedendogli di fare reazioni
indesiderate
Fe2+ + H2O2
Enzimi detossificanti
Catalasi
Perossidasi
Superossido dismutasi
Fe3+ + OH- + OH.
PEROSSIDASI
Classe di emoproteine che catalizza
l’ossidazione di molecole organiche
da parte di H2O2.che viene ridotta ad
acqua.
H2O2 + AH2
2H2O + A
Il centro metallico è un Fe(III) alto spin
coordinato ad un imidazolo di una istidina.
Nella sesta posizione coordina l’H2O2: gli aa
presenti da questo lato guidano la
coordinazione e promuovono la reazione
H2O2 coordina sul Fe(III) e istidina
distale media il trasferimento di un
H+ in modo che entrambi gli
idrogeni siano legati sull’ossigeno
non coordinato al ferro
Composto I è ridotto al Fe(III) di partenza a seguito di due trasferimenti elettronici.
Gli elettroni provengono dal substrato che si ossida
L’aa Arg polarizza il legame
perossidico favorendo la
rottura eterolitica di detto
legame
Si libera una
molecola di acqua e
si forma un
intermedio Fe(IV)=O
con il metallo in uno
stato di ossidazione
elevato. L’anello
porfirinco è un
radicale catione
CATALASI
È una perossidasi speciale perché il suo substrato è una seconda molecola di H 2O2.
Catalizza la reazione di disproprozione di H2O2
Il Ferro (III) alto spin è coordinato assialmente dal gruppo fenolato dell’aminoacido tirosina e
da una molecola di acqua che viene spostata dall’H2O2.
H2O2 + H2O2
2H2O + O2
Meccanismo d’azione:
Fe(III)porf + H2O2
Fe(III)porf(OOH) + H+
Fe(III)porf(OOH)
Fe(IV)porf+.=O + OH-
Fe(IV)porf+.=O + H2O2
O2 + Fe(III)porf + H2O
Stesso
meccanismo
visto per le
perossidasi e si
forma Composto
I con ferro ad alta
valenza
Usando H2O2 marcata si è stabilito che rottura legame O-O non avviene. Si tratta di una riduzione
bielettronica del composto I da parte di H2O2, con l’ossigeno coordinato al ferro che viene rilasciato
in una molecola di acqua
SUPEROSSIDO DISMUTASI
Sono una famiglia di metallo proteine che catalizza la disproporzione dello ione superossido
attraverso un meccanismo che consiste di due passaggi consecutivi:
1)
2)
Mn+ + O2-
M(n-1)+ + O2
M(n-1)+ + O2-
Mn+(O22-)
2H+
Mn+ + H2O2
Nello step 1) lo ione superossido riduce lo ione metallico ossidandosi ad ossigeno
molecolare
Nello step 2) lo ione superossido riossida lo ione metallico riducendosi a perossido
La reazione complessiva è:
2O2
-+
2H+
SOD
O2 + H 2 O2
Nei mitocondri delle cellule eucariote si trova la
Cu-Zn SOD
consiste di due subunità identiche tenute
insieme da interazioni idrofobiche
il rame e lo zinco si trovano sul fondo di uno
stretto canale fatto ad imbuto. Le dimensioni di
questo canale consentono il passaggio solo
alle molecole molto piccole (es. acqua) e agli
ioni piccoli.
all’imboccatura del canale sulla superficie
esterna della proteina ci sono due aa lisina,
che essendo carichi positivamente, attraggono
lo ione superossido.
lungo le pareti del canale vi è un aa arginina
anch’esso positivo che ha la funzione di
convogliare l’anione superossido verso il sito
catalitico
una modifica chimica delle lisine e della
arginina comporta una forte diminuzione
dell’attività della SOD
Sito catalitico della Cu-Zn SOD
His118
H2O
His44
His 69
Cu
Zn
Cu2+ è coordinato a 4
imidazoli istidinici e a
una molecola
d’acqua. La geometria
è piramidale a base
quadrata con acqua
nella posizione
apicale
Asp 81
His 46
His 78
His 61
A ponte tra i due centri metallici
Zn2+ è coordinato a 3 imidazoli
istidinici e al carbossilato di un
aspartato
Sito catalitico della Cu-Zn SOD
His118
H2O
His44
His 69
Cu
Zn
Asp 81
His 46
His 78
Cu2+ è il sito di interazione dello ione
superossido. Quindi il Cu2+ è il sito
His 61
su cui avviene la disproporzione:
Cu2+ + O2Cu+ + O2-
Rimozione dello Zn2+ non altera l’attività
della SOD ma rende più instabile la
proteina che si denatura a temperatura
più bassa della SOD nativa
Cu+ + O2
Cu2+(O22-)
Cu2+ + H2O2
Zn2+ ha ruolo strutturale
Attività della SOD è inibita in presenza di specie
anioniche piccole come CN-, F-, N3- che competono con
lo ione superossido nel sito catalitico.
Reattività dell’O2
La reazione tra un substrato organico e l’O2 è termodinamicamente molto
favorita perché libera una grande quantità di calore (DH negativo)
DG° = DH° -TDS°
La reazione tra un substrato organico e l’O2 è cineticamente molto lenta
perché la barriera energetica di attivazione è molto elevata.
k = Ae-Eatt./RT
Energia
Eatt
potenziale
Coordinata di reazione
Il motivo sta nel fatto che O2 è
allo stato fondamentale di
tripletto, mentre le molecole
organiche hanno stati
fondamentali di singoletto
(senza elettroni spaiati)
la bassa velocità di reazione tra ossigeno e substrati organici ha
permesso ai sistemi biologici la messa a punto di processi catalitici.
L’azione degli enzimi è quella di individuare nuovi percorsi di reazione
con energia di attivazione molto più bassa.
Energia
Eatt
Eatt’
potenziale
Coordinata di reazione
Coordinata di reazione
Funzioni dell’O2 nei sistemi biologici:
monoossigenazione e diossigenazione
Sorgente di atomi di ossigeno per la biosintesi di metaboliti o per la
conversione di molecole idrofobiche in metaboliti più polari e solubili in
acqua facilitando l’eliminazione per via renale
diossigenasi
RH + O2
RH + O2 +
2e- +
2H+
RHO2
monossigenasi
ROH + H2O
Tra le monoossigenasi gli enzimi citocromo P-450 sono stati oggetto di molti
studi perché sono emoproteine il cui sito attivo è molto simile a quello della
emoglobina/mioglobina e perché catalizzano la inserzione di un atomo di
ossigeno in una grande varietà di substrati
C
C
Idrossilazione di composti alifatici
OH
Idrossilazione di composti aromatici
OH
H
Epossidazione di alcheni
O
N+_ O-
N
S
S
O
Ossidazione di ammine a N-ossidi
Ossidazione di solfuri a solfossidi
Gli enzimi citocromo P450 sono stati difficili da caratterizzare perché sono legati alle
membrane del mitocondrio e del reticolo endoplasmatico e sono poco solubili in
acqua.
Si è isolato quello presente nel batterio Pseudomonas putida
Questi enzimi consistono di una
singola catena polipeptidica (con
400-530 aa, a seconda del tipo di
enzima) con un gruppo eme b
(Fe-protoporfirina IX) privo di
legami covalenti fra l’anello
porfirinico e la proteina. L’atomo
di Fe(III), legato solo ad un
atomo di S di una cisteina, è in
uno stato di basso spin,
probabilmente con una molecola
di H2O in posizione apicale. Il
gruppo cisteinato RS- stabilizza il
metallo nella forma ossidata
Fe(III), in una configurazione a
basso spin.
Il potenziale redox, a pH 7 è
– 330 mV.
Cys
Interazione con il substrato genera
Fe(III) pentacoordinato ad alto spin. La
variazione di spin cambia il potenziale
redox a +170 mV
L’aumento di potenziale
favorisce la riduzione: si ottiene
Fe(II) pentacoordinato ad alto
spin, del tutto simile alla specie
che coordina O2 in emoglobina
Fe(III) esacoordinato a
basso spin: potenziale
redox a -330 mV
XOOH
XOH
[(Por•+)Fe(IV)=O]
O2 si coordina per
dare addotto
Fe(II)O2 o Fe(III)superossido
Specie ossidante ed
elettrofila che fa la
monoossigenazione
La cattura di un H+ forma un Fe(III) idroperossido, il
quale per rottura eterolitica del legame O-O si
trasforma in OH- che viene eliminato come H2O per
acquisto di un protone.
La seconda riduzione forma il complesso perossidico
Similitudine tra perossidasi e citocromo P-450
R-H
His
+
Arg
O
O
Fe(IV)-Por+.
Fe(IV)-Por+.
S-Cys
His
Compound I
Come è possibile che la stessa specie ipervalente dia due reazioni molto diverse,
trasferimento di atomo di ossigeno nel cyt P-450 e trasferimento elettronico in
perossidasi e catalasi?
Le cavità in cui si dispone il substrato sono diverse: nel cytP450 RH è molto vicino al ferrile.
Nella perossidasi alcuni aminoacidi bloccano di fatto l’avvicinamento del substrato al ferrile,
rendendo possibile solo il trasferimento dell’elettrone.
Come si effettua la rottura eterolitica del legame perossidico nei due sistemi enzimatici?
Nella perossidasi la polarizzazione del legame è raggiunta grazie all’azione degli aminoacidi.
nel citocromo P-450 tali aminoacidi non ci sono perché il complesso si trova in una tasca
idrofobica. Probabilmente il legante assiale cisteina, per la sua natura basica, favorisce la
rottura eterolitica.
Sistemi modello del citocromo P450 sono ferro porfirine di sintesi
X2
X2
X3
X1
X3
X1
X4
X4
X2
X2
X4
N
N
Fe
X4
X4
X1
X2
X4
X1
X3
X2
X2
X1=X3=CH3; X2=X4=H
FeTMP
X1=Cl; X2=X3=X4=H
FeTDCPP
X1=X2=X3=F; X4=H
FeTF5PP
3a generazione:
X2
X4
X1
FeTPP
2a generazione:
N
N
X4
X1
X3
(III)
1a generazione:
X1=X2=X3=X4 = H
X1
X1
Catalisi biomimetica
X1=Cl; X2=X3=H; X4=Cl
FeTDCPCl8P
Sistemi modello del citocromo P450
h
OH
Ferro porfirine di
sintesi/donatore di atomi di
ossigeno
N
N
N
Fe
.
Ferro porfirine di sintesi/agente
riducente chimico/O2
Ferro porfirine di sintesi/luce
ultravioletta/O2. La luce è un
reagente riducente rinnovabile
che consente la formazione di
una specie elettrofila
N
N
N
N
N
FeII
III
O2
OH
O
H2O
H
.
O.
O
O
O
N
N
N
FeIII
N
N
III
Fe
N
N
N
Funzioni dell’O2 nei sistemi biologici:
fosforilazione ossidativa
Negli organismi aerobi l’ossigeno è l’accettore finale di elettroni della catena respiratoria,
provenienti dall’ossidazione di molecole come il glucosio o gli acidi grassi.
Nella reazione, che rappresenta la sorgente principale di energia negli organismi aerobici,
il prodotto di riduzione è l’acqua:
O2 + 4H+ + 4e-
2H2O
La respirazione cellulare è più correttamente una fosforilazione ossidativa:
infatti, gli enzimi che la catalizzano accoppiano alla ossidazione del substrato organico e
alla riduzione dell’ossigeno la sintesi dell’ATP a partire da ADP e fosfato.
ADP + Pi
ATP
LA CATENA RESPIRATORIA
fosforilazione ossidativa: cosa assicura la monodirezionalità
del movimento degli elettroni?
Fe4S4
Fe3S4
Fe2S2
Citocromo c
rubredossine
Citocromo a
O2/H2O
800
600
400
200
0
-200
-400
Potenziale di riduzione (mV)
-600
-800
Proteine ferro-zolfo
Sono metallo proteine contenenti raggruppamenti atomici di ferro e zolfo con
stechiometrie differenti. Sono molto antiche, hanno PM bassi, non richiedono
gruppi prostetici e non possiedono aminoacidi di forma complessa.
Hanno potenziali di riduzione compresi tra -0.49 e -0.05 mV.
Si suddividono in:
-Rubredossine (a)
-Ferredossine (b, c,d)
(a) rubredossine: 1Fe-0S
(b) ferredossine: 2Fe-2S
(c) ferredossine: 4Fe-4S
(d) ferredossine: 3Fe-4S
Attività si basa sulla
reversibilità della
coppia redox
Fe(III)/Fe(II)
Il ferro è coordinato da 4 S secondo geometria tetraedrica:
i leganti solfuro sono a campo debole
Alto spin
t2g
eg
Fe(III) d5
meff = 5.85
no transizioni d-d
Fe(II) d6
meff = 5.05
si transizione d-d che cade nell’IR
Si possono distinguere forma ossidata ridotta per via spettroscopica
Le ferredossine Fe2S2 sono molto diffuse nei cloroplasti delle piante e partecipano
al processo fotosintetico. Dato che i numeri di ossidazione per atomi di Fe in un
intorno tetraedrico sono +2 e +3, la carica del cluster può variare da 0 (Fe(II)Fe(II))
a +1 (Fe(II)Fe(III)) a +2 (Fe(III)Fe(III)).
4Fe-4S è il più diffuso cluster Fe-S in biologia Si trova nella succinato
deidrogenasi. La struttura: un cubo con atomi di Fe e S ai vertici, in
posizione alternata. Il cubo è ancorato alla proteina attraverso l’atomo
di S di 4 cisteine, generando una geometria tetraedrica distorta per i 4
atomi di Fe.
Esistono i dati strutturali di varie proteine 4Fe-4S sia nella forma
ossidata che ridotta: la variazione del N.O. del metallo conseguente al
trasferimento elettronico non determina importanti variazioni di
geometria di coordinazione e di distanze di legame. Questo minimizza
l’energia di attivazione associata al processo ossido-riduttivo rendendo
il trasferimento elettronico un processo molto veloce.
L’unità Fe4S4 nelle proteine può esistere in tre stati di ossidazione
stabili
Fe4S43+
[Fe(III)3Fe(II)]
e-e-
Fe4S42+
[Fe(III)2Fe(II)2]
e-e-
Fe4S4+
[Fe(III)Fe(II)3]
CITOCROMI: emoproteine contenenti gruppi eme
eme a
eme c
Eme b o protoporfirina IX
CITOCROMO C
Citocromo c è coordinato con una istidina e una metionina ed ha un potenziale redox di +260 mV
È proteina solubile in acqua, a
basso peso molecolare. Facile
da isolare e purificare perché
non è fortemente associata
alla membrana mitocondriale
interna.
I gruppi vinilici dell’eme legano
due cisteine della proteina.
È proteina antica in termini
evoluzionistici
La funzione è tasferire un
elettrone attraverso la
reversibilità della coppia redox
Fe(III)/Fe(II)
In che modo la proteina controlla il potenziale di riduzione del centro metallico?
citocromo
Potenziale di
riduzione (mV)
Citocromo c nativo
+260 mV
Met-80
His-80
+40 mV
Tyr 67
Phe 67
+225 mV
Eme ottapeptide
-50 mV
Quali sono i requisiti a livello molecolare affinchè il trasferimento elettronico
sia veloce?
Il trasferimento di elettroni
non è veloce quando le
geometrie del sistema in
forma ossidata e in forma
ridotta sono molto diverse,
cioè occorre energia per
riorganizzare.
I raggi X della forma ossidata e
ridotta hanno dimostrato che ci
sono minime variazioni.
Il trasferimento dell’elettrone è più
veloce del movimento dei nuclei
come è possibile trasferire elettroni tra due centri redox
che possono essere separati da una distanza di più di 20 Angstrom
da un ambiente proteico apparentemente inerte?
e-
donatore
ponte
accettore
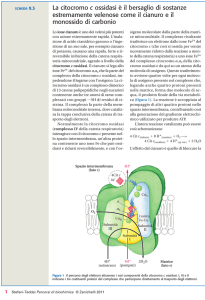
Citocromo c ossidasi
Ultimo enzima della catena respiratoria
Fortemente associato con membrana mitocondriale interna
Costituito da almeno 13 subunità
Comprende almeno 4 centri redox
Citocromo c
Eme a / CuA (II)
Eme a3 / CuB (II)
eme è ferro basso spin
esacoordinato (due imidazoli
assiali). La funzione è solo
di trasferimento elettronico:
Eme pentacoordinato (un
imidazolo). Fe(III) coordina
CN- e Fe(II) coordina CO.
È il sito di legame per l’O2
Meccanismo proposto per la citocromo c ossidasi
(alto spin) (cyt a3)Fe(II)
3O
Cu(I)
2
(basso spin) (cyt a3)Fe(II)(O2) o Fe(III)(O2-)
(cyt a3)Fe(III)(O22-)
Cu(I)
Cu(II)
+e+ 2 e-
(cyt a3)Fe(III)(O22-)
Cu(I)
+H+
(cyt a3)Fe(III)(OOH) Cu(I)
(cyt a3)Fe(II)(OOH)- - Cu(II)
+H+
(cyt a3)Fe(IV)=O (H2O)Cu(II)
+e-
(cyt a3)Fe(III)(OH) ….(HO)Cu (II)
2H+
(cyt a3)Fe(III) Cu (II) + 2H2O
fosforilazione ossidativa: cosa assicura la monodirezionalità
del movimento degli elettroni?
Fe4S4
Fe3S4
Fe2S2
Citocromo c
rubredossine
Citocromo a
O2/H2O
800
600
400
200
0
-200
-400
Potenziale di riduzione (mV)
-600
-800