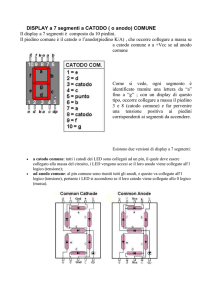
Elettrochimica
Prof.ssa Elena Truffo
Anno scolastico 2004/05
Scambi di elettroni
Zn
Cu
Zn2+
Cu2+
Cu(s) + Zn2+(aq) Cu2+(aq) + Zn(s)
Cu2+(aq) + Zn(s) Cu(s) + Zn2+(aq)
potere ossidante di Cu2+/Cu > potere ossidante di Zn2+/Zn
Cu
Zn
H2
H 3O +
H3O+
2 H3O+(aq) + Cu(s) H2(g) + Cu2+(aq) + 2 H2O(l)
2 H3O+(aq) + Zn(s) H2(g) + Zn2+(aq) + 2 H2O(l)
pot ox Cu2+/Cu > pot ox H3O+/H2 > pot ox Zn2+/Zn
Cu
Ag+
Zn
Ag+
2 Ag+(aq) + Cu(s) 2 Ag(s) + Cu2+(aq)
Ag+/Ag
Cu2+/Cu
H3O+/H2
Zn2+/Zn
Scala qualitativa del potere ossidante
Cella elettrochimica: pila
• Con una cella elettrochimica si può
sfruttare la tendenza spontanea degli
elementi allo scambio di elettroni e si
possono utilizzare le redox per convertire
l’energia chimica in energia elettrica, senza
dissiparla in calore
Cu2+(aq) + Zn(s) Cu(s) + Zn2+(aq)
Zn(s) Zn2+(aq) + 2 e-
ossidazione
Cu2+(aq) + 2 e- Cu(s)
riduzione
Zn
Zn2+
Cu
Cu2+
Se la reazione è spontanea, gli elettroni hanno la tendenza
ad andare spontaneamente da sinistra a destra.
Pila di Volta
• La prima pila è stata inventata nel 1799 dal fisico italiano
Alessandro Volta. Egli realizzò questo dispositivo
“impilando” diverse coppie di dischi di zinco e di rame
separati da un panno imbevuto di acido solforico
(H2SO4). I due metalli a contatto con la soluzione
elettrolitica tendono a caricarsi; lo zinco negativamente e
il rame positivamente, generando una piccola ddp.
Sommando i contributi delle diverse coppie di dischi,
otteniamo la ddp della pila.
•
•
Cu(s) + 4H+(aq) + 2 e- Cu2+(aq) + 2H2 Riduzione Catodo (polo +)
Zn(s) Zn2+(aq) + 2 eOssidazione Anodo (polo -)
----------------------------------------------------------------------------------Cu (s) + Zn (s) + 4 H+ (aq) Zn2+(aq) + Cu2+(aq) + 2 H2
• Nella pila di Volta si verifica, però, il fenomeno della
polarizzazione. Infatti l’idrogeno che si sviluppa
all’elettrodo positivo di rame circonda l’elettrodo stesso,
alterandone le proprietà e determinando un rapido
annullamento della fem. In questo caso diciamo che la
pila si è polarizzata.
Pila Daniell
Voltmetro
Zn
-
+
Cu
V = 0
Anodo polo -
Cu2+
Zn2+
Cl- ponte salino K+
Cu2+(aq) + 2 e- Cu(s) Riduzione
Zn(s) Zn2+(aq) + 2 e- Ossidazione
Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s)
Catodo polo +
Catodo (polo +)
Anodo (polo -)
Reazione totale della pila
Pila Daniell
• E’ costituita da 2 semicelle collegate da un filo
conduttore e da un ponte salino. Una semicella è
costituita da una lamina di Zn immersa in una
soluzione 1M di ZnSO4; l’altra è una lamina di Cu
in una soluzione 1M di CuSO4. Le 2 lamine
(elettrodi) sono collegate dal filo conduttore che
permette il passaggio degli elettroni; sul filo è
inserito un voltmetro. Le 2 soluzioni sono
collegate da un ponte salino.
Il ponte salino
V
(-)
+
+
+
- - - -
(+)
+
-
+
-
+
-
+
+
+
+
+
+
+
-
+
-
Consiste in un tubo di
vetro a U, contenente
una soluzione salina,
per es. KCl molto
concentrata
+
Movimento di elettroni nel circuito esterno
Migrazione di ioni all’interno della pila
PERMETTE
Cosa accade durante il
funzionamento?
•
•
•
•
•
Si assottiglia la lamina di Zn
Si ispessisce la lamina di Cu
Si scolora la soluzione di CuSO4
Si riscalda il conduttore metallico
Il ponte salino mantiene la neutralità elettrica, in quanto:
- la parte del sistema in cui c’è il Cu assume carica – man
mano che gli ioni Cu 2+ vengono rimossi
- l’elettrodo di Zn assume una carica + man mano che si
formano nuovi ioni Zn 2+
Schematizzazione di una pila:
Composti
allo stato
solido o
gassoso
Composti
in
soluzione
Composti
in
soluzione
Composti
allo stato
solido o
gassoso
Esempio:
Zn Zn
2
Cu
2
Cu
Forza elettromotrice della
pila
• Forza elettromotrice (f.e.m., E) di una pila: differenza di
potenziale della pila misurata agli elettrodi quando NON vi
è circolazione di corrente
E = V(I0)
• La f.e.m. di una pila è per definizione una grandezza
POSITIVA ed è correlata al potenziale (assoluto) di ciascun
semielemento dalla relazione:
E = ECatodo - EAnodo = EC – EA
EC > EA
il catodo (semireazione di riduzione) si
trova a un potenziale maggiore rispetto all’anodo
Come si calcola la f.e.m.
• La f.e.m dipende dalla temperatura alla
quale si opera e dalla concentrazione delle
soluzioni ioniche in essa presenti.
• L’equazione di Nernst che tiene conto di
queste variabili ce ne consente facilmente il
calcolo quando le condizioni operative non
sono quelle standard (soluzioni 1 M, T=
25°C)
Per calcolare il potenziale di un elettrodo non allo
stato standard si usa l’equazione di Nernst:
Potenziale
standard
Costante di
equilibrio della
redox
RT
ln K
nF
Walter Hermann Nernst
Briesen 1864 – Berlino 1940
Premio Nobel per la Chimica 1920
Numero degli
elettroni
A 25°C:
Costante di
Faraday
0,059
log 10 K
n
Per esempio:
MnO4-(aq) + 8 H3O+(aq) + 5 e- Mn2+(aq) + 12 H2O(l)
=1,491 V
2
0,059
[Mn ]
1,491
log 10
8
5
[MnO 4 ][ H3O ]
PbO2(s) + 4 H3O+(aq) + 2 e- Pb2+(aq) + 6 H2O(l)
=1,460 V
2
0,059
[Pb ]
1,460
log 10
4
2
[ H 3O ]
Potenziale standard di un
semielemento
• Con un tester si misura la f.e.m. di una pila, ma
non si può conoscere il potenziale di ogni singolo
elettrodo. Per fare questo è necessario costruire
una pila nella quale un elettrodo sia quello di cui
si vuole conoscere il potenziale e l’altro sia un
elettrodo di riferimento a cui si assegna
arbitrariamente un valore al potenziale standard
pari a 0,00 V
• L’elettrodo standard (o normale) è quello ad
idrogeno (ESI)
Elettrodo standard di riferimento:
2 H3O+(aq) + 2 e- H2(g) + 2 H2O(l)
Pt
H3O (aq)
H 2 (1 atm)
pH 0
H2(1 atm)
Pt
.... a 25C
Sulla lamina di Pt arriva
una corrente di H2 alla P
di 1 atm. La soluzione è
1 M per H3O+
25°C
pH=0
La serie elettrochimica dei
potenziali standard
• Con l’assunzione del riferimento per l’ESI si
può determinare il potenziale standard di
un qualsiasi semielemento costituito da una
coppia Oss/Rid, accoppiando l’ESI con il
semielemento, in condizioni standard e
misurando la f.e.m. della pila così ottenuta.
Potenziale standard di riduzione:
Cu2+(aq) + 2 e- Cu(s)
= + 0,3419 V
H2(1 atm)
Cu
Pt
pH=0
25°C
[Cu2+]=1,0 M
Potenziale standard di riduzione:
Zn2+(aq) + 2 e- Zn(s)
= - 0,7618 V
H2(1 atm)
Zn
Pt
pH=0
25°C
[Zn2+]=1,0 M
F.e.m. della pila Daniell
o
o
ΔV ε ε 0.3419 0.7618 1,1037 V
-
+
Zn
[Zn2+]=1,0
M
Ossidazione
(anodo)
Cu
25°C
[Cu2+]=1,0 M
Riduzione
(catodo)
Serie elettrochimica dei
potenziali standard (25°C)
Semireazione
E° (V)
Semireazione
E° (V)
F2(g) + 2e- 2F-
+2.87
2H+(aq) + 2e- H2(g)
0.00
+1.69
Sn2+(aq) + 2e- Ni(s)
-0.14
PbO2(s) + SO42-(aq) + 4H+ + 2e- PbSO4(s) + H2O
2HOCl(aq) + 2H+(aq) + 2e- Cl2(g) + 2H20
+1.63
-0.25
MnO4-(aq) + 8H+(aq) + 5e- Mn2+(aq) + 4H20
Ni2+(aq) + 2e- Ni(s)
+1.51
PbO2(s) + 4H+(aq) + 2e- Pb2+(aq) + 2H2O
Co2+(aq) + 2e- Co(s)
-0.28
+1.46
PbSO4(s) + 2e- Pb(s) + SO42-(aq)
-0.36
Cd2+(aq) + 2e- Cd(s)
-0.40
Fe2+(aq) + 2e- Fe(s)
-0.44
Cr3+(aq) + 3e- Cr(s)
-0.74
+1.07
Zn2+(aq) + 2e- Zn(s)
-0.83
NO3-(aq) + 4H+(aq) + 3e- NO(g) + 2H2O
+0.96
2H2O(aq) + 2e- H2(g) + 2OH-(aq)
-1.66
Ag+(aq) + e- Ag(s)
+0.80
Mg2+(aq) + 2e- Mg(s)
-2.37
Fe3+(aq) + e- Fe2+(aq)
+0.77
Na+(aq) + e- Na(s)
-2.71
I2(s) + 2e- 2I-(aq)
+0.54
Ca2+(aq) + 2e- Ca(s)
-2.76
NiO2(aq) + 4H+(aq) + 3e- Ni(OH)2(s) + 2OH-(aq) +0.49
K+(aq) + e- K(s)
-2.92
Cu2+(aq) + 2e- Cu(s)
+0.34
Li+(aq) + e- Li(s)
-3.05
SO42-(aq) + 4H+(aq) + 2e- H2SO3(aq) + H2O
+0.17
-
BrO3 (aq) +
6H+(aq)
3e-
Au3+(aq)
+
Cl2
2e-
(g)
+
+
6e-
Br-
(aq)
+ 3H2O
Au(s)
Cl-
(aq)
O2(g) + 4H+(aq) + 4e- 2H2O
Br2
(aq)
+ 2e- 2Br-(aq)
+1.44
+1.42
+1.36
+1.23
• I valori sono tabulati come potenziali standard di riduzione; ogni semireazione
elettrodica è riportata come riduzione
• Il potenziale standard di riduzione di una certa coppia redox indica la capacità
di questa coppia a comportarsi da ossidante o da riducente rispetto alla coppia
H3O+/H2
• Lo stesso criterio può essere facilmente esteso a qualsiasi altra coppia redox,
confrontando i relativi potenziali standard
• Calcolo immediato della f.e.m. standard (E°) di una cella formata da due
semielementi qualsiasi
(-) ZnZn2+(aq, a=1)Cu2+(aq, a=1)Cu (+)
E° = E°C-E°A = E°Cu2+/Cu-E°Zn2+/Zn = +0.337 - (-0.763) = +1.100 V
Pile a concentrazione
Ag [Ag ] c1 [Ag ] c 2 Ag
0,059
1
o
log 10
1
[Ag ]
c1 = c2
c1 < c2
c1 > c2
Pt [H3O ] [H3O ] Pt
H 2 pH1
pH 2 H 2
pila scarica
catodo a destra
catodo a sinistra
Pile zinco-carbone (Leclanché)
Catodo metallico (ottone)
Chiusura in plastica
Impasto di ZnCl2,
NH4Cl e polvere di
carbone
Zn(s) Zn2+(aq) + 2 e2MnO2(s) + 2 NH4+(aq) + 2 e-
Mn2O3(s) + 2 NH3(aq) + H2O(l)
Grafite
Involucro di zinco (anodo)
MnO2(s)
Pile alcaline (voltaggio costante)
Catodo metallico (ottone)
Chiusura in plastica
Impasto di ZnCl2,
KOH e polvere di
carbone
Zn(s) + 2 OH-(aq) Zn(OH)2(s) + 2 e2 MnO2(s) + H2O(l) + 2 e- Mn2O3(s) + 2 OH-(aq)
Grafite
Involucro di zinco (anodo)
MnO2(s)
Pile zinco – ossido di
argento
densità di energia molto alta, lunga durata, peso contenuto;
utilizzate per: satelliti, macchine fotografiche,
orologi, apparecchi acustici
Pile a elettrolita solido
(litio-iodio)
Potenza ridottissima ma lunghissima durata
Impieghi: pacemakers, orologi, smoke detectors,
microfoni senza fili, calcolatrici.
Primi modelli: Ag/I2, DE 0.6 V, ma più soggette alla
rottura dell’elettrolita solido
Anodo (-):
Catodo (+):
Reazione totale:
2 Li 2 Li+ + 2 eI2 + 2 e- 2 I2 Li + I2 2 LiI
DE 2.8 V
Accumulatori Ni/Cd
• In queste batterie ricaricabili il
cadmio (Cd) costituisce l’elettrodo
negativo, l’ossido di nichel (NiO2)
quello positivo mentre, come
elettrolita, utilizzano l’idrossido di
potassio (KOH). Questi
accumulatori vengono
comunemente impiegati per i
dispositivi elettrici ed elettronici
portatili.
Anodo (-): Cd + 2OH- Cd(OH)2 + 2 eCatodo (+): 2NiO(OH)2 + 2 e- Ni(OH)2 + 2OHReazione totale: Cd + 2NiO(OH)2 2 Ni(OH)2+ Cd(OH)2
f.e.m 1,4 V
Effetto memoria
•
•
E’ il fenomeno per cui se una batteria NiCd viene ripetutamente caricata prima che sia
completamente scarica, essa dimentica di avere ulteriore capacità energetica in
aggiunta a quella fino a quel momento erogata, ma si riscontra solamente in alcune
applicazioni aerospaziali
Non bisogna confondere quest’effetto memoria con uno più comune e simile, chiamato
abbassamento di potenziale di scarica, dovuto alla crescita delle dimensioni dei
cristalli di cadmio. Il materiale che forma gli elettrodi è costituito da cristalli di piccole
dimensioni; fin tanto che questi cristalli rimangono di dimensioni ridotte le celle
elettrochimiche funzionano in modo appropriato. Quando si ha crescita delle dimensioni
ha luogo la drastica riduzione dell'area superficiale dei materiali elettrodici con
conseguente diminuzione di voltaggio e quindi delle prestazioni del dispositivo
elettrochimico. Qualora i cristalli crescano eccessivamente è possibile che i loro spigoli
possano penetrare attraverso il separatore e cortocircuitare i due elettrodi; in queste
condizioni si può verificare un'autoscarica della batteria. L'effetto della crescita delle
dimensione dei cristalli è più pronunciato se la batteria viene lasciata sotto carica per
giorni o viene ripetutamente scaricata in maniera incompleta. Per evitare quest'effetto
bisogna ciclare (caricare e scaricare) completamente la batteria almeno una volta ogni
due o tre settimane. Stesso fenomeno di crescita (autocrescita) delle dimensioni dei
cristalli ha luogo anche se la batteria non viene usata per lungo tempo. In questo caso
per ripristinare le caratteristiche iniziali è necessario un lento e profondo processo di
scarica in grado di rimuovere completamente l'energia rimasta nella cella
elettrochimica.
Batterie NiMH
•
•
•
•
•
•
Sono un'evoluzione di quelle nickel-cadmio presentando il vantaggio di avere maggiore
densità energetica (Wh/kg o Wh/dm3), circa il 30-40% in più, e di aver eliminato gli
inconvenienti dovuti all'uso di metalli pesanti. Il processo elettrochimico di carica, al
polo negativo costituito da una lega metallica generalmente di nichel e terre rare (per
esempio il LaNi5), è rappresentato dalla seguente reazione:
M + H2O +e- MH + OHe a quello positivo, costituito da idrossido di nichel, è:
Ni(OH)2 + OH- NiOOH + H2O + eLa reazione globale di cella durante il processo di carica, è pertanto:
M + Ni(OH)2 MH + NiOOH
In particolare, le leghe metalliche impiegate sono in grado di immagazzinare e
successivamente rilasciare una quantità d'idrogeno un migliaio di volte superiore al
proprio volume.
L'elettrolita impiegato è una soluzione diluita di idrossido di potassio (KOH) cui sono
aggiunti, in minor quantità, altri composti chimici per migliorare le prestazioni della
batteria.
Il separatore tra anodo e catodo, che impedisce il contatto elettrico tra gli elettrodi, ma
ne permette un efficiente scambio ionico, è costituito da un sottile film a base di nylon.
Accumulatori al litio
•
I moderni accumulatori al litio sono potenti e leggeri, anche se ancora relativamente
costosi. All’anodo abbiamo degli atomi di litio “immersi” in strati di grafite, il catodo è
un suo sale (solitamente LiMn2O4) e l’elettrolita è una soluzione di perclorato di litio
(LiClO4) in etilencarbonato (C2H4CO3), un solvente organico. La differenza di
potenziale ai poli è di 3,7 V.
•
Reazione chimica all'anodo (ossidazione)
•
Reazione chimica al catodo (riduzione)
•
Reazione completa
–
–
–
–
–
–
Lix xLi+ + xe-
Li1-xMn2O4 + xLi+ + xe- LiMn2O4
Lix + Li1-xMn2O4 LiMn2O4
Usi: Apparecchiature elettroniche moderne, computer portatili, cellulari, videocamere.
Vantaggi: Estremamente potente e leggera: solo 7 grammi di metallo producono fino ad
una mole di elettroni. Nessun “effetto memoria”. Non si verifica l'inconveniente
dell'abbassamento di potenziale di scarica in quanto durante il processo di carica e
scarica(intercalazione e deintercalazione di ioni litio) non si ha modificazione né delle
dimensioni dei grani né della struttura cristallina dei materiali elettrodici.
Svantaggi: Piuttosto costosa, il solvente può essere infiammabile
Gli accumulatori
Pb(s)
PbO2(s)
H2SO4(aq)
Accumulatori al Pb
• anodo in piombo spugnoso (lega Pb-Sb), catodo
in PbO2;
• elettrolita: H2SO4 37%
• numerose celle collegate in serie, elevata densità
di energia
• Sono ricaricabili perché i loro processi
elettrochimici sono reversibili. Per ricaricarli viene
applicata una corrente esterna in grado di far
avvenire la reazione redox in senso inverso
Cella a combustibile H - O
Anodo:
2H2(g) + 4 OH-(aq) 4 H2O(l) + 4 e-
Vapore
H2O(g)
Catodo:
O2(g) + 2 H2O(l) + 4 e- 4 OH-(aq)
H2(g)
O2(g)
Elettrodi di carbone
poroso contenenti
nichel
Soluzione calda con
K+(aq) e OH-(aq)
Pile a combustibile
• Operano a pressione e temperatura
abbastanza elevate (20-40 atm, 200 °C)
con un’alimentazione continua dei reagenti
• Sviluppate per le missioni spaziali (Apollo),
oggi allo studio per alimentare automobili a
impatto zero (ZEV)
Elettrolisi
Trasformazione di sostanze per opera di
energia elettrica fornita da una corrente
continua. Avviene in una cella
elettrolitica
Nella cella
elettrolitica si
realizza la
trasformazione di
energia elettrica
in energia
chimica
Catodo: elettrodo negativo
(reazione di riduzione)
Tra anodo e catodo si
genera un campo
elettrico che
determina la
migrazione degli ioni,
quelli + sono attratti
dal catodo, quelli –
dall’anodo
Anodo: elettrodo positivo
(reazione di ossidazione)
Elettrolita fuso
• Utilizzando 2 elettrodi di grafite immersi in
un bagno di NaCl fuso si ottengono le
seguenti reazioni:
all’anodo 2 Cl- → Cl2 + 2 eal catodo 2 Na+ + 2 e- → 2 Na
• Globalmente avviene la reazione
2 NaCl → 2 Na + Cl2
Scarica delle specie agli
elettrodi
•
Difficilmente in una soluzione è presente una sola coppia redox. Allora, quale
coppia si scarica per prima agli elettrodi?
•
Al catodo si scarica per prima la coppia con il potenziale di riduzione più alto
•
All’anodo si scarica per prima quella che ha il potenziale di riduzione più basso
•
Prevale il PROCESSO che avviene con la minor spesa di L
•
La concentrazione gioca un ruolo determinante: ioni con potenziali maggiori
vengono scavalcati da latri con potenziali minori nella scarica al catodo per la
loro ridottissima concentrazione
el
Una soluzione acquosa di
NaCl
Soluzione acquosa di NaCl (1 M)
Na+, Cl-, H2O
---------------------------------------------------------------------------------------------------------------------------2 H2O + 2 e- H2 + 2 OH-
E = -0,83 V potenziale più alto
2 Na+ + 2 e- → 2 Na
E = -2,71 V
---------------------------------------------------------------------------------------------------------------------------2 H2O → O2 + 4H+ + 4e-
E = 1,23 V
2 Cl- → Cl2 + 2 e-
E = 1,36 V
Per la sovratensione è
favorita quella con
potenziale più alto
Alcuni gas (H2 e O2) vengono prodotti dalla semireazione a un elettrodo di
metallo solo se il potenziale è di 0,4-0,6 V maggiore del potenziale standard
(sovratensione) a causa dell’alta energia di attivazione della semireazione.
Elettrolisi dell’acqua
• Aggiungendo piccole quantità di H2SO4 (per
renderla conduttrice) è possibile realizzare
l’elettrolisi dell’acqua
• Al catodo entrano in competizione H2O e
H3O+, all’anodo H2O, SO4- e OH• Prescindendo dai potenziali redox, dato la
bassa concentrazione di alcuni ioni, le uniche
reazioni possibili sono:
4 H2O + 4 e- 2 H2 + 4 OH- al catodo
6 H2O → O2 + 4 H3O+ + 4e- all’anodo
_________________________________
10 H2O → 4 H3O+ + 4 OH- + 2 H2 + O2
Ossia 2 H2O → 2 H2 + O2
Galvanostegia
• Consiste nel ricoprire oggetti metallici con
uno strato molto sottile di un altro
metallo fatto depositare
elettroliticamente con lo scopo di
proteggere l’oggetto stesso dalla
corrosione oppure di renderlo più
pregiato.
• Gli oggetti metallici da ricoprire vengono
utilizzati come catodi in una cella
elettrolitica il cui anodo è formato dal
metallo che si vuole depositare
sull’oggetto
• Se l’oggetto da ricoprire non è un
metallo, lo si riveste di una vernice
conduttrice (polvere di grafite) prima di
utilizzarlo come catodo e tale processo è
detto galvanoplastica
Leggi di Faraday
Quantità di elettrolita formato o decomposto agli elettrodi
Quantità di carica elettrica transitata attraverso la cella elettrolitica
Prima Legge di Faraday
La quantità di una sostanza formata o decomposta ad un elettrodo è
proporzionale alla quantità di carica elettrica che ha attraversato la cella
durante l’elettrolisi.
m e el q e el I t
eel: equivalente elettrochimico dell’elettrolita considerato (quantità in grammi
ottenuta per il passaggio di 1 coulomb di carica elettrica attraverso la cella)
Seconda Legge di Faraday
Per una stessa quantità di carica elettrica , le quantità delle specie chimiche formate o
decomposte agli elettrodi sono proporzionali ai loro pesi equivalenti Meq (M/n).
Faraday (F): quantità di carica corrispondente ad una mole di elettroni
1 F = (6.022•1023)(e-/mol) (1.602•10-19)(C/e-)= 96485 C/mol
Esempio: elettrolisi CuSO4 in H20
Catodo: Cu2+(aq) + 2 e- Cu(s)
1 mol di Cu(s) occorrono 2 mol di e- (2 F)
Anodo: 6 H20 O2(g) + 4 e- + H30+(aq)
1 mol di O2(g) occorrono 4 mol di e- (4 F)
Il passaggio di 1 F comporta la formazione di 1/2 mol di Cu(s) (63.5/2 g)
e di 1/4 mol di O2(g) (32/4 g)
e el
M eq
1F
m e el
M eq
M
q
I t
I t
1F
nF
Relazione di Faraday
• Le leggi possono essere riassunte nell’unica
relazione:
Massa in g
Intensità di corrente in A
m = i · t · Meq
96500
Tempo in s
Massa molare/numero di escambiati
Costante di Faraday
La corrosione dei metalli
•
•
•
Insieme di fenomeni chimici che
risultano nella degradazione di un
metallo (peggioramento delle proprietà
chimiche e fisiche)
Ossidazione del metallo
Corrosione di origine chimica: azione di
sostanze come SO2, H2S, NH3, H2SO4,
HNO3
•
Corrosione dovuta alle correnti
elettriche vaganti nel terreno; l’acqua e
i sali funzionano come elettroliti.
•
Fenomeni di corrosione dovuti alla
presenza CONTEMPORANEA di ossigeno
e acqua
La formazione della ruggine
• Quando una goccia d’acqua bagna un materiale di
ferro, il Fe metallico può ossidarsi, fungendo da
anodo:
Fe → Fe2+ + 2 eL’ossigeno atmosferico e l’acqua fungono da
catodo
O2 + 4e- + 2 H2O 4 OH• Gli ioni Fe in presenza di ioni OH- formano gli
idrossidi che reagiscono con l’ossigeno
atmosferico formando la ruggine (Fe2O3 · 2 H2O)
2 Fe(OH)2 + ½ O2 → Fe2O3 · 2 H2O
La corrosione del ferro del
ferro
Metodi per combattere la
corrosione
• Si rivestono i manufatti con smalti protettivi (inibizione)
• Si utilizzano leghe metalliche resistenti all’ossidazione (es.
acciaio inox)
• Si favorisce la formazione di una sottile pellicola
superficiale di ossido che rende inattaccabile il metallo
sottostante (passivazione)
• Si mette in contatto il metallo con un metallo più
ossidabile (protezione mediante anodo sacrificale)
• Si ricopre il metallo con metalli più resistenti
(galvanostegia)