Elettrochimica
L’elettrochimica studia l’impiego di energia elettrica per promuovere reazioni
non spontanee e l’impiego di reazioni spontanee per produrre energia elettrica,
entrambi i processi coinvolgono reazioni redox.
ENERGIA CHIMICA⇔ ENERGIA ELETTRICA
1. Celle elettrolitiche
Processi ossidoriduttivi NON SPONTANEI - trasformazione di energia elettrica in energia
chimica
2. Celle galvaniche o pile
Processi ossidoriduttivi SPONTANEI - trasformazione di energia chimica in energia
elettrica
1
Elettrolisi
Energia elettrica → Energia chimica
Cella elettrolitica
Reazioni di scarica agli elettrodi:
catodo (-) semireazioni di RIDUZIONE
Az+ + z e- → A
anodo (+) semireazioni di OSSIDAZIONE
B z- → B + z e-
Anodo: elettrodo positivo
Catodo: elettrodo negativo
Soluzione elettrolitica (o elettrolita fuso)
2
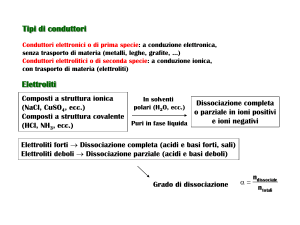
Sono chiamati “elettroliti” quelle sostanze che in fase liquida, allo stato
puro, o in soluzione in solventi polari sono dissociati in ioni, positivi e
negativi. In fase liquida, sotto l’azione di un campo elettrico gli elettroliti
conducono la corrente per migrazione ionica.
Gli elettroliti possono presentare struttura ionica (NaCl, KBr, etc) o
struttura molecolare (HCl, HBr, CH3COOH, etc).
L’elettrolisi, e quindi il passaggio di corrente, avviene solo se la
differenza di potenziale applicata agli elettrodi supera un determinato
valore di soglia, chiamato “potenziale di decomposizione”, dipendente
dal tipo di elettrolita:
I
V
Pot. di soglia
3
Se la differenza di potenziale applicata supera il potenziale di decomposizione,
sulla superficie di separazione tra gli elettrodi e la soluzione iniziano processi di
trasferimento di elettroni:
Processo
catodico:
M z+
+
ze
M
il processo catodico è un processo di riduzione; l’agente riducente è l’elettrodo che
dona elettroni ai cationi.
Processo
anodico:
X z-
X
+
ze
il processo anodico è un processo di ossidazione; l’agente ossidante è l’elettrodo
che sottrae elettroni agli anioni.
4
La conducibilità elettrica di una soluzione elettrolitica dipende dai
seguenti fattori.
- concentrazione degli ioni
- carica degli ioni
- mobilità degli ioni
- temperatura della soluzione
5
Scarica delle specie agli elettrodi
Difficilmente in una soluzione è presente una sola coppia redox.
Allora, quale coppia si scarica per prima agli elettrodi?
Ci si basa sui valori dei potenziali standard di riduzione della coppia
redox ( E°).
Al catodo si scarica per prima la coppia con il potenziale di riduzione
meno negativo (più positivo).
All’anodo si scarica per prima quella che ha il potenziale di riduzione
meno positivo (più negativo).
Fenomeni di SOVRATENSIONE possono invertire l’ordine di scarica.
6
Sovratensione
La sovratensione ha origine cinetica → Sovratensione di attivazione
I processi elettrochimici sono notevolmente lenti e quindi spesso richiedono un aumento
della tensione applicata.
Elettrodo
Pt platinato
Pt liscio
Au
Ag
Cu
Hg
Grafite
sovratensione H2 (V)
0.05
0.67
0.80
1.09
1.25
1.11
1.22
La sovratensione di H2 è trascurabile solo su elettrodo di Pt platinato.
7
Elettrolisi dell’acqua
corrente elettrica
2 H2O
2 H2 (g) + O2 (g)
a) soluzione acida ([H3O+] >> 1,00 10-7 moli l-1)
catodo (-)
anodo (+)
2 H3O+ + 2 e- → H2 (g) + 2 H2O
3 H2O →1/2 O2 (g) + 2 H3O+ + 2 e-
b) soluzione basica ([H3O+] << 1,00 10-7 moli l-1)
catodo (-)
anodo (+)
2 H2O + 2 e- → H2 (g) + 2 OH2 OH- →1/2 O2 (g) + H2O + 2 e-
c) soluzione neutra ([H3O+] = 1,00 10-7 moli l-1)
catodo (-)
anodo (+)
2 H2O + 2 e- → H2 (g) + 2 OH3 H2O →1/2 O2 (g) + 2 H3O+ + 2 e8
Elettrolisi di soluzioni acquose
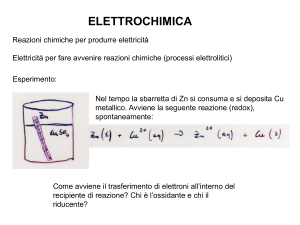
Lo Zn può essere ottenuto per elettrolisi di soluzioni acquose di ZnSO4 (in presenza di H2SO4 per impedire
l’idrolisi degli ioni Zn2+). Come catodo si utilizza un elettrodo di Zn e come anodo un elettrodo di Pb:
catodo (-) Zn :
anodo (+) Pb :
Zn2+ + 2 e- → Zn
3 H2O →1/2 O2 (g) + 2 H3O+ + 2 e-
Al catodo avviene la riduzione degli ioni Zn2+ e non quella degli ioni H3O+ come dovrebbe essere in base ai
valori di E° ( E°Zn2+/Zn = - 0,763 V), ciò è dovuto all’elevata sovratensione di H2 sull’elettrodo di Zn.
All’anodo si ha l’ossidazione di H2O e non dello ione SO42- dato che: E°O2/H2O = 1,23 V; E°S2O8/SO42-= 2,01V
Elettrolisi di sali fusi
Si utilizzano sali fusi per la produzione di metalli come Na, Mg, ecc., (a causa dei loro potenziali di riduzione
negativi non si possono usare soluzioni acquose perché si avrebbe la riduzione di acqua).
Il Na si prepara per elettrolisi di un fuso costituito da NaCl (~40%) e CaCl2 (~60%) a 600 °C.
catodo (-) acciaio :
anodo (+) grafite :
Na+ + e- → Na (l)
2 Cl- → Cl2 (g) + 2 e-
Il Na (l) galleggia sul fuso e viene raccolto su kerosene per evitare il contatto con l’aria o l’umidità (il Na
reagisce rapidamente con ossigeno e violentemente con acqua).
9
L’alluminio metallico viene prodotto per trattamento dell’allumina per via
elettrolitica.
Per mescolamento della criolite, Na3AlF6, con l’allumina si ottiene la fusione della miscela a
circa 930°C (contro i 2050°C dell’allumina pura).
La miscela, allo stato fuso, viene sottoposta ad elettrolisi in una cella avente anodi di
grafite e catodi di acciaio:
reazione catodica:
Al3+ (fus) + 3e- → Al(l)
reazione anodica:
2O2- (fus) + C (s,gr) → CO2 (g) + 4e-
la reazione complessiva è:
4Al3+ (fus) + 6O2- (fus) + 3C (s,gr) → 4Al (l) + 3CO2 (g)
Il processo è condotto a 940-980°C; la produzione di una tonnellata di Al
richiede 1,89 tonnellate di Al2O3, circa 0,45 tonnellate di C (derivante dall’anodo), 0,07 tonnellate
di Na3AlF6 e circa 15000 KWh di energia elettrica.
Si noti che la produzione di una tonnellata di Al è accompagnata dalla formazione diretta
di 1,45 tonnellate di CO2, oltre a quella derivanti eventualmente dalla produzione dell’energia
elettrica necessaria.
È quindi una produzione ad altissimo consumo di energia, che rende importantissimo il
riciclo del metallo; il processo completo di riciclo richiede solo il 5% dell’energia necessaria ad
10
estrarre l’alluminio dalla bauxite.
Leggi di Faraday
La decomposizione elettrolitica è determinata dal passaggio di corrente continua
attraverso la soluzione; la prima legge di Faraday precisa la relazione tra quantità di
corrente fatta passare attraverso la cella e la quantità di elettrolita decomposto:
“La quantità di sostanza che si deposita agli elettrodi è
proporzionale alla quantità di corrente fatta passre attraverso la cella”
La seconda legge di Faraday afferma che:
“Per depositare una mole di un elettrolita monovalente occorrono
96485 coulomb (1 Faraday)”
11
Pile (celle galvaniche)
Energia chimica → Energia elettrica
Pile chimiche: coinvolgono reazioni di ossidoriduzione
Pile di concentrazione: coinvolgono un processo di diluizione
di una soluzione o di espansione di un gas
Me
(+)
Mz+(aq) + z e- → M
.
M → Mz+(aq) + z e-
(-)
+
-
+
Mez+(aq)
+
Semielemento
+
+
Mz+
(aq) +
z
e-
→M
- - - -
-
+
+
+
atomi e cationi del metallo
- anioni dell’elettrolita
- elettroni
+
M → Mz+(aq) + z e-
All’equilibrio: formazione di un doppio strato elettrico all’interfaccia (d.d.p. fra metallo
e soluzione) → potenziale assoluto dell’elettrodo
12
Pila Daniell
eSetto
poroso
Zn
Zn2+(aq) + SO42+(aq)
(+)
(-)
Cu
Zn
Cu2+(aq) + SO42+(aq)
All’interfase metallo-soluzione:
Zn2+(aq) + SO42+(aq)
Zn2+(aq) + 2 e-
→ Zn(s)
Cu2+(aq) + 2 e-
→ Cu(s)
Cu2+(aq) + 2 e- → Cu(s)
Riduzione
Catodo (polo +)
Zn(s) →
Ossidazione
Anodo (polo -)
Zn2+
(aq) +
2
e-
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
V
Ponte
salino
(+)
Cu
Cu2+(aq) + SO42+(aq)
→
(-)
→
V
e-
Zn
Reazione totale della pila
Cu2+(aq)
13
Pila Daniell
Zn(s) + Cu2+(aq)→ Zn2+(aq) + Cu(s)
→
Funzione del SETTO POROSO o del PONTE SALINO
V
(-)
(+)
V
(-)
+
+
+
- - - -
+
-
+
-
+
Zn2+
+
+
+
Anodo (-)
Zn(s) → Zn2+(aq) + 2 e-
-
+
+
+
+
+
-
+
-
SO42-
Catodo (+)
2+
Cu (aq) + 2 e- → Cu(s)
+
+
+
- - - -
(+)
+
-
+
-
+
-
NO3
+
+
+
+
+
+
+
-
+
-
+
-
K+
Movimento di elettroni nel circuito esterno
Migrazione di ioni all’interno della pila
14
Rappresentazione schematica di un semielemento
specie ossidata specie ridotta
ZnZnSO4 (aq, …… M )
Rappresentazione schematica di una pila
A sinistra si indica l’elettrodo (-) e il semielemento dove avviene l’ossidazione a destra il
semielemento dove avviene la riduzione, poi l’elettrodo (+). Il ponte salino viene indicato
Pila Daniell
(-) ZnZnSO4 (aq,…..M) CuSO4 (aq,….M)Cu (+)
Anodo (-): Zn → Zn2+(aq) + 2 eCatodo (+): Cu2+(aq) + 2 e- → Cu
Reazione totale: Zn + Cu2+(aq) → Zn2+(aq) + Cu
15
Tipi di semielementi
Semielementi di prima specie
Sono costituiti da elettrodo metallico immerso in una soluzione elettrolitica
contenente i suoi ioni (pila Daniell); l’equilibrio elettrochimco riguarda il metallo e i
suoi cationi.
Me
Semielemento di
prima specie
Mez+(aq)
16
Semielementi di seconda specie
Sono formati da un elettrodo metallico ricoperto (a contatto) con una fase
solida costituta da un suo sale poco solubile e da una soluzione di un elettrolita
avente l’anione in comune con il sale insolubile.
All’equilibrio elettrochimico partecipa il metallo dell’elettrodo, il sale indisciolto e
l’elettrolita della soluzione.
Esempi di questo tipo di semielementi sono:
-elettrodo ad argento-cloruro di argento
-elettrodo a calomelano
17
Hg2Cl2(s) + n H2O + 2e
AgCl(s) + n H2O + e
2 Hg (l) + 2 Cl- (aq)
Ag (s) + Cl- (aq)
18
Semielementi redox
Sono costituiti da una coppia redox di ossidoriduzione, entrambe le
specie sono in soluzione e sono caratterizzate dall’equilibrio di scambio
elettronico fra i due membri della coppia; nella soluzione è immerso un
elettrodo inerte che ha solo la funzione di tasportare gli elettroni:
Fe 3+ (aq)
+
e
Fe 2+ (aq)
Semielementi a gas
Sono costituti da un elettrodo metallico inerte (Pt, Au) a contatto con
un gas e immerso in una soluzione elettrolitica contenente l’anione o il
catione corrispondente al gas (semielementi ad idrogeno, ad ossigeno, a
cloro). L’elettrodo adsorbe il gas, il quale partecipa all’equilibrio con un’altra
specie presente in soluzione:
½ Cl 2 (g) +
nH2O
+
e
Cl – (aq)
elettrodo a cloro
19
H3O+ (aq) + e
½ H2 (g) + n H2O
20
OX
RED
21
La serie elettrochimica dei potenziali standard di riduzione (25°C)
Semireazione
E° (V)
Semireazione
E° (V)
F2(g) + 2e- ⇔ 2F-
+2.87
2H+(aq) + 2e- ⇔ H2(g)
0.00
PbO2(s) + SO42-(aq) + 4H+ + 2e- ⇔ PbSO4(s) + H2O
+1.69
Sn2+(aq) + 2e- ⇔ Ni(s)
-0.14
2HOCl(aq) + 2H+(aq) + 2e- ⇔ Cl2(g) + 2H20
+1.63
-0.25
MnO4-(aq) + 8H+(aq) + 5e- ⇔ Mn2+(aq) + 4H20
Ni2+(aq) + 2e- ⇔ Ni(s)
+1.51
Co2+(aq) + 2e- ⇔ Co(s)
-0.28
PbSO4(s) + 2e- ⇔ Pb(s) + SO42-(aq)
-0.36
Cd2+(aq) + 2e- ⇔ Cd(s)
-0.40
Fe2+(aq) + 2e- ⇔ Fe(s)
-0.44
Cr3+(aq) + 3e- ⇔ Cr(s)
-0.74
Zn2+(aq) + 2e- ⇔ Zn(s)
-0.83
PbO2(s) +
4H+(aq)
⇔
+ 2H2O
+1.46
BrO3-(aq) + 6H+(aq) + 6e- ⇔ Br-(aq) + 3H2O
+1.44
Au3+(aq)
+
Cl2 (g) +
2e-
O2(g) +
3e-
+
2e-
Pb2+(aq)
⇔ Au(s)
⇔
4H+(aq)
Cl-(aq)
+
4e-
⇔ 2H2O
+1.42
+1.36
+1.23
Br2 (aq) + 2e- ⇔ 2Br-(aq)
+1.07
NO3-(aq) + 4H+(aq) + 3e- ⇔ NO(g) + 2H2O
+0.96
2H2O(aq) + 2e- ⇔ H2(g) + 2OH-(aq)
-1.66
Ag+(aq) + e- ⇔ Ag(s)
+0.80
Mg2+(aq) + 2e- ⇔ Mg(s)
-2.37
Fe3+(aq) + e- ⇔ Fe2+(aq)
+0.77
Na+(aq) + e- ⇔ Na(s)
-2.71
I2(s) + 2e- ⇔ 2I-(aq)
+0.54
Ca2+(aq) + 2e- ⇔ Ca(s)
-2.76
NiO2(aq) + 4H+(aq) + 3e- ⇔ Ni(OH)2(s) + 2OH-(aq)
+0.49
K+(aq) + e- ⇔ K(s)
-2.92
Cu2+(aq) + 2e- ⇔ Cu(s)
+0.34
Li+(aq) + e- ⇔ Li(s)
-3.05
SO42-(aq) + 4H+(aq) + 2e- ⇔ H2SO3(aq) + H2O
+0.17
22
Forza elettromotrice di una pila
Forza elettromotrice (f.e.m., E) di una pila: differenza di potenziale (d.d.p.) massima che
può esistere tra i due elettrodi di quella pila, cioè a circuito aperto e quindi quando NON vi
è circolazione di corrente
(per la misura della f.e.m. di una pila si utilizza un circuito potenziometrico)
La f.e.m. di una pila è per definizione una grandezza POSITIVA ed è correlata al potenziale
(assoluto) di ciascun semielemento dalla relazione:
E = ECatodo - EAnodo = EC - EA
EC > EA →
il catodo (semireazione di riduzione) si trova ad un potenziale
maggiore rispetto all’anodo.
23
24
Elettrodo standard (o normale) ad idrogeno
Il valore assoluto del potenziale di un semielemento (espresso dall’equazione
di Nernst) non può essere misurato sperimentalmente.
È necessario scegliere un elettrodo di riferimento a cui assegnare
arbitrariamente un valore al potenziale standard.
Elettrodo standard (o normale) ad idrogeno (ESI):
H3O+ (aq, 1 M) H2 (g, 1 atm) Pt
2 H3O+ (aq) + 2e- → H2(g) + 2 H2O
→
EH O+ / H = 0
3
2
(PH = 1, [H3O+] = 1)
2
L’elettrodo standard ad idrogeno è reversibile, dato che in una pila può comportarsi da catodo o da anodo.
25
La serie elettrochimica dei potenziali standard
• I valori sono tabulati come potenziali standard di riduzione; ogni semireazione
elettrodica è riportata come riduzione.
• Il potenziale standard di riduzione di una certa coppia redox indica la capacità di questa
coppia a comportarsi da ossidante o da riducente rispetto alla coppia H3O+/H2.
• Lo stesso criterio può essere facilmente esteso a qualsiasi altra coppia redox,
confrontando i relativi potenziali standard.
• Calcolo immediato della f.e.m. standard (E°) di una cella formata da due semielementi
qualsiasi.
(-) ZnZn2+(aq, 1M)Cu2+(aq, 1 M)Cu (+)
E° = E°C-E°A = E°Cu2+/Cu-E°Zn2+/Zn = +0.337 - (-0.763) = +1.100 V
26
La corrosione dei metalli
Insieme di fenomeni chimici che risultano nella degradazione di un metallo
(peggioramento delle proprietà chimiche e fisiche). Alla base c’è sempre un processo di
ossidazione del metallo che si corrode.
Corrosione di origine chimica: azione di sostanze come: CO, CO2, SO2, H2S, NH3,
H2SO4, HNO3, ecc.
Corrosione dovuta alle correnti elettriche vaganti nel terreno; l’acqua e i sali
funzionano come elettroliti, fenomeni di elettrolisi nei quali le strutture metalliche
interrate fungono da elettrodi.
Fenomeni di corrosione dovuti alla presenza contemporanea di ossigeno e acqua.
27
La corrosione dei metalli
28
La corrosione dei metalli
In generale, metalli con potenziale di riduzione molto alto resistono molto bene alla
corrosione (Cu, E° = 0.337 V; Au, E° = 1.42 V).
Alcuni metalli che hanno un potenziale di riduzione molto negativo (Al, E° = - 1.66 V;
Ti, E° = - 0.89 V; Cr, E° = - 0.74 V) resistono meglio alla corrosione di altri metalli che
hanno un E° molto meno negativo (Fe, E° = - 0.45 V).
Questo diverso comportamento è dovuto al fatto che questi metalli a contatto con
l’atmosfera si ricoprono rapidamente, per inizio della corrosione, di un sottilissimo velo di
ossido, molto aderente, insolubile che costituisce una barriera..
Questo fenomeno è chiamato PASSIVAZIONE DEI METALLI.
29
La corrosione dei metalli
Condizioni per la PASSIVAZIONE:
• E° molto negativo, rapida corrosione iniziale del metallo;
• formazione di uno strato molto sottile di ossido, insolubile e poco
reattivo (barriera cinetica)
• dimensioni reticolari dell’ossido poco diverse (10-15%) da quelle del
metallo: buona adesione tra strato di ossido e metallo.
•Passivazione spontanea: migliore protezione contro la corrosione
30
Corrosione galvanica
31
La corrosione per aerazione differenziale
32
Riepilogo del meccanismo di corrosione
33
Protezione dalla corrosione
Esistono numerose tecniche per proteggere i metalli (Fe) dalla corrosione:
Rivestimenti con strati impermeabili (vernici, materie plastiche, vetro, ecc.); lo strato non deve
presentare difetti.
Elettrodeposizione: si forma un rivestimento con un metallo avente E° più negativo (Zn, Cr, Ni)
che tende a passivarsi. Con metalli aventi E° maggiore del Fe, lo strato deve essere assolutamente
continuo per evitare la corrosione galvanica.
Corrente impressa: l’oggetto di Fe da proteggere è collegato al polo (-) di una sorgente esterna di
corrente continua mentre un altro blocco di lega ferrosa è collegato al polo (+). L’oggetto di Fe
funziona da catodo di una cella elettrolitica e quindi non si ossida
Protezione catodica: l’oggetto di Fe viene collegato ad un altro metallo avente E° più negativo
(es. Mg) che si comporta da anodo sacrificale ossidandosi al posto del Fe.
34
Protezione dalla corrosione
35