Tipi di conduttori
Conduttori elettronici o di prima specie: a conduzione elettronica,
senza trasporto di materia (metalli, leghe, grafite, …)
Conduttori elettrolitici o di seconda specie: a conduzione ionica,
con trasporto di materia (elettroliti)
Elettroliti
Composti a struttura ionica
In solventi
Dissociazione completa
polari (H2O, ecc.)
(NaCl, CuSO4, ecc.)
o parziale in ioni positivi
Composti a struttura covalente
e ioni negativi
Puri in fase liquida
(HCl, NH3, ecc.)
Elettroliti forti Dissociazione completa (acidi e basi forti, sali)
Elettroliti deboli Dissociazione parziale (acidi e basi deboli)
Grado di dissociazione
ndissociate
n totali
Pila Daniell
e-
e-
V
(+)
Setto
poroso
Zn
Zn2+(aq) + SO42+(aq)
(-)
Cu
Zn
Cu2+(aq) + SO42+(aq)
Zn2+(aq) + SO42+(aq)
All’interfase metallo-soluzione:
Ponte
salino
(+)
Cu
Cu2+(aq) + SO42+(aq)
Zn2+(aq) + 2 e- Zn(s)
(-)
V
Cu2+(aq) + 2 e- Cu(s)
Cu2+(aq) + 2 e- Cu(s)
Riduzione
Catodo (polo +)
Zn(s)
Ossidazione
Anodo (polo -)
Zn2+
(aq) +
2
e-
Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s)
Zn
Reazione totale della pila
Cu2+(aq)
Pila Daniell
Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s)
All’equilibrio G = 0
Il sistema non è più in grado di compiere LAVORO
La pila è SCARICA
Funzione del SETTO POROSO o del PONTE SALINO
V
(-)
(+)
V
(-)
+
+
+
- - - -
+
-
+
-
+
+
+
Zn
+
2+
Anodo (-)
Zn(s) Zn2+(aq) + 2 e-
-
+
+
+
+
+
-
+
-
SO42-
Catodo (+)
2+
Cu (aq) + 2 e- Cu(s)
+
+
+
- - - -
(+)
+
-
+
+
-
+
+
-
+
NO3-
K+
+
+
+
+
+
-
+
-
Movimento di elettroni nel circuito esterno
Migrazione di ioni all’interno della pila
Tipi di semielementi
Semielementi di PRIMA SPECIE: elettrodo metallico immerso in una soluzione
elettrolitica contenente i suoi ioni (pila Daniell)
Semielementi di SECONDA SPECIE: elettrodo metallico a contatto con una fase
solida formata da un sale poco solubile del metallo e con una soluzione
elettrolitica avente l’anione in comune con il sale poco solubile (elettrodi a calomelano
e ad argento-cloruro d’argento)
Semielementi A GAS: elettrodo inerte (Pt, Au) a contatto con un gas e immerso
in una soluzione elettrolitica contenente l’anione o il catione corrispondente al gas
(elettrodi ad idrogeno e ad ossigeno)
Pt
H2(s)
Ag
Me
Cl-(aq)
AgCl(s
Mez+(aq
)
H3O+(aq)
)
Prima specie
Seconda specie
A gas
Rappresentazione schematica di un semielemento
ZnZn2+(aq, aZn2+) CuCu2+(aq, aCu2+) PtH2(g, aH2) H3O+(aq, aH30+)
Rappresentazione schematica di una pila
Per sistemi ideali: ai = Ci
ai = Pi
ZnZn2+(aq, a1)Cu2+(aq, a2)Cu
Anodo (-): Zn Zn2+(aq) + 2 eCatodo (+): Cu2+(aq) + 2 e- Cu
Reazione totale: Zn + Cu2+(aq) Zn2+(aq) + Cu
ZnZn2+(aq, a1) H3O+(aq, a2)H2(g, P1)Pt
Anodo (-): Zn Zn2+(aq) + 2 eCatodo (+): 2 H3O+(aq) + 2 e- H2(g) + 2 H2O
Reazione totale: Zn + 2 H3O+(aq) Zn2+(aq) + H2(g) + 2 H2O
Forza elettromotrice di una pila
Forza elettromotrice (f.e.m., E) di una pila: differenza di potenziale della pila
misurata agli elettrodi quando NON vi è circolazione di corrente
E = V(I0)
(per la misura della f.e.m. di una pila si utilizza un circuito potenziometrico)
La f.e.m. di una pila è per definizione una grandezza POSITIVA ed è correlata
al potenziale (assoluto) di ciascun semielemento dalla relazione:
E = ECatodo - EAnodo = EC - EA
EC > EA
il catodo (semireazione di riduzione) si trova ad un potenziale
maggiore rispetto all’anodo
Potenziale standard di un semielemento
Potenziale standard di un semielemento: potenziale del semielemento quando
le attività dei componenti della coppia redox sono unitarie.
Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s)
E Zn2 / Zn E Zn2 / Zn ECu2 /Cu ECu2 /Cu
Zn(s) Zn2+(aq) + 2 eCu2+(aq) + 2 e- Cu(s)
Anodo (ossidazione)
Catodo (riduzione)
0.0591
a
0.0591
1
Log Zn E Zn2 / Zn Log
2
a Zn2
2
a Zn2
0.0591
a
0.0591
1
Log Cu ECu2 / Cu Log
2
aCu2
2
aCu2
f.e.m. della pila
E E C E A E Cu2 /Cu E Zn2 / Zn
E Cu2 / Cu E Zn2 / Zn
a 2
0.0591
Log Zn
2
aCu2
(T=25°C)
f.e.m. standard della pila
E E ECu2 /Cu EZn2 / Zn
quando aCu2 aZn2 1
Elettrodo standard (o normale) ad idrogeno
Il valore assoluto del potenziale di un semielemento (espresso dall’equazione
di Nernst) non può essere misurato sperimentalmente.
È necessario scegliere un elettrodo di riferimento a cui assegnare
arbitrariamente un valore al potenziale standard.
Elettrodo standard (o normale) ad idrogeno (ESI):
H2(g) + 2H2O
2H3O+ (aq) + 2e-
EH O /H E H O / H
3
a
H2
2
3
2
aH2 aH22O
0.0591
Log 2
E H O / H 0
3
2
2
aH O
= aH2O = aH O 1
3
3
La serie elettrochimica dei potenziali standard
Con l’assunzione del riferimento per l’ESI si può determinare il potenziale
standard di un qualsiasi semielemento costituito da una coppia Oss/Rid,
accoppiando l’ESI con il semielemento, in condizioni standard e misurando
la f.e.m. della pila così ottenuta.
PtH2(g, P =1 atm)H3O+(aq, a=1)Zn2+(aq, a=1)Zn
E°cella=0.763 V
Il polo negativo (anodo) è l’elettrodo
di zinco E°Zn2+/Zn = -0.763 V
PtH2(g, P =1 atm)H3O+(aq, a=1)Cu2+(aq, a=1)Cu
E°cella=0.337 V
Il polo positivo (catodo) è l’elettrodo
di rame E°Cu2+/Cu = +0.337 V
La serie elettrochimica dei potenziali standard (25°C)
Semireazione
E° (V)
Semireazione
E° (V)
F2(g) + 2e- 2F-
+2.87
2H+(aq) + 2e- H2(g)
0.00
+1.69
Sn2+(aq) + 2e- Ni(s)
-0.14
+1.63
Ni2+(aq) + 2e- Ni(s)
-0.25
+1.51
Co2+(aq) + 2e- Co(s)
-0.28
+ 2H2O
+1.46
-0.36
+ 3H2O
+1.44
PbSO4(s) + 2e- Pb(s) + SO42-(aq)
Cd2+(aq) + 2e- Cd(s)
-0.40
Fe2+(aq) + 2e- Fe(s)
-0.44
Cr3+(aq) + 3e- Cr(s)
-0.74
+1.07
Zn2+(aq) + 2e- Zn(s)
-0.83
NO3-(aq) + 4H+(aq) + 3e- NO(g) + 2H2O
+0.96
2H2O(aq) + 2e- H2(g) + 2OH-(aq)
-1.66
Ag+(aq) + e- Ag(s)
+0.80
Mg2+(aq) + 2e- Mg(s)
-2.37
Fe3+(aq) + e- Fe2+(aq)
+0.77
Na+(aq) + e- Na(s)
-2.71
I2(s) + 2e- 2I-(aq)
+0.54
Ca2+(aq) + 2e- Ca(s)
-2.76
NiO2(aq) + 4H+(aq) + 3e- Ni(OH)2(s) + 2OH-(aq) +0.49
K+(aq) + e- K(s)
-2.92
Cu2+(aq) + 2e- Cu(s)
+0.34
Li+(aq) + e- Li(s)
-3.05
SO42-(aq) + 4H+(aq) + 2e- H2SO3(aq) + H2O
+0.17
PbO2(s) + SO42-(aq) + 4H+ + 2e- PbSO4(s) + H2O
2HOCl(aq) + 2H+(aq) + 2e- Cl2(g) + 2H20
-
8H+(aq)
MnO4 (aq) +
PbO2(s) +
-
4H+(aq)
BrO3 (aq) +
3e-
Au3+(aq)
+
Cl2
2e-
(g)
+
+
+
6H+(aq)
5e-
2e-
+
6e-
Pb2+(aq)
Br-
(aq)
+ 4H20
Au(s)
Cl-
(aq)
4e-
2H2O
O2(g) +
4H+(aq)
Br2
+ 2e- 2Br-(aq)
(aq)
Mn2+(aq)
+
+1.42
+1.36
+1.23
La serie elettrochimica dei potenziali standard
• I valori sono tabulati come potenziali standard di riduzione; ogni semireazione
elettrodica è riportata come riduzione
• Il potenziale standard di riduzione di una certa coppia redox indica la capacità
di questa coppia a comportarsi da ossidante o da riducente rispetto alla coppia
H3O+/H2
• Lo stesso criterio può essere facilmente esteso a qualsiasi altra coppia redox,
confrontando i relativi potenziali standard
• Calcolo immediato della f.e.m. standard (E°) di una cella formata da due
semielementi qualsiasi
(-) ZnZn2+(aq, a=1)Cu2+(aq, a=1)Cu (+)
E° = E°C-E°A = E°Cu2+/Cu-E°Zn2+/Zn = +0.337 - (-0.763) = +1.100 V
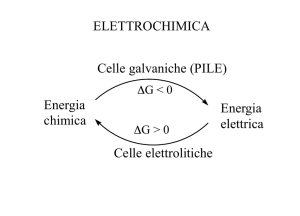
Elettrolisi
Legge di Ohm
V RI
Energia elettrica Energia chimica
Cella elettrolitica
conduttore
di prima specie
conduttore di
seconda specie
Potenziale di
decomposizione
Anodo: elettrodo positivo
(reazione di ossidazione)
Catodo: elettrodo negativo
(reazione di riduzione)
Scarica delle specie agli elettrodi
Difficilmente in una soluzione è presente una sola coppia
redox. Allora, quale coppia si scarica per prima agli
elettrodi?
Al catodo si scarica per prima la coppia con in potenziale
di riduzione più alto
All’anodo si scarica per prima quella che ha il potenziale di
riduzione più basso
Prevale il PROCESSO che avviene con la minor spesa di Lel
Scarica delle specie agli elettrodi
Soluzione acquosa di CuSO4 (1 M)
Cu2+, SO42-, H3O+, OHCu2+(aq) + 2 e- Cu(s)
E = 0.337 V
E E Cu2 / Cu
0.0591
LogaCu2
2
aCu2 1
potenziale di riduzione più alto
2H3O+
(aq)
+ 2e- H2(g) + 2H2O
E E H O / H
3
2
aH2 = 1
E = - 0.413 V
aH O 10 7
3
aH2
0.0591
Log 2
2
a
H3O
Scarica delle specie agli elettrodi
Soluzione acquosa di CuSO4(1 M)
Cu2+, SO42-, H3O+, OH-
4 OH-(aq) O2 (g)+ 4 e- + 2H2O
4
E E O
potenziale di riduzione più basso
E = 1.72 V
/OH
aO2 = 1
E = 0.814 V
2SO42-(aq) S2O82- (aq) + 2e-
2
a
0.0591
Log OH
4
a O2
aOH 10 7
E E S O2 / SO2
2
8
aS O2 = 10
2
8
aSO2 1
4
4
-10
a2SO2
0.0591
4
Log
2
aS O2
2
8
Leggi di Faraday
Quantità di elettrolita formato o decomposto agli elettrodi
Quantità di carica elettrica transitata attraverso la cella elettrolitica
Prima Legge di Faraday
La quantità di una sostanza formata o decomposta ad un elettrodo è
proporzionale alla quantità di carica elettrica che ha attraversato la cella
durante l’elettrolisi.
m e el q e el I t
eel: equivalente elettrochimico dell’elettrolita considerato (quantità in grammi
ottenuta per il passaggio di 1 coulomb di carica elettrica attraverso la cella)
Seconda Legge di Faraday
Leggi di Faraday
Per una stessa quantità di carica elettrica , le quantità delle specie chimiche
formate o decomposte agli elettrodi sono proporzionali ai loro pesi equivalenti
Meq (M/n).
Faraday (F): quantità di carica corrispondente ad una mole di elettroni
1 F = (6.022•1023)(e-/mol) (1.602•10-19)(C/e-)= 96485 C/mol
Esempio: elettrolisi CuSO4 in H20
Catodo: Cu2+(aq) + 2 e- Cu(s)
1 mol di Cu(s) occorrono 2 mol di e- (2 F)
Anodo: 6 H20 O2(g) + 4 e- + H30+(aq)
1 mol di O2(g) occorrono 4 mol di e- (4 F)
Il passaggio di 1 F comporta la formazione di 1/2 mol di Cu(s) (63.5/2 g)
e di 1/4 mol di O2(g) (32/4 g)
e el
M eq
M eq
1F
M
m e el q
I t
I t
1F
nF