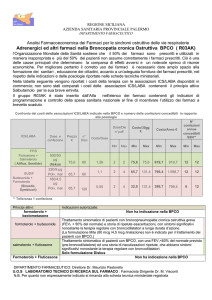
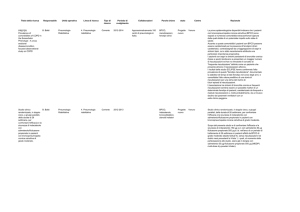
Il trattamento farmacologico stabile
Il trattamento farmacologico stabile nella BPCO ha l’obiettivo di ridurre o abolire i sintomi,
migliorare la capacità di esercizio fisico e diminuire la frequenza e la gravità delle
riacutizzazioni, migliorando così lo stato globale di salute e la qualità di vita di questi
pazienti. Molti aspetti del trattamento della malattia possono essere standardizzati, ma
ogni paziente può avere caratteristiche diverse dagli altri. L’approccio terapeutico
dovrebbe essere personalizzato su ogni singolo paziente non tralasciando di considerare
la gravità della malattia, che deve essere valutata non solo sulla quantificazione del dato
funzionale respiratorio di ostruzione del flusso nelle vie aeree, ma anche sulla qualità e
intensità dei sintomi percepiti dal paziente e l’impatto che possono avere sulla qualità di
vita, sulla frequenza delle riacutizzazioni e sulla presenza di complicazioni sistemiche e/o
comorbidità.1-2
I Broncodilatatori
I broncodilatatori rappresentano il cardine del trattamento nei pazienti con BPCO.1-2 I
farmaci appartenenti a questa classe attualmente disponibili sono rappresentati dai beta2agonisti a lunga durata d’azione (LABA) e a breve durata d’azione (SABA), dagli
anticolinergici a lunga durata d’azione (LAMA) e a breve durata d’azione (SAMA) e dalla
teofillina a lento rilascio. Questi farmaci migliorano il calibro delle vie aeree riducendo
l’iperinsufflazione polmonare e le resistenze a carico delle vie aeree migliorando,
attraverso questi meccanismi, i sintomi, la tolleranza allo sforzo e la qualità della vita dei
pazienti con BPCO. L’uso regolare dei broncodilatatori a lunga durata d’azione è inoltre in
grado di ridurre la frequenza delle riacutizzazioni nella BPCO, uno dei principali eventi
clinici che caratterizzano la storia naturale della malattia. Possono essere prescritti sia al
bisogno che in maniera regolare con la finalità di alleviare e/o prevenire i sintomi
respiratori e la scelta a del trattamento dipende sia dalla disponibilità dei farmaci che dalla
risposta individuale sia in termini di efficacia che di effetti collaterali.1-3
Broncodilatatori per via inalatoria a breve durata di azione
Beta-2 agonisti (SABA)
Fanno parte di questa categoria di farmaci il salbutamolo, il fenoterolo e la terbutalina. Tali
farmaci agiscono sui recettori beta-2 adrenergici del muscolo liscio bronchiale
determinando aumento del calibro delle vie aeree e riducendo di conseguenza la dispnea
e migliorando la qualità di vita dei pazienti, mentre determinano solo un modesto
miglioramento della funzionalità respiratoria.4 La broncodilatazione ottenuta è rapida e la
durata d’azione massima è di 4-6 ore, pertanto sono prevalentemente indicati come
farmaci al bisogno in tutti gli stadi della malattia.
Gli effetti collaterali provocati da tali farmaci, più o meno rilevanti, dipendono molto
dell’età e dalle comorbidità presenti nei pazienti affetti da BPCO. Uno degli effetti
collaterali più frequenti in relazione al loro uso è sicuramente la comparsa di episodi di
tremore degli arti e/o di tachicardia dose-dipendente. Altri effetti collaterali legati al loro
utilizzo sono l’ipokaliemia5 e l’aumento del consumo di ossigeno6 ma comunque non è
stata dimostrata alcuna responsabilità di questi farmaci riguardo all’aumento della
mortalità nella BPCO.
Anticolinergici (SAMA)
Fanno parte di questa categoria di farmaci l’ipratropio bromuro e l’ossitropio bromuro. Tali
farmaci
agiscono
bloccando
l’azione
dell’acetilcolina
sui
recettori
colinergici
e
determinando di conseguenza broncodilatazione, riduzione della dispnea ed una migliore
qualità di vita per i pazienti affetti da BPCO. La durata di azione di questi farmaci è un po'
più lunga di quella dei SABA ed è di circa 8 ore. 7 Gli effetti collaterali provocati da tali
farmaci possono essere secchezza delle fauci, possibili disturbi prostatici ed talvolta effetti
negativi in portatori di glaucoma acuto.
Associazioni con i broncodilatatori a breve durata d’azione
La somministrazione combinata di due broncodilatatori a breve durata di azione con
meccanismo di azione differenziato (beta-2 adrenergico e anticolinergico) determina una
maggiore variazione positiva dei parametri spirometrici rispetto a ognuno dei due
componenti da soli, una minore necessità di SABA al bisogno e un miglioramento della
qualità di vita.8
Broncodilatatori per via inalatoria a lunga durata di azione
Beta due agonisti a lunga durata d’azione (LABA)
I broncodilatatori beta-2 adrenergici a lunga durata di azione attualmente disponibili sono
formoterolo, salmeterolo e indacaterolo. Vari studi di confronto negli anni hanno dimostrato
che tali farmaci migliorano la funzionalità respiratoria, riducono la dispnea, e la necessità
di SABA al bisogno, migliorando pertanto la qualità di vita nei pazienti affetti da BPCO.
Inoltre è stato dimostrato che l’uso regolare di broncodilatatori a lunga durata d’azione
riduce l’incidenza di riacutizzazioni nella storia naturale di questa patologia. 9-11
L’effetto dei LABA è di durata maggiore rispetto ai SABA. La durata d’azione è di
circa 12 ore per il formoterolo e il salmeterolo e di più di 24 ore per indacaterolo. In
particolare Indacaterolo ha mostrato in recenti studi un’azione broncodilatatrice più rapida
che si sviluppa entro 5 minuti dall’inalazione e una superiorità come LABA in termini di
funzionalità respiratoria, qualità di vita e controllo della dispnea, rispetto al Formoterolo 12 e
al Salmeterolo13
Anticolinergici a lunga durata d’azione (LAMA)
Gli anticolinergici a lunga durata d’azione hanno una maggiore selettività per i recettori
colinergici M3, che sono localizzati nel polmone sulla muscolatura liscia bronchiale, a
livello endoteliale e sulle ghiandole mucipare sottomucose e mediano la broncocostrizione,
la produzione di muco e la vasodilatazione. Tali farmaci agiscono riducendo il tono vagale
colinergico che è aumentato nelle vie aeree del paziente con BPCO e determinando
pertanto broncodilatazione.14
I LAMA attualmente disponibili sono il tiotropio bromuro, il glicopirronio e
l’aclidinium.
Il tiotropio bromuro ha una durata di azione superiore alle 24 ore e agisce
antagonizzando competitivamente e reversibilmente soprattutto i recettori colinergici M1 e
M3, ma anche gli M2 da cui però si dissocia più rapidamente. Il suo uso regolare migliora
la funzione respiratoria valutata in termini di FEV1 e FVC, riduce i sintomi respiratori e la
necessità di SABA al bisogno e migliora la qualità di vita dei pazienti affetti da BPCO 15-17.
Inoltre revisioni sistematiche18 hanno dimostrato che il tiotropio è in grado di ridurre
significativamente il rischio di riacutizzazione e di ricovero per questa causa rispetto al
placebo e dell’ipratropio bromuro, ma non diversamente dai LABA, in pazienti con BPCO
da moderata a grave. Nello studio Upflit17, durato quattro anni, che ha coinvolto un totale
di quasi seimila pazienti BPCO è stato a sua volta confermata l’efficacia del tiotropio, nei
confronti del placebo, nel migliorare la funzionalità respiratoria e la qualità della vita e nel
ridurre l’incidenza delle riacutizzazioni e dei ricoveri correlati a tale patologia, sebbene non
si sia dimostrata una riduzione statisticamente significativa del declino del FEV1 funzione
respiratoria che si ha nella BPCO. Per quanto riguarda gli effetti collaterali della
somministrazione di tiotropio, nei vari studi gli eventi avversi sono risultati paragonabili a
quelli registrati nei soggetti di controllo che non assumevano tiotropio.
Tra l’altro il recentissimo studio Tiospir, uno dei più ampi studi internazionali mai
condotti, ha confermato l’equivalenza, in termini di sicurezza e di efficacia, per entrambe le
formulazioni disponibili di tiotropio, tiotropio handihalear 18 µg 1 erogazione o.d. e tiotropio
respimat 2.5µg due erogazoni o.d.19
Il glicopirronio, altro LAMA approvato dall’EMEA nel 2012, mostra una spiccata
selettività per i recettori M3 rispetto gli M2 (quattro volte maggiore) ed è in grado di
raggiungere una concentrazione plasmatica di picco (C max) entro 5 minuti
dall’assunzione del farmaco. Il glicopirronio ha una lunga durata d’azione (24 ore) con una
sola somministrazione giornaliera. In due importanti studi di fase III randomizzati 20-21 e
controllati con placebo e con tiotropio22, è stata dimostrata la superiorità di glicopirronio
versus placebo in termini di miglioramento della funzionalità respiratoria, sia per quanto
concerne l’end point primario (trough FEV1) che per quanto concerne gli end point
secondari funzionali. Inoltre si è riscontrato un miglioramento statisticamente significativo
per quanto concerne il SGRQ e il TDi rispetto placebo. Nei trial clinici il glicopirronio ha
diminuito l’uso di farmaci al bisogno e ha ridotto in maniera statisticamente significativa il
rischio di riacutizzazioni moderate severe del 34% (p= 0.001) di rispetto placebo. Infine
nello studio GLOW III23, questo nuovo LAMA ha mostrato miglioramenti significativi
rispetto placebo in termini di tolleranza all’esercizio dopo 3 settimane di trattamento.
Anche per questo la maggior parte degli eventi avversi sono risultati di lieve –moderata
gravità. L’incidenza di eventi avversi anticolinergici e cardiaci è risultata bassa e simile al
gruppo placebo.
Aclidinio è un anticolinergico a lunga durata d’azione approvato nel luglio 2012 per
la terapia dei paziente BPCO. Il dosaggio raccomandato è 400µg t.d. Questa nuova
molecola ha mostrato una maggiore selettività per i recettori M3 rispetto agli M2
determinando un significativo effetto broncodilatatore con un numero non significativo di
effetti avversi cardiovascolari. La bronco dilatazione viene ottenuta già dopo 10-15 minuti
dall’assunzione del farmaco e due recenti studi, ATTAIN
24
e ACCORD COPD I
25,
hanno
di fatto dimostrato l’efficacia della molecola in termini di broncodilatazione e controllo della
dispnea nonché nel miglioramento della qualità di vita rispetto placebo nei pazienti con
BPCO da moderata e grave. Inoltre l’analisi combinata dei due studi di fase III sopra citati
ha evidenziato che aclidinium ha diminuito in maniera significativa le esacerbazioni
moderate-severe del 29 % (p=0.01) Il farmaco inoltre è risultato ben tollerato e la maggior
parte degli eventi avversi sono risultati di lieve–moderata gravità. L’incidenza di eventi
avversi anticolinergici e cardiaci è risultata bassa e simile al gruppo placebo.
Broncodilatatori per via orale: Metilxantine a lento rilascio
Oltre al rilascio del muscolo liscio bronchiale, i teofillinici, in genere somministrati
come formulazioni orali a lento rilascio, possono aumentare la forza di contrazione del
diaframma, interferire positivamente con la clearance delle vie aeree e aumentare l’output
cardiaco, con benefici per lo stato di salute nei pazienti con BPCO, ma il loro margine
terapeutico è piuttosto ristretto a causa della potenziale tossicità e delle interazioni con
altri farmaci, per cui essi debbono essere considerati di seconda scelta nel trattamento
della fase stabile della malattia. Le metilxantine possono essere indicate solamente nei
pazienti che rimangono sintomatici nonostante la terapia con broncodilatatori inalatori. 1-2
Inibitori delle fosfodiesterasi 4 (PDE-4)
Questa categoria di farmaci agisce aumentando la concentrazione cellulare
dell’AMP ciclico e riducendo l’infiammazione bronchiale. Roflumilast è il primo inibitore
della fosfodiesterasi 4 approvato dall’EMEA, è un farmaco orale in monosomministrazione
giornaliera, che pur non avendo una azione broncodilatatrice diretta, migliora la
funzionalità respiratoria (FEV1 e FVC) sia in pazienti non trattati con broncodilatatori 26 che
in pazienti in trattamento con salmeterolo e tiotropio27. Al momento è indicato nel
trattamento di pazienti BPCO in stadio III – in stadio IV, con storia di bronchite cronica e
frequenti riacutizzazioni poiché, oltre ad esplicare un’azione antiinfiammatoria, riduce le
riacutizzazione nei pazienti BPCO con tali caratteristiche. Tuttavia la terapia con tale
farmaco è associata a significativi effetti collaterali, in particolare diarrea, perdita di peso. 12
Corticosteroidi
Il documento GOLD e le linee guida AGENAS sconsigliano la somministrazione dei soli
corticosteroidi inalatori
nella BPCO e vengono raccomandati solo in combinazione con
broncodilatatori a lunga durata d’azione nei pazienti BPCO 1-2. Le associazioni al momento
a disposizione per il trattamento della BPCO sono fluticasone/salmeterolo e budesonide
/formoterolo.
I dati più solidi, sui quali si basano le attuali indicazioni delle linee guida si basano su
numerosi studi nei quali gli steroidi inalatori sono stati studiati in associazione con i LABA
e confrontati con i singoli monocomponenti (ICS e LABA) ed il placebo. Tra i primi Mahler
e coll28 hanno evidenziato che il trattamento con l’associazione fluticasone propionato e
salmeterolo somministrati con lo stesso erogatore induceva un incremento della
funzionalità respiratoria maggiore di quello indotto dagli stessi farmaci somministrati
singolarmente. Analoghi risultati a favore della combinazione sono stati anche evidenziati
in altri studi in cui l’associazione salmeterolo 50 μg/fluticasone 500 μg, era in grado di
incrementare maggiormente la funzione respiratoria e di ridurre i sintomi e il numero di
riacutizzazioni di più rispetto al trattamento con ì singoli componenti somministrati da soli
nei pazienti con BPCO29.
Tuttavia la nuova prospettiva per il trattamento della BPCO nasce con lo studio TORCH
(Towards a Revolution in COPD Health)30. Nessun studio sino ad allora aveva valutato
l’effetto della terapia inalatori nella BPCO sui parametri fondamentali della malattia, come
la mortalità. Lo studio TORCH è stato condotto per valutare se il trattamento con
la combinazione salmeterolo 50 μg più fluticasone propionato μg, due volte al giorno
riducesse la mortalità per qualsiasi causa nei pazienti affetti da BPCO, rispetto al placebo.
Nello
studio
è
stato
comparato
il
trattamento
con salmeterolo
50
mcg più
fluticasone propionato 500 mcg (in regime di combinazione) con ciascuno dei componenti
dell’associazione somministrati singolarmente e con il placebo per ha valutato per
un periodo di 3 anni in pazienti BPCO con VEMS pre-broncodilatatore < 60%. Il dato più
rilevante riguarda la riduzione del rischio di mortalità relativa che è del 17.5% nel gruppo in
trattamento con l’associazione rispetto al placebo, ancorché ai limiti della significatività
statistica (P=0.052). Tale riduzione del rischio di mortalità relativa è particolarmente
rilevante se si considera che la riduzione di mortalità ottenibile con la sospensione del
fumo di sigaretta sia intorno al 12% e che l’effetto di riduzione della mortalità data dalle
statine sia del 12.8%. Lo studio ha confermato l’efficacia della combinazione
Fluticasione/salmeterolo nel ridurre la frequenza delle riacutizzazioni, comprese quelle
riacutizzazioni che richiedono l’ospedalizzazione, nel migliorare la sintomatologia e la
qualità della vita nonchè la funzione respiratoria. Tali effetti sono risultati migliori non solo
rispetto al placebo ma anche rispetto ai gruppi trattati con i singoli componenti
dell’associazione (salmeterolo o fluticasone solamente) indicando che la combinazione dei
2 farmaci (ICS e LABA) è più vantaggiosa dei singoli componenti. Un’analisi post hoc del
TORCH ha inoltre evidenziato che il trattamento farmacologico con l’associazione
steroide-broncodilatatore a lunga durata d’azione per via inalatoria è in grado di ridurre il
declino della funzione respiratoria (in termini di VEMS, cioè volume di aria espirata nel
primo secondo) nei pazienti con BPCO da moderata o grave rallentando così la
progressione della malattia. Si è evidenziato che salmeterolo la combinazione riduce il
declino del VEMS di 16 ml/anno rispetto al placebo (p< 0,001). I dati ottenuti hanno quindi
supportato l’uso di questa terapia in pazienti con gravità spirometrica minore (VEMS
prebroncodilatore <60% predetto) rispetto a quelli indicati Sulla base di tali studi pertanto
le linee guida attualmente consigliano l’utilizzo degli steroidi in associazione ad
broncodilatatori a lunga durata d’azione in pazienti con VEMS ≤ 50% del teorico (VEMS <
60% pre broncodilatatore se si utilizza fluticasone propionato + salmeterolo) e storia di
frequenti riacutizzazioni (1 o più all’anno negli ultimi 3 anni).
Per quanto concerne gli effetti collaterali della terapia con steroidi inalatori a lungo termine,
dati solidi sulla safety arrivano, ancora una volta, dallo studio TORCH, che per numerosità
coinvolge un numero di pazienti superiore a tutti gli studi precedenti con la stessa
combinazione ICS/LABA. In tale studio per quanto concerne l’associazione steroidebroncodilatatore a lunga durata d’azione non sono emerse differenze rispetto al placebo
riguardo al rischio di eventi cardiovascolari, insorgenza di cataratta, fratture e variazioni in
termini di osteopenia/osteoporosi alla densitometria ossea31-33.
In uno studio randomizzato di 12 mesi, anche l’associazione budesonide/formoterolo
(160/4.5 mcg) ha ridotto il numero di severe esacerbazioni per paziente/anno del 24 %
versus placebo e 23 % versus formoterolo34. L’incremento del FEV1 è risultato del 15%
versus placebo e 9% versus budesonide. Il miglioramento del PEF a favore
dell’associazione
si
è
mantenuto
per
tutti
i
12
mesi
di
osservazione.
budesonide/formoterolo ha ridotto i sintomi e l’uso di broncodilatatori al bisogno e
migliorato la qualità di vita.
In un ulteriore trial di 12 mesi35, i soggetti trattati con budesonide/formoterolo avevavo un
tempo prolungato alla prima esacerbazione (254 versus 96 giorni) ed un miglioramento
significativo del FEV1 rispetto al placebo. La terapia di associazione si confermava in
grado di ridurre le esacerbazioni (1.38 versus 1.80 per paziente per anno) e di migliorare
la qualità di vita.
Particolarmente discusso è stato il rischio di polmonite del trattamento prolungato con ICS,
che è emerso dallo studio TORCH30, date le dimensioni del campione analizzato.
L’incidenza delle polmoniti nello studio, peraltro non confermate radiograficamente, non ha
tuttavia determinato un aumento nel numero dei decessi. Quantificando nel dettaglio il
rischio
pro-infettivo
di
un
trattamento
cronico
con
una
combinazione
fluticasone/salmeterolo nei pazienti con BPCO dai risultati dello studio TORCH emerge
inoltre un dato contrastante: in corso di terapia con steroidi vi è sì un aumento di patologie
infettive come le polmoniti (3 su 100 pazienti/anno nel gruppo placebo contro 7 su 100
pazienti nel gruppo trattato con la combinazione) ma si osserva anche una marcata
riduzione delle riacutizzazioni (92/100 pazienti/anno nel gruppo placebo contro 67/100
pazienti/anno nel gruppo in trattamento con la combinazione steroide–broncodilatatore a
lunga durata d’azione)31. Un'analisi a posteriori dello studio ha rilevato inoltre che i pazienti
a maggiore rischio di sviluppare polmonite, sono i soggetti più anziani, quelli con un indice
di massa corporea più basso (<25kg/m2) ed i pazienti affetti da una forma grave della
malattia (VEMS<50% del teorico)36.
I risultati dello studio osservazionale “real-life” PATHOS37 hanno dimostrato che il
trattamento con la combinazione fissa budesonide/formoterolo si associa ad una minore
incidenza
di
polmonite
e
decessi
correlati,
rispetto
alla
terapia
a
base
di
fluticasone/salmeterolo37.
Il gruppo di pazienti trattati con fluticasone/salmeterolo ha avuto un’incidenza di polmoniti
superiore del 73%, con un numero di eventi pari ad 11,0 per 100 pazienti-anni in confronto
a 6,4 per 100 pazienti-anni nel gruppo budesonide/formoterolo. Inoltre, la terapia con
fluticasone/salmeterolo è associata al 74% in più di ospedalizzazioni per polmonite rispetto
al trattamento con budesonide/formoterolo, con 7,4 ricoveri ospedalieri per 100 pazientianni nel gruppo trattato con fluticasone/salmeterolo, rispetto a 4,3 ricoveri ospedalieri per
100 pazienti-anni nel gruppo trattato con budesonide/formoterolo.
BPCO stabile. La scelta terapeutica
La scelta terapeutica deve essere adeguata per la singola persona e guidata dalla gravità
del quadro clinico, considerato nel suo complesso di sintomi, funzione respiratoria,
complicanze, comorbilità e dalle caratteristiche individuali (fenotipo) della persona che ne
è affetta.1
Nelle persone con diagnosi di BPCO che abbiano sintomi quali ad esempio la ridotta
tolleranza all’esercizio fisico e/o dispnea da sforzo (≥ grado 1 MMRC), anche in presenza
di un VEMS o FEV1 pre-broncodilatatore > 80% del valore teorico si può considerare il
trattamento con farmaci broncodilatatori.38
Nelle persone sintomatiche con diagnosi di BPCO e VEMS o FEV1 pre-broncodilatatore <
80% del valore teorico, attuare il trattamento regolare e continuativo con un
broncodilatatore a lunga durata d’azione (salmeterolo, formoterolo, indacaterolo, tiotropio,
aclidinio, glicopirronio) per via inalatoria.39,10-21 Due studi clinici ad un anno hanno indicato
una maggiore protezione verso le riacutizzazioni del tiotropio rispetto ai LABA pur
determinando entrambe le categorie una efficace broncodilatazione.40-42 Inoltre, uno studio
clinico su una larga popolazione di pazienti ha dimostrato la sicurezza clinica del tiotropio
nelle formulazioni inalatorie e nei dosaggi disponibili.19
Nelle persone in trattamento farmacologico regolare, ad ogni visita programmata si
dovrebbe valutare:
- la corretta e regolare assunzione della terapia inalatoria;
- la variazione dei sintomi ed in particolare, la tolleranza all’esercizio fisico e la dispnea da
sforzo;
- le modificazioni della funzione polmonare in termini non solo di VEMS o FEV 1 e di volumi
polmonari (in base al programma di controlli spirometrici);
- il ricorso ai broncodilatatori a breve durata d’azione come supporto occasionale;
- la frequenza e gravità degli episodi di riacutizzazione;
- la frequenza e la durata degli episodi di ospedalizzazione;
- gli eventuali eventi collaterali e/o avversi.
Nel caso di risultato giudicato insoddisfacente in termini di sintomatologia e/o funzionalità
polmonare da parte della persona con BPCO e/o dal medico curante, considerare:
• l’aumento della dose del singolo broncodilatatore se e come previsto nella scheda
tecnica del farmaco in uso;43-44
• l’aggiunta di un secondo broncodilatatore a lunga durata d’azione, con meccanismo
d’azione differente;45-50
• l’aggiunta di un corticosteroide per via inalatoria (CSI), nei pazienti con frequenti
riacutizzazioni e FEV1 <60% del predetto.28-31, 34-35
Nelle persone con BPCO, sintomatiche nonostante l’uso regolare di broncodilatatori a
lunga durata d’azione, con VEMS o FEV1 pre-broncodilatatore < 60% del valore teorico e
storia di frequenti riacutizzazioni (≥ 2/anno), considerare l’associazione LABA+CSI. 2,31
L’utilizzo della combinazione fissa può migliorare significativamente l’aderenza della
persona alla terapia.30-31, 34-35
- L’associazione LAMA+LABA+CSI, in persone sintomatiche con VEMS o FEV1< 60% del
valore teorico, ha migliorato la funzione ventilatoria e la qualità della vita e ridotto il numero
di ospedalizzazioni.51-52
- In pazienti con diagnosi di BPCO, bronchite cronica, VEMS o FEV1 < 50% e frequenti
riacutizzazioni (≥ 2), l’aggiunta di un inibitore delle fosfodiesterasi-4 (roflumilast) alla
terapia regolare con broncodilatatori a lunga durata d’azione (LAMA o LABA) migliora la
funzione ventilatoria e riduce la frequenza delle riacutizzazioni.26-27
Scelta degli inalatori
La terapia inalatoria rappresenta il cardine del trattamento farmacologico della BPCO. A
differenza della terapia orale o endovena, la terapia inalatoria consente di somministrare i
farmaci direttamente nel lume delle vie aeree, ottenendo a questo livello concentrazioni
consistenti del farmaco riducendone al minimo l’esposizione sistemica. L’efficacia dei
farmaci somministrati per via inalatoria può variare, però, in relazione alla differente
formulazione e alle caratteristiche dei dispositivi usati per inalarli. Il successo della terapia
inalatoria non dipende solamente dall’efficacia del farmaco, ma anche dalla disponibilità di
inalatori facili da usare e che assicurino elevate quantità del farmaco nell’apparato
respiratorio.
Le evidenze cliniche più recenti, sottolineate dalle principali società scientifiche
pneumologiche, richiamano l’attenzione sul fatto che la terapia inalatoria può risultare
poco o per niente efficace se non assunta in maniera adeguata. Si può affermare, quindi,
che non si può parlare solo dell’efficacia delle singole molecole, ma della combinazione tra
molecola ed inalatore.
Esistono differenti tipi di device per la somministrazione inalatoria dei farmaci usati nel
trattamento dell’asma e della BPCO: i nebulizzatori, gli spray predosati (pressurized
metered dose inhaler, pMDI) e gli inalatori di polvere secca (dry powder inhalers, DPI).
Gli spray pre-dosati sono stati introdotti nella pratica clinica circa 50 anni fa, sono stati
progressivamente migliorati, in particolare per quanto riguarda la velocità dell’erogazione,
il diametro delle particelle, l’uso in soluzione anziché sospensione, i propellenti non più
dannosi per l’ambiente. Il limite maggiore rimane proprio la necessità di coordinare
l’attuazione dello spray con l’inspirio da parte del paziente. Lo sviluppo di nuove tecnologie
e dispositivi inalatori ha consentito lo sviluppo di formulazioni pMDI in soluzione che
permettono di ridurre le dimensioni delle particelle erogate e diminuire la velocità di
erogazione. Gli MDI con propellente HFA migliorano la coordinazione mano/respiro in
quanto il plume prodotto dal MDI è meno veloce e questo offre al paziente un maggior
tempo per effettuare una corretta inspirazione.
I DPI possono essere: 1) a singola dose 2) multidose con dosi unitarie 3) multidose con
reservoir ed hanno eliminato rispetto ai tradizionali spray ogni necessità di coordinazione
da parte del paziente, poiché consentono di assumere la dose del farmaco inspirando
direttamente dall’inalatore. Il paziente deve tuttavia essere in grado di produrre un flusso
inspiratorio sufficiente a mobilizzare il farmaco.
L’efficacia di un dispositivo DPI è
funzionale al flusso inspiratorio generato dal paziente. A parità di sforzo inspiratorio il
dispositivo che genera al suo interno valori più elevati di Picco di Flusso Inspiratorio (PIF)
garantisce erogazioni più precise e costanti di farmaco.
Anche per i DPI, come già sottolineato per gli MDI, la deposizione polmonare dipende
dalla quota di frazione respirabile del farmaco, vale a dire la quantità di particelle con un
diametro tra 5 - 2.5 um. DPI dotati di una resistenza particolarmente elevata possono
essere utilizzati con difficoltà da pazienti che possono effettuare un modesto sforzo
inspiratorio come bambini, anziani, paziente severamente ostruiti.
Bibliografia
1. La gestione clinica integrata della BPCO. Documento dell’Agenzia Nazionale per i
Servizi Sanitari Nazionali 2013.
2. Vestbo J, Hurd SS, Agusti AA, et al. Global Strategy for the Diagnosis,
management, and Prevention of Chronic Obstructive Pulmonary Disease. GOLD
Executive Summary. Am J Resp Crit Care Med 2013; 187,4, 347-365.
3. Guyatt GH, Townscend M, Pugsley SO, et al. Bronchodilators in chronic airflow
limitation. .Am Rev Respir Dis 1987;135:1069-1074
4. Liesker JJW, Wijkstra PJ, Ten Hacken NHT, et al. A systematic review of the effects
of
bronchodilators on
exercise
capacity
in
patients
with
COPD.
Chest
2002;121:597-608.
5. Lipworth BJ, McDavitt DG, Struthers AD. Hypokalemic and ECG sequelae of
combined beta-agonist/diuretic therapy. Chest 1990;98 (4): 811-815
6. Uren NG, Davies SW, Jordan SL, Lipkin DP. Inhaled bronchodilators increase
maximum oxygen consumption in chronic left ventricular failure. Eur Heart J
1993;14:744–50.
7. Gross Ng, Petty TL, Friedman M, et al. Dose response to ipratropium as a
nebulized solution in patients with COPD. Am Rev Resp Dis 1989; 139: 1188-91
8. In chronic obstructive pulmonary disease, a combination of ipratropium and
albuterol is more effective than either agent alone. An 85-day multicenter trial.
COMBIVENT Inhalation Aerosol Study Group. Chest 1994;105:1411-1419
9. Appleton S, Poole P, Smith BJ, et al. Long-acting beta2-agonists for poorly
reversible chronic obstructive pulmonary disease. Cochrane Database of
Systematic Reviews 2006,Issue 3
10. Rennard SI, Anderson W, ZuWallack R, et al. Use of a long acting inhaled beta2adrenergic agonist, salmeterol xinafoate, in patients with chronic obstructive
pulmonary disease. Am J Respir Crit Care Med 2001; 163: 1087-92
11. Dahl R, Greefhorst LA, Nowak D, et al. Formoterol in chronic obstructive pulmonary
disease. Am J Respir Crit Care Med 2001;164:778-784
12. Dahl R, Chung KF, Buhl R, et al. Efficacy of a new once-daily long-acting inhaled
β2-agonist indacaterol versus twice-daily formoterol in COPD. Thorax 2010, 65:473479;
13. Kornmann O, Dahl R, Centanni S, et al. et al. Once-daily indacaterol versus twicedaily salmeterol for COPD: a placebo-controlled comparison. Eur. Resp. J. 2011
27:273 - 279;
14. Montuschi P. Inhaled muscarinic acetylcholine receptor antagonists for treatment of
COPD. Curr Med Chem 2013; 20(12): 1464-76
15. Tashkin DP, Pearle J, Iezzoni D, Varghese ST. Formoterol and tiotropium
compared with tiotropium alone for treatment of COPD. COPD 2009;6:17–25.
16. Niewoehner DE, Rice K, Cote C, et al. Prevention of exacerbations of chronic
obstructive pulmonary disease with tiotropium, a once-daily inhaled anticholinergic
bronchodilator: a randomized trial. Ann Intern Med 2005;143:317–326
17. Tashkin DP, Celli B, Senn S, et al. A 4-year trial of tiotropium in chronic obstructive
pulmonary disease. N Engl J Med 2008;359:1543–1554.
18. Barr RG, Bourbeau J, Camargo CA, Ram FS. Inhaled tiotropium for stable chronic
obstructive pulmonary disease. Cochrane Database Syst Rev 2005;CD002876.
19. Wise RA, Anzueto A, Cotton D, et al. Tiotropium Respimat Inhaler and the risk of
death in COPD. New Eng J Med 2013;369:1491-1501.
20. D’Urzo A, Ferguson GT, van Noord JA, et al. Efficacy and safety of once-daily
NVA237 in patients with moderate-to-severe COPD: the GLOW1 trial. Respir Res
2011; 7: 156-169
21. van Noord JA, Buhl R, Laforce C, et al. QVA149 demonstrates superior
bronchodilation compared with indacaterol or placebo in patients with chronic
obstructive pulmonary disease. Thorax 2010; 65(12):1086-91.
22. Kerwin E, Hébert J, Gallagher N, et al. Efficacy and safety of NVA237 versus
placebo and tiotropium in patients with COPD: the GLOW2 study. Eur Resp J 2012;
40:1106-1114
23. Beeh KM, Singh D, Di Scala L, Drollmann A. Once-daily NVA237 improves exercise
tolerance from the first dose in patients with COPD: the GLOW3 trial. Int J COPD
2012; 7:503-523
24. Jones P, Singh D, Bateman E, et al. Efficacy and safety of twice-daily aclidinium
bromide in COPD patients: The ATTAIN study. Eur Respir J 2012;40:830–836
25. Kerwin EM, D’Urzo AD, Gelb AF, et al. Efficacy and safety of a 12-week treatment
with twice-daily aclidinium bromide in COPD patients. ACCORD COPD I. COPD
2012;9:90–101
26. Calverley PM, Rabe KF, Goehring UM, et al. Roflumilast in symptomatic COPD: two
randomized clinical trials. Lancet 2009; 374 (9691): 685-694
27. Fabbri LM, Calverley PM, Izquierdo-Alonso JL, et al. Roflumilast in moderate-tosevere COPD treated with long-acting bronchodilators: two randomized clinical
trials. Lancet 2009; 374 (9691): 695-703
28. Mahler DA, Wire P, Horstman D, et al. Effectiveness of fluticasone propionate and
salmeterol combination delivered via the Diskus device in the treatment of chronic
obstructive pulmonary disease. Am J Resp Crit Care Med 2002;166:1084-1091.
29. Calverley P, Pauwels R, Vestbo J, et al. Combined salmeterol and fluticasone in the
treatment of chronic obstructive pulmonary disease: a randomized controlled trial.
Lancet 2003;361:449-456.
30. Celli BR, Thomas NE, Anderson Ja, et al. Effect of pharmacotherapy on rate of
decline of lung function in COPD: results from the TORCH study. Am J Respir Crit
Care Med 2008;178:332–338
31. Calverly PMA, Anderson Ja, Celli B, et al. Salmeterol and Fluticasone Propionate
and Survival in Chronic Obstructive Pulmonary Disease. N Engl J Med
2007;356:775–89
32. Ferguson GT, Calverley PM, Anderson JA, et al. Prevalence and progression of
osteoporosis in patients with COPD: results from TORCH. Chest 2009;136:1456–
1465
33. Calverley PMA, Anderson JA, Celli B, et al. Cardiovascular events in patients with
COPD: TORCH Study results. Thorax 2010;65:719–725
34. Szafranski
W,
Cukier
A,
Ramirez
A,
et
al.
Efficacy
and
safety
of
budesonide/formoterol in the management of chronic obstructive pulmonary
disease. Eur Respir J 2003;21:74-81.
35. Calverley PM Boonsawat W, Cseke Z, et al. Maintenance therapy with budesonide
and formoterol in chronic obstructive pulmonary disease. Eur Respir J 2003; 22:
912-919
36. Crim C, Calverley PMA, Anderson JA, et al. Pneumonia risk in COPD patient
receiving inhaled corticosteroids alone or in combination: TORCH study result. Eur
Respir J 2009;34:641–647
37. Janson C, Larsson K, Ställberg B, et al. Pneumonia and pneumonia related
mortality in patients with COPD treated with fixed combinations of inhaled
corticosteroid and long acting β2 agonist: observational matched cohort study
(PATHOS). BMJ 2013; 346:f3306
38. O’Donnell DE, Laveneziana P, Ora J, et al. Evaluation of acute bronchodilator
reversibility in patients with symptoms of GOLD stage I COPD. Thorax 2009;
64:216–223.
39. Tashkin DP, Fabbri LM. Long-acting beta-agonists in the management of chronic
obstructive pulmonary disease: current and future agents. Respir Res 2010; 11:149.
40. Volgelmeier C, Hederer B, Glaab T, et al. for the POET-COPD Investigators:
Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Eng J
Med 2011; 363:1093–1103.
41. Decramer M, Chapman KR, Dhak R, et al. on behalf of the INVIGORATE
investigators: Once-daily indacaterol versus tiotropium for patients with severe
chronic obstructive pulmonary disease (INVIGORATE): a randomised, blinded,
parallel-group study. Lancet Respir Med 2013; 1(7):524–533.
42. Wedzicha JA. Choice of bronchodilator therapy for patients with COPD. N Engl J
Med 2011; 364:1167–1168.
43. Rossi A, Kristufek P, Levine BE, et al. Comparison of the efficacy, tolerability, and
safety of formoterol dry powder and oral, slow release theophylline in the treatment
of COPD. Chest 2002; 121:1058–1069.
44. Rossi A, Polese G. Indacaterol: a comprehensive review. Int J COPD 2013; 8:353–
363.
45. Van Noord JA, Aumann JL, Janssens E, et al. Effects of tiotropium with and without
formoterol on airflow obstruction and resting hyperinflation in patients with COPD.
Chest 2006; 129:509–517.
46. Rabe KF, Timmer W, Sagkriotis A, Viel K. Comparison of a combination of
tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest
2008; 134:255–262.
47. Van Noord JA, Buhl R, LaForce C, et al. QVA149 demonstrates superior
bronchodilation compared with indacaterol or placebo in patients with chronic
obstructive pulmonary disease. Thorax 2010; 65:1086–1091.
48. Karner C, Cates CJ. Long-acting beta2-agonist in addition to tiotropium versus
either tiotropium or long-acting beta2-agonist alone for chronic obstructive
pulmonary disease. Cochrane Database Syst Rev 2012; 4:CD008989.
49. Mahler DA, D’Urzo A, Bateman ED, et al., on behalf of the INTRUST-1 and
INTRUST-2 study investigators. Concurrent use of indacaterol plus tiotropium in
patients with COPD provides superior bronchodilation compared with tiotropium
alone: a randomized, double-blind comparison. Thorax 2012; 67:781–788.
50. Vogelmeier CF, Bateman E, Pallante J, et al. Efficacy and safety of once-daily
QVA149 compared with twice-daily salmeterol-fluticasone in patients with chronic
obstructive pulmonary disease (ILLUMINATE): a randomised, double-blind, parallel
group study. Lancet Respir Med 2013; 1(1):51–60.
51. Short PM, Williamson PA, Elder DH, et al. The impact of tiotropium on mortality and
exacerbations when added to inhaled corticosteroids and long-acting- agonist
therapy in COPD. Chest 2012; 141(1):81–6.
52. Welte T, Miravitlles M, Hernandez P, et al. Efficacy and tolerability of
budesonide/formoterol added to tiotropium in patients with chronic obstructive
pulmonary disease. Am J Respir Crit Care Med 2009; 180:741–750.
53. Laube BL, Janssens HM, de Jongh FHC, et al. What the pulmonary specialist
should know about the new inhalation therapies. Eur Resp J 2011; 37: 1308-1331.