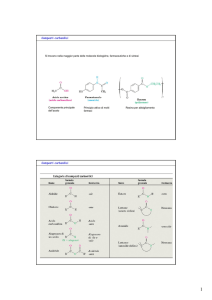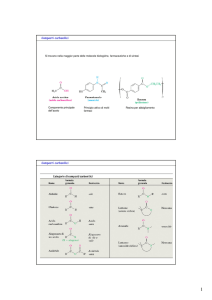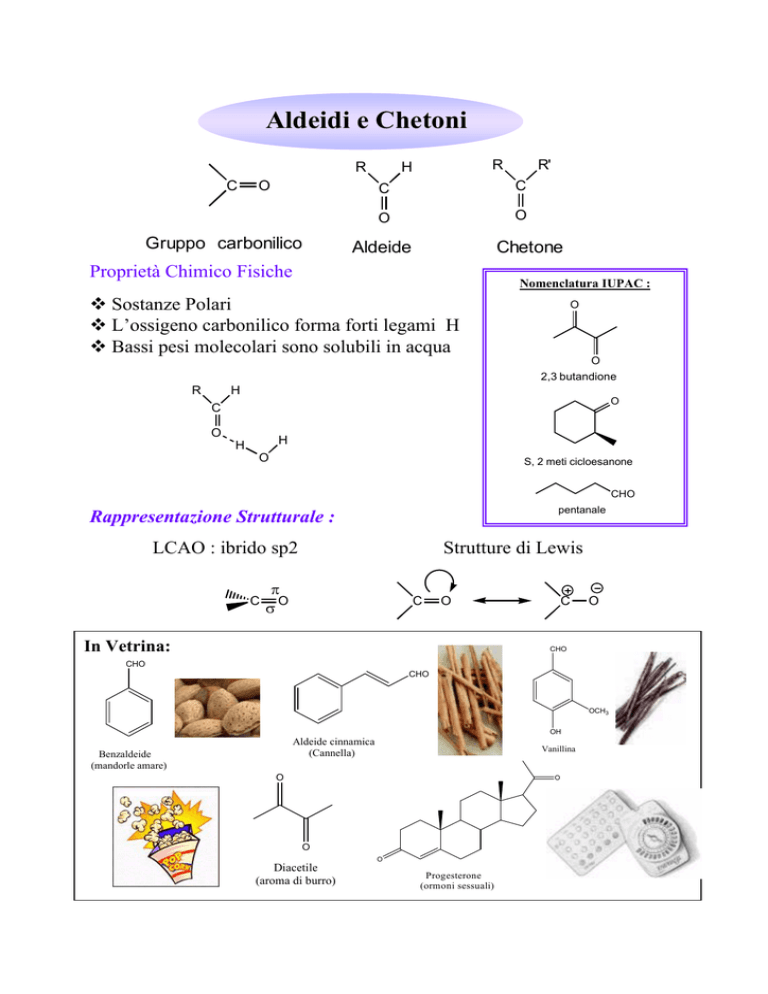
Aldeidi e Chetoni
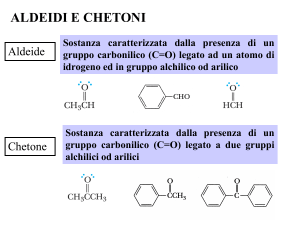
R
C
O
Gruppo carbonilico
R
H
R'
C
C
O
O
Aldeide
Chetone
Proprietà Chimico Fisiche
Nomenclatura IUPAC :
Sostanze Polari
L’ossigeno carbonilico forma forti legami H
Bassi pesi molecolari sono solubili in acqua
O
O
2,3 butandione
R
H
O
C
O
H
H
O
S, 2 meti cicloesanone
CHO
pentanale
Rappresentazione Strutturale :
LCAO : ibrido sp2
C
Strutture di Lewis
π
O
σ
C
O
In Vetrina:
C
O
CHO
CHO
CHO
OCH3
OH
Aldeide cinnamica
(Cannella)
Benzaldeide
(mandorle amare)
Vanillina
O
O
O
O
Diacetile
(aroma di burro)
Progesterone
(ormoni sessuali)
Aldeidi e chetoni : REATTIVITA'
⇒ Reazioni di Addizione Nucleofila di Acidi di Bronsted
Reversibile
Irreversibile
⇒ Reazioni di Sostituzione Elettrofila del H in α al gruppo Carbonilico
Addizione Reversibile
δ+
δ−
C
O
+
δ+
δ−
O
H
Nu
C
H
Nu
Acido di Bronsted
H
O
C
H-OH
OH
O
H-OR
H
gem-diolo
C
OR
emi-acetale,chetale
H-CN
O
H
C
CN
cianidrina
Va notato che danno reazione di addizione acidi di Bronsted DEBOLI, quali
acqua ed alcoli in quanto acidi forti tipo H -Alogeno, danno sì addizione,
ma risulta essere più veloce la reazione di eliminazione di ritorno, essendo
l'alogeno un miglior gruppo uscente.
Meccanismo: L'ossigeno carbonilico come base di Bronsted
L' H2O come buon gruppo uscente
H
OH
O
OH
R
O
OH
+
+H
-H
ROH
+
-H
+
H
OR
R
OR
O
R
OH
-H
- H2O
O
OH
+
+
+H
emichetale
ROH
R
O
OR
chetale
⇒ Questa reazione di equilibrio viene spostata a favore del chetale "rimuovendo”
dalla reazione l'acqua che si forma , o con un forte eccesso di alcol ROH.
⇒ Il chetale può essere visto come gruppo "protettore" della funzione carbonilica,
essendo questa mascherata come carbonio tetraedrico, che può essere ripristinata
aggiungendo acqua e H+.
⇒ Gli zuccheri (monosaccaridi) sono strutture cicliche emiacetaliche
o emichetaliche.
Ad es. : il glucosio
H
OH
OH
H
H O
HO
HO
H
H O
HO
HO
H
H
OH
H
OH
OH
OH
H
β glucosio
α glucosio
H
OH
H OH
HO
HO
da sopra
da sotto
O
H
OH
H
H
La cellulosa è un polisaccaride di giunzione acetalica di glucosio
H
OH
H
OH
H O
H O
O
HO
H
O
HO
H
OH
H
β glucosio
H
O
OH
H
β glucosio
H
H
Addizione Irreversibile
Danno questo tipo di reazione i Sali di acidi di Bronsted DEBOLISSIMI.
δ+
δ−
C
O
δ+
+ .Met
δ−
O
Nu
C
metallo
Nu
Nucleofilo = H - (ione idruro , NaBH4)
R - ( carbanioni, organo metallici, reattivi di grignard )
Si ottengono quindi sali di alcoli che per idrolisi formano gli alcoli stessi :
la riduzione di una aldeide fornisce un alcol primario
la riduzione di un chetone fornisce un alcol secondario
l'addizione di un organo - metallo ad una aldeide porta ad un alcol secondario
l'addizione di un organo - metallo ad un chetone porta ad un alcol terziario
O
metallo
H2O
C
Nu
OH
C
Nu
⇒ Deve essere messo in evidenza che a differenza del C = C il C = O non viene
ridotto con H2 e catalizzatori.
Reazioni con i derivati dell'Azoto : Addizione - Eliminazione
Meccanismo : ruolo importante dell'emi - amminale.
Disponibilità della coppia di e Eliminazione di H +
PH 5-6
C
+
O
H2N
Y
C
N
Y
+H
+
H
C
N
Y
OH2
OH
C
OH
C
C
N
NH2
Y
Y
H2N
- H2O
H
Y
Questa reazione è acido catalizzata, necessità di non portare il pH a valori
troppo acidi in quanto si avrebbe la contemporanea totale protonazione dell'azoto
con perdita della sua capacità nucleofila.
Y = - OH
C
ossima
N
OH
Y = - NH
C
2
idrazone
N
NH 2
Y = -H
C
immina
N
H
Y = -R
C
base di Sciff
N
R
Y = - NHCONH
2
C
semicarbazone
N
NHCONH 2
⇒ A differenza del C = O il C = N - viene ridotto facilmente con H2 e catalizzatori
O
NH2
NADH
NH
+ NH3
R
COOH
R
COOH
R
H
NAD
COOH
α amminoacido
biosintesi formale degli ammino acidi
Addizione di Ilidi : REAZIONE DI WITTIG
Ph
Ph
H
H
Ph
P
+ X
(Ph)3P
X
-
R
sale di fosfonio
R
(Ph)3P
(Ph)3P
R
R
ilide di fosforo
⇒ L'ilide, stabilizzata per risonanza (il P può espandere la valenza),
ha un carattere Nucleofilo
R'
⇒ SN2
(Ph)3P
'R
X
(Ph)3P
R
⇒ Addizione
Eliminazione
O
C
R
(Ph)3P
(Ph)3P
-
O
R
R
(Ph)3P
Sintesi di Alcheni
ossafosfatano
betaina
R
R
O
+
(Ph)3P=O
Composti carbonilici: Enoli ed Enolati
Osservazioni Sperimentali
Acidità degli H in α al gruppo Carbonilico Pka 10 - 20 (alcani Pka 10 - 42 )
O
O
H
H
H
Cl
Cl2
+
H2O
H
'R
O
+
H /OH
RR'CHCOPh
racemo
RR'CDCOPh
racemo
RR'CClCOPh
racemo
-
D2O
intermedio
R
+ HCl
Ph
Cl2
(+)
L'intermedio: Tautomeria Cheto - Enolica
H
H
+
+H lenta
R'
R
R'
R
OH
H
veloce
OH
acido coniugato
R'
R
R'
R
O
chetone
base,
veloce
veloce
R'
R
R'
R
O
base enolato
O
OH
enolo
L'anione enolato è un buon Nucleofilo, ma BIDENTATO: al C o al O
H
R'
R
R'
+ NaH
R
O
O
chetone
chetone
Si-Cl
H
H C-Cl
H
R'
CH 3
R
R'
O
sililenoletere
R
Si
O
chetone
L'enolo come acido di Bronsted debole può dare la reazione di addizione
nucleofila reversibile:
Condensazione Aldolica
O
H3C
O
OH
OH -
O
H3C
H
H
H
aldolo
+H2O
O
H3C
O
H
O
O
H2C
H
H
La reazione è reversibile perché lanione enolato è un buon gruppo uscente.
Si forma un legame C - C
Si può avere eliminazione di acqua dando un composto carbonilico α-β insaturo
La formazione del fruttosio 1,6 bis fosfato, dalla R - gliceraldeide 3- fosfato è un
esempio di condensazione aldolica.
O
H3C
OH
-
O
OH
O
H3C
H
H
H
H
O
condensazione
crotonica
H
OH
O
P
OH
gliceraldeide fosfato
O
OH
O
H
B:
P
P
H
O
OH
P
HO
O
fruttosio difosfato
O
O
diidrossi acetone fosfato
da ultimo va notato che la posizione α di un composto carbonilico è attivata
come la posizione allilica, quindi le reazioni di SN2 sono molto veloci.
Nu
Nu:
Nu
X
X
O
O
O