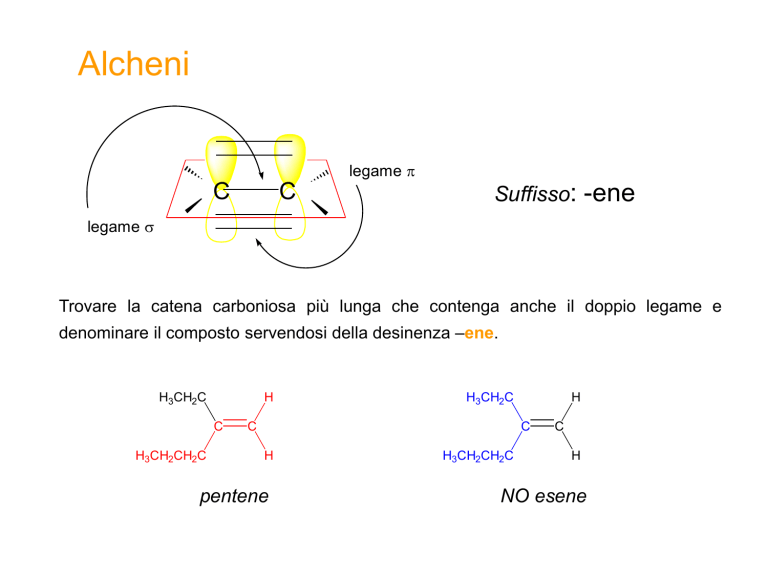
Alcheni
legame
C
C
Suffisso: -ene
legame
Trovare la catena carboniosa più lunga che contenga anche il doppio legame e
denominare il composto servendosi della desinenza –ene.
H3CH2C
H
C
H3CH2CH2C
H3CH2C
C
H
C
H
pentene
H3CH2CH2C
C
H
NO esene
Numerare gli atomi di carbonio della catena incominciando dall’estremità più
prossima al doppio legame. Se quest’ultimo è equidistante dalle due estremità, si
incominci dall’estremità più prossima al primo punto di ramificazione.
5
6
4
2
3
CH 3
1
CH3CH2CH2CH CHCH 3
CH 3CH 2CH
CHCH 2CH 3
1
4
2
3
5
6
Indicare la posizione del doppio legame mediante il numero del primo carbonio
alchenico.
6
5
4
3
2
1
CH3CH2CH2CH CHCH 3
2-esene
H3CH2C
CH 3
CH 3CH 2CH
CHCH 2CH 3
1
4
2
3
5
2-metil-3-esene
6
H
C
H3CH2CH2C
C
H
2-etil-1-pentene
In maniera simile si denominano i cicloalcheni, non esistendo però in essi il punto di inizio di
una catena, si denominano in modo che il doppio legame si trovi tra C1 e C2 e che il primo
sostituente abbia il più piccolo numero possibile.
CH 3
H3C
H 3C
1-metilcicloesene
CH2=
metilene
1,5-dimetilciclopentene
CH2=CHvinile
CH2=CH-CH2allile
Assegnare il nome IUPAC alle seguenti molecole:
a)
b)
4-isopropil-1-metilcicloes-1-ene
Cl
Cl
5,5-dicloro-2-vinilcicloocta-1,3,6-triene
OH
c)
(5E)-3-vinilept-5-en-2-olo
o
(5E)-3-(1-idrossieetil)-ept-1,5-diene
Isomeria cis-trans negli alcheni
Dal momento che i due orbitali p che formano il legame π devono essere paralleli per avere il
massimo grado di sovrapposizione, la rotazione attorno al doppio legame non avviene facilmente. La
barriera energetica che si oppone alla rotazione intorno ad un doppio legame è di 63 kcal/mol.
H3C
CH3
H
H3C
H
H
trans-2-butene
cis-2-butene
H
CH3
Proprio a causa di questa barriera energetica, un
alchene come il 2-butene può esistere in due
forme diastereoisomeriche distinte: gli idrogeni
legati ai carboni sp2 possono trovarsi dalla stessa
parte rispetto al doppio legame (cis) o da parti
opposte (trans).
L'isomeria cis-trans può verificarsi ogni qual volta
entrambi gli atomi di carbonio del doppio legame siano
congiunti con due gruppi differenti.
Cl
H
H
H
H
Cl
Cl
Cl
trans-1,2-dicloroetene
Cl
H
H3C
H
cis-1,2-dicloroetene
Se, però, uno di tali atomi di carbonio è legato a due gruppi identici,
l'isomeria cis-trans non è possibile.
Per questo composto non esiste isomeria cis/trans
Regole di successione: notazione E, Z
ATLA
ALTA
ASSAB
ATLA
BASSA
BASSA
ASSAB
Z
ALTA
E
Il sistema di nomenclatura E, Z si basa su regole di successione che assegnano la priorità ai gruppi
sostituenti congiunti con un doppio legame. Se i gruppi a priorità più alta presenti sull'uno e sull'altro
carbonio si trovano dalla stessa parte del doppio legame, l'alchene si designa Z ( = insieme). Se
i gruppi a priorità più alta si trovano da parti opposte l'alchene si designa E (= opposto).
H
alta
H3C
CH3
Cl
(Z)-2-cloro-butene
H
alta
alta
H3C
Cl alta
CH3
(E)-2-cloro-butene
Assegnate la configurazione E, Z ai seguenti alcheni:
H3C
CH2OH
H3CH2C
Cl
CH2CH3
H3CO
Cl
CH2CH2CH3
Z
E
H3C
COOH
CH2OH
Z
H
CN
H3C
CH2NH2
E
Gli alcheni si comportano da nucleofili. Il doppio legame carbonio-carbonio è ricco di elettroni
e può donarne una coppia ad un elettrofilo nel corso di una reazione di addizione
elettrofila.
Addizione di HX (acidi alogenidrici) agli alcheni
H
H 3C
H
+
H 3C
H
2-metilpropene
H
Br
Br
H3C
H
H3C
H
carbocatione intermedio
l'elettrofilo H+ è attaccato dagli elettroni
del doppio legame e si forma un nuovo legame semplice
C-H. Ciò lascia sull'altro atomo di carbonio una carica +
(carbocatione) e un orbitale p vuoto.
-
Br
H3C
H3 C
H
H
H
il carbocatione intermedio è esso stesso
un elettrofilo in grado di accettare
una coppia di elettroni dal nucleofilo ione bromuro,
formando così un legame C-Br
e, di conseguenza un prodotto di addizione neutro.
Regola di Markovnikov: nell’addizionarsi di HX ad un alchene H si lega al carbonio che
reca il minor numero di sostituenti ed X al carbonio che reca il maggior numero di
sostituenti.
Quale prodotto vi attendereste dalla reazione fra l’HCl e l’1-metilcicloesene?
Due alchili sul carbonio 1
1
2
un alchile sul carbonio 2
H 3C
H
1-metilcicloesene
Secondo la regola di Markovnikov l’idrogeno dovrebbe addizionarsi al carbonio del doppio legame
che reca un alchile e il cloro a quello che ne reca due.
+
H3C
H
1-metilcicloesene
H
Cl -
Cl
H
H3C
H
carbocatione intermedio
Cl
H3C
H
H
1-cloro-1-metilcicloesano
Quale prodotto vi attendereste dalla reazione fra l’HBr e il 2-pentene?
H3CH2C
CH3
un alchile sulcarbonio 2
un alchile sul carbonio 3
H
H
Essendo le estremità del doppio legame caratterizzate da una sostituzione della stessa entità,
il prodotto è una miscela.
H
Br
H3CH2C
H3CH2C
H
CH3
+
H
CH3
H
Br
H
H
H3CH2C
CH3
H
H
carbocatione 2°
H
H
H
CH3
H3CH2C
H
H
carbocatione 2°
Br
CH3
H3CH2C
H
H
Dato che nelle reazioni di addizione elettrofila si invocano come intermedi i carbocationi, una
versione alternativa della regola di Markovnikov è che, nell’addizione di HX all’alchene, tende
a formarsi di preferenza come intermedio il carbocatione maggiormente sostituito.
H
R
R
R
C
più stabile
C
R
R
R
terziario
H
>
secondario
H
C
H
H
>
primario
C
H
>
metile
meno stabile
La stabilità dei carbocationi aumenta con l’aumentare del numero dei sostituenti: i
carbocationi maggiormente sostituiti sono più stabili.
Durante la reazione di HX con un alchene possono aver luogo trasposizioni strutturali.
H
CH3
H
CH3
+
H
H
CH3
H
CH3
H
H
Cl
H
H
H
trasposizione
H
di idruro
H
CH3
H
3-metil-1-butene
CH3
H
carbocatione 2°
carbocatione 3°
Cl
Il carbocatione intermedio secondario
formatosi per protonazione del 3-metil-1butene si riordina (traspone) nel più
stabile carbocatione terziario mediante
uno spostamento di idruro.
H
Cl
CH3
H
CH3
H
H
Cl
H
H
2-cloro-3-metilbutano
H
CH3
H
CH3
H
Cl
H
H
2-cloro-2-metilbutano
N.B. la trasposizione del carbocatione può anche avvenire mediante spostamento di un
gruppo alchilico insieme con la sua coppia di elettroni. Vedi esempio successivo
Quali prodotti sono sintetizzati dalla reazione fra l’HBr e il 3,3-dimetilbutene? Quale avrà
maggiore stabilità?
H
CH3
H
CH3
+
H
CH3
H
CH3
H
CH3
H
CH3
Br
H
H
trasposizione
CH3
H
di metiluro H
H
3,3-dimetil-1-butene
CH3
H
carbocatione 2°
carbocatione 3°
Br
H
Br
CH3
H
CH3
H
CH3
Br
CH3
H
2-bromo-3,3-dimetilbutano
H
CH3
H
CH3
H
Br
H
CH3
2-bromo-2,3-dimetilbutano
+ Stabile
Quali prodotti sono sintetizzati dalla reazione fra l’HBr e l’1-metil-1-vinilciclobutano?
Quale avrà maggiore stabilità?
CH3
CH3
+
H
H
C
CH2
CH3
Br
H
C
Br
-
CH
CH3
CH3
i carbocationi possono riarrangiarsi anche attraverso un'espansione d'anello,
un altro shift-1,2.
CH3
CH3
BrCH3
Br
CH3
l'espansione ad anello porta ad un carbocatione più stabile e alla
formazione di un anello a cinque termini con minore tensione
angolare dell'anello a quattro termini.
Stereochimica delle reazioni di addizione elettrofila di acidi alogenidrici agli alcheni
Quando un reagente che non presenta carboni asimmetrici subisce una reazione che porta
alla sintesi di un prodotto con un carbonio asimmetrico, il prodotto sarà una miscela
racemica.
Cl
H
Cl
(S)
H
H
H
H
H3CH2C
Cl
H
CH3
H3CH2C
CH3
+
H3CH2C
H
CH3
H3CH2C
(R)
Cl
Se una reazione porta alla formazione di un carbonio asimmetrico in un composto che già ne
presenta uno, si formerà una coppia di diastereoisomeri.
diastereoisomeri
Br
H
Cl
C
H
Cl
Cl
Br
H
H
C
H
C
C
H3C
(R)-3-cloro-1-butene
C
H
H
H
H3C
CH3
+
C
C
Br
H
H3C
CH3
(2R,3R)-2-bromo-3-clorobutano (2S,3R)-2-bromo-3-clorobutano
Se, come risultato di una reazione di addizione che passa attraverso un intermedio
carbocationico, si creano due carboni asimmetrici, si ottengono come prodotti della reazione
quattro stereoisomeri.
CH2CH3
CH2CH3
H3CH2C
+ H
Br
Br
CH3
H3C
H
C
*C
CH2CH3
*
CH3
CH3
3-bromo-3,4-dimetilesano
(Z)-3,4-dimetil-3-esene
Formule prospettiche degli stereoisomeri del prodotto
H3C
H
H3CH2C
CH2CH3
C
C
Br
CH3
H3CH2C
Br
H3C
C
CH3
C
H
CH2CH3
H3CH2C
H3C
Br
C
H3C
CH3
C
H
CH2CH3
H
H3CH2C
C
CH2CH3
C
CH3
Br
Proiezioni di Fisher degli stereoisomeri del prodotto
CH2CH3
CH2CH3
H3C
Br
Br
CH3
H3C
H3C
H
H
CH3
H
CH2CH3
CH2CH3
CH2CH3
CH2CH3
Br
CH3
CH2CH3
Br
H3C
CH3
H
CH2CH3
Prevedete i prodotti delle seguenti reazioni
…da svolgere!
A
+
HCl
+
B
HBr
CH2
C
H3PO4
+
KI
N.B. Anche HI si addiziona agli alcheni ma
anziché servirsi direttamente di HI
conviene generare HI nella miscela
reattiva mescolando acido fosforico e
ioduro di potassio.
Da quali alcheni partireste per preparare i seguenti alogenuri alchilici?
…da svolgere!
a) bromociclopentano;
b) 1-iodo-1-etilcicloesano;
c) 1-cloro-1-metilciclopentano;
d) 2-iodo-2-metilpropano.
Addizione degli alogeni agli alcheni
H3C
H
+
H3C
Br
Br
H
H 3C
H 3C
2-metilpropene
la coppia di elettroni del doppio legame attacca il bromo
polarizzato positivamente formando
uno ione bromonio ciclico a tre termini
H
Br
H
Br
-
Br
H
H 3C
H
H3C
Br
lo ione bromuro reagisce con questo intermedio
a ponte dal lato opposto a quello occupato dallo
ione bromonio (addizione anti)
per dare il dibroalcano.
In che senso la formazione dello ione bromonio giustifica la stereochimica anti dell’addizione
all’alchene? In un simile intermedio si può immaginare che l’atomo di bromo “schermi” una faccia
della molecola, sicché l’attacco dello ione bromuro – nello stadio successivo – potrebbe avvenire
solo sull’altra faccia fornendo il prodotto anti.
Se in seguito ad una reazione di addizione che presenta come intermedio uno ione alonio ciclico si
formano due carboni asimmetrici, si formerà un’unica coppia di enantiomeri.
Br
H3C
CH2CH3
(R)
H3C
CH2CH3
C
C
+
C
Br
H3C
Br
Br
(R)
CH2CH3
Br
H
Br
H
H
+
C
H
H
C
H
Br
CH2CH3
H
(S)
C
cis-2-pentene
C
H3C
(S)
H
Br
Dal cis-2-pentene si formano gli enantiomeri (2R,3R)-2,3-dibromopentano e (2S,3S)-2,3-dibromopentano
Br
H3C
H3C
Br
H
C
C
C
+
H3C
Br
Br
CH2CH3
C
H
H
(S)
Br
C
H
H
H
(R)
CH2CH3
+
CH2CH3
Br
H
Br
trans-2-pentene
CH2CH3
(S)
C
H3C
C
(R)
H
Br
Dal trans-2-pentene si formano gli enantiomeri (2R,3S)-2,3-dibromopentano e (2S,3R)-2,3-dibromopentano
L’alogenazione degli alcheni è una reazione stereospecifica. Una reazione si definisce stereospecifica quando
ognuno dei due specifici stereoisomeri del materiale di partenza fornisce un determinato stereoisomero del
prodotto.
L’alogenazione del 2-butene determina la sintesi di prodotti in cui ciascuno dei due atomi di carbonio asimmetrici
lega a sè gli stessi quattro sostituenti.
Cl
H 3C
CH3
+
H
Cl
Cl
H 3C
H
H
CH3
Cl
Cl
CH3
H 3C
-
H
H3 C
H
H
Cl
+
Cl
H
Cl
CH3
H
cis-2-butene
ENANTIOMERI
L’alogenazione del cis-2-butene fornisce due enantiomeri.
Cl
H3C
H
+
H
Cl
Cl
CH3
H3 C
H
Cl
H3C
H
Cl
H
H 3C
-
CH3
H
CH3
Cl
+
Cl
H
H
Cl
CH3
trans-2-butene
singolo composto meso achirale
L’alogenazione del trans-2-butene fornisce un composto meso achirale.
Per disegnare i prodotti dell’alogenazione:
- Addizionate Cl2 in modo anti sui due lati del doppio legame, lasciando tutti gli altri gruppi nella loro orientazione
originale. Disegnate i prodotti in modo che un determinato atomo di Cl si trovi al di sopra del piano in un prodotto
e al di sotto nell’altro.
Disegnate tutti gli stereosomeri che si formano nella seguente reazione:
CH3
(R)
+
Br
Br
CH3
CH3
Br-
(R)
Br
(R)
(R)
(R)
(R)
Br
CH3
CH3
Br
Br
+
Br
(S)
(S)
Br
Br
Sintesi di aloidrine
H
CH3
+
H3C
Br
Br
Br
Br
H
H2O
H
CH3
H
CH3
H3 C
H
H 3C
H
O
H
H
2-butene
Br -
la reazione dell'alchene con una molecola di
bromo fornisce un intermedio a carattere di
ione bromonio.
Br
CH3
H
H
H 3C
OH
+
HBr
3-bromo-2-butanolo
l'acqua si comporta da nucleofilo impiegando
una coppia di elettroni solitaria per
aprire lo ione bromonio e formare un legame con il carbonio.
Donando i suoi elettroni, l'ossigeno acquista una carica +.
La perdita di un protone da parte dell'ossigeno fornisce poi
HBr e la bromoidrina.
Addizione di acqua agli alcheni (idratazione)
H
H2O
+
H
CH2CH3
H
H
CH3
H2 O
H
H
CH3
H
CH3
H
CH2CH3
H
CH2CH3
O
H
2-metil-1-butene
La reazione dell'alchene con acqua è catalizzata da acidi. Essa fornisce un
intermedio a carattere carbocationico. L'addizione di acqua segue la regola
di Markovnikov.
Base
H
H
H
CH3
CH2CH3
OH
H
Quali sono le coppie di alcheni che, tramite una reazione di idratazione acido
catalizzata, formano come prodotto principale ognuno dei seguenti alcoli?
CH3
a.
H3C
C
CH2CH2CH3
OH
CH3
H3C
H+
CHCH2CH3
C
CH3
H3C
C
CHCH2CH3
H
CH3
H2C
C
H+
CH2CH2CH3
H2C
H
CH3
C
C
O
H
H
CH2CH2CH3
H
H2C
CHCH2CH3
CH3
C
H
H
H3C
CH2CH2CH3
C
3
H
H2C
CH3
C
OH
H
CHCH2CH
OH H
H
H
O
O
H
H3C
H
O
CH3
CH3
CH2CH2CH3
CH3
b.
OH
H
H
H
+
CH2
H
CH2
CH2
CH2
H
OH
O
O
H
CH3
H+
H
H
H
H O
CH3
CH3
CH3
H
OH
O
H
H
H
H
Ossidazione di un alchene a glicole
(H3C)2HC
CH2CH3
+
H
Alcuni metalli di transizione nei loro stati di ossidazione più
alti, particolarmente il Mn (VII), sono efficaci agenti ossidanti
e convertono l'alchene in glicole. Un glicole o diolo vicinale è
un composto con gruppi ossidrilici su carboni adiacenti.
KMnO4
CH3
(H3C)2HC
CH2CH3
(H3C)2HC
(H3C)2HC
CH2CH3
H2O
H
CH3
O
O
H
CH3
Mn
O
O
O
Mn
O
O
CH2CH3
(S)
(R)
H
OH
CH3
HO
OH
+ enantiomero
O
L'ossidazione di un alchene è una reazione stereoselettiva:
essa porta ad un addizione sin di gruppi -OH al doppio legame C-C.
In un'addizione sin entrambi i gruppi sono addizionati dallo stesso lato o faccia del doppio legame.
+
MnO2
Quali prodotti sono sintetizzati dalla reazione fra OsO4 e il ciclopentene?
+
Il tetrossido di osmio reagisce con gli alcheni fornendo con alte
rese gli 1,2-dioli. Anche in questo caso prende corpo un
intermedio ciclico che si scinde, poi,a dare il diolo cis.
OsO4
NaHSO3/OH2
+
O
O
O
HO
OsO2
OH
O
Os
Os
O
O
O
O
Essendo un'addizione sin, l'ossidazione si può realizzare su entrambe le facce della molecola. Ne segue che
possono essere sintetizzati entrambi i prodotti cis:
oppure
HO
OH
HO
OH
IDROGENAZIONE CATALITICA
Questa reazione può avvenire solo in presenza di un catalizzatore metallico come Pt, Pd,
Ni. Il metallo adsorbe sulla sua superficie sia l’idrogeno sia l’alchene. Questi si vengono
così a trovare legati alla superficie del metallo uno di fronte all’altro e possono reagire in
modo concertato.
Stadi 1 e 2: Complessazione dell’H2 e dell’alchene al catalizzatore
H2
HH
CH2=CH2
H H CH2=CH2
-l’H2 viene adsorbito sulla superficie del catalizzatore con rottura parziale o completa del legame H-H.
-Il legame π dell’alchene si complessa con il metallo.
Stadi 3 e 4: Addizione sequenziale degli atomi di idrogeno
CH3-CH3
H H CH2=CH2
H
-I due atomi di H sono trasferiti sequenzialmente al legame p portando alla formazione dell’alcano.
-Dal momento che l’alcano formatosi non ha più un legame p con cui complessarsi al metallo, viene
rilasciato dalla superficie del catalizzatore.
L’addizione rapida e sequenziale di H2 avviene sulla faccia dell’alchene complessata
con la superficie del metallo, pertanto si verifica un’addizione sin.
I doppi legami meno ingombrati stericamente si complessano più rapidamente con la
superficie del catalizzatore, dando luogo ad una reazione più veloce.
Dal momento che l’addizione sin di H2 si verifica da entrambi i lati di un doppio legame, disegna tutti i
possibili stereoisomeri che si formano quando l’1-metil-4-metilencicloesano è trattato con H2.
Alchini
Suffisso: -ino
Indicare la posizione del triplo legame con il numero che lo contraddistingue nella
catena. La numerazione comincia sempre dall’estremità più prossima al triplo legame.
CH3
CH3CH2CHCH2C CCH2CH3
8
7
6
5
4
3 2
1
I composti dotati di più di un triplo legame si dicono diini, triini e così via; quelli che
contengono sia il doppio che il triplo legame prendono il nome di enini. Nell’enino la
numerazione incomincerà sempre dall’estremità più prossima al legame multiplo, non
importa se doppio o triplo legame.
HC
CCH2CH2CH2CH
1-epten-6-ino
CH2
Disegnare le strutture di ciascuno dei seguenti composti:
a. 1-bromo-5-metil-3-esino;
b. 1-cloro-3-esino;
c. Ciclottino;
d. 4,4-dimetil-1-pentino;
e. Dimetilacetilene.
CH3
a. BrH2CH2CC
CCHCH3
b. ClH2CH2CC
CCH2CH3
c.
H3C
d.
H3CCH2CC
H3C
CH
e. H3C
C
C
CH3
Assegnare il nome sistematico a ciascuno dei seguenti composti
a.
BrH2CH2CC
CCH3
5-bromo-2-pentino
c.
H3CH2CHCC
CH
b. H3COH2CC
CCH2CH3
1-metossi-2-pentino
d. H3CH2C(Br)HCC
CCH(Cl)CH2CH3
H3CH2CH2C
3-bromo-6-cloro-4-ottino
3-etil-1-esino
Addizione di acidi alogenidrici agli alchini
Se l’alchino è terminale, l’H+ si addiziona al carbonio sp legato all’idrogeno poiché il catione vinilico
risultante è più stabile del catione vinilico primario che si formerebbe se l’H+ si legasse all’altro
carbonio sp.
H 3C
C
+
H
C
H
Br
H
H 3C
C
Br
H
Br
-
C
C
H
C
H 3C
1-propino
H
2-bromo-1-propene
carbocatione vinilico secondario
Anche se generalmente l’addizione di un acido alogenidrico (HX) ad un alchino si può arrestare dopo l’addizione
di un equivalente di HX, se ne è presente un eccesso avviene una seconda reazione di addizione. Il prodotto di
questa seconda addizione è un dialogenuro geminale, una molecola con due alogeni sullo stesso carbonio.
Br
H
Br
C
Br
+
C
H
H3C
Br
H3C
H3C
H
2-bromo-1-propene
Br
C
CH3
H3C
C
C
CH3
CH3
Br
2,2-dibromopropano
Addizione di acidi alogenidrici agli alchini
L’addizione di un acido alogenidrico ad un alchino interno porta alla formazione di due dialogenuri
geminali in quanto l’addizione iniziale del protone può avvenire con uguale facilità su entrambi i
carboni sp.
H 3C
C
C
+
CH2
Cl
Cl
CH3
H
Cl
H3CH2CH2C
CH3
C
+
H3CH2C
C
3
eccesso
Cl
Cl
2-pentino
CH2CH
3,3-dicloropentano
2,2-dicloropentano
Se, tuttavia, i due carboni sp dell’alchino interno sono legati ad un gruppo uguale (alchino
simmetrico), si ottiene un unico dialogenuro geminale.
H3C
H2C
Cl
CH3
C
C
CH2
+
H
Cl
eccesso
3-esino
H3CH2CH2C
C
CH2CH3
Cl
3,3-dicloroesano
Addizione di alogeni agli alchini
L’addizione di una mole di X2 (X = Cl o Br) forma un dialogenuro trans, che può reagire con un
seconda mole di X2 per dare un tetralogenuro.
addizione di X2 per formare un dialogenuro trans
H 3C
C
CH3
C
+
Br
Br
Br
H3C
Br
H3C
CH3
Br
Br
CH3
addizione di X2 per formare un tetralogenuro
H 3C
Br
+
Br
CH3
Br
Br
Br
Br
CH3
H 3C
Br
Br
H 3C
Br
Br
C
C
Br
Br
CH3
Idratazione degli alchini
H
H
H
H2SO4
HC
CCH2CH2CH3
C
H 2O
1-pentino
O
H
H2 O
C
CCH2CH2CH3
HSO4
CCH2CH2CH3
H
H
La regiochimica è quella prevista da Markovnikov. Il prodotto non risulta però il previsto alcol vinilico o
enolo ma il corrispondente chetone.
H
O
H 3C
C
CCH2CH2CH3
2-pentanone
Enolo
e
chetono
sono
tautomeri,
speciali
O
H
H
isomeri
CCH2CH2CH3
enolo
di
struttura che mutano l'uno nell'altro secondo un equilibrio rapidissimo.
O
Tautomerizzazione in ambiente acido
H
H
H
OH
H
C
CCH2CH2CH3
H
H+
enolo
H
H
OH
C
CCH2CH2CH3
H
H
H
O
C
CCCH2CH3
H
O
H 3C
CCH2CH2CH3
Scrivere l’intermedio enolico ed il prodotto chetonico che si formano nella seguente reazione
H+
H+
C
CH
C
CH2
C
CH2
OH
H2O
enolo
C
CH3
C
O
CH3
O
H
H2 O
Da svolgere…
Quale alchino rappresenta il reagente migliore per la sintesi di ciascuno dei seguenti chetoni?
O
a.
H3C
O
CH3
b. H CH C
3
2
O
CH2CH2CH3
c.
H 3C
Addizione di idrogeno
Gli alchini interni possono essere trasformati in alcheni trans utilizzando sodio (o litio) in
ammoniaca liquida.
Na
H3CC
H
H3CC
CCH3
2-butino
H3CC
CCH3
H
NH2
H
anione vinilico
H3C
C
H
CH3
C
H
Na
H3CC
anione radicalico
CH3
CH3
NH2
H
trans-2-butene
Addizione di idrogeno
Gli alcheni cis sono sintetizzati per addizione di idrogeno in presenza di un catalizzatore metallico
come il palladio, il platino o il nickel.
Poiché l’alchino si trova sulla superficie del catalizzatore metallico e gli idrogeni sono trasferiti al
triplo legame sulla superficie del catalizzatore, si ha solo un’addizione sin di idrogeno.
H3CH2C
H3CH2CC
CCH3
2-pentino
+
H
H
catalizzatore
CH3
C
C
di Lidlar
H
H
cis-2-pentene
Da svolgere…
A partire da quale alchino e con quali reagenti si possono sintetizzare:
a. pentano; b. cis-2-butene; c. trans-2-pentene; d. 1-esene
Reazione degli ioni acetiluro
Gli alchini terminali sono rapidamente convertiti con basi forti ad anioni acetiluro. Questi anioni
sono nucleofili forti.
H3CH2CC
C
H
+
NH2
H3CH2CC
+
C
H2N
H
anione acetiluro
nucleofilo
Gli anioni acetiluro reagiscono con gli alogenuri alchilici poco ingombrati per dare prodotti di
sostituzione nucleofila (SN2). A seconda della struttura dell’anione acetiluro si possono peparare
alchini terminali (reazione 1) o alchini interni (reazione 2).
[1]
SN2
HC
C
+
H3C
CH3
C
HC
Cl
nuovo legame C-C
[2] H3CC
C
+ H3CH2C
SN2
Cl
H3CC
C
CH2CH3
Proporre un meccanismo per la sintesi del 4-decino da un alogenuro alchilico appropriato ed un
alchino terminale opportuno.
possibilità 1
I due carboni sp del 4-decino sono
legati uno ad un propile, l’altro ad un
pentile.
possibilità 2
4-decino
Possibilità 1
H3CH2CH2CC
C
H +
H3CH2CH2CC
NH2
C
+
Cl
CH2CH2CH2CH2CH3
1-pentino
H3CH2CH2CC
CCH2CH2CH2CH2CH3
Possibilità 2
H3CH2CH2CH2CH2CC
C
H +
NH2
H3CH2CH2CH2CH2CC
C
+
Cl
CH2CH2CH3
1-eptino
H3CH2CH2CC
CCH2CH2CH2CH2CH3
Esercizio. Come è possibile sintetizzare il seguente chetone a partire dall’1-butino?
O
?
?
H3CH2CC
CH
H3CH2C
CH2CH2CH3
La sintesi di chetoni si realizza per idratazione acido catalizzata di alchini.
L'alchino da usare per questa sintesi è il 3-esino.
O
OH
H2O
H3CH2CC
H3CH2CC
CCH2CH3
CHCH2CH3
H3CH2C
H+
Il 3-esino si può ottenere per rimozione del protone terminale dell'1-butino e successiva alchilazione.
H3CH2CC
CH
NH2-
H3CH2CC
CCH2CH3
CH3CH2Br
Continua…
CH2CH2CH3
Elaborata la sequenza completa delle reazioni, si può mostrare lo schema di sintesi invertendo
la sequenza degli stadi ed includendo tutti i reattivi necessari per ciascuno stadio.
O
H3CH2CC
CH
NH2CH3CH2Br
H2O
H3CH2CC
CCH2CH3
H+
H3CH2C
CH2CH2CH3
Esercizio. Come è possibile sintetizzare l’(E)-2-pentene a partire dall’1-etino?
HC
CH2CH3
H
?
?
CH
H3C
H
Un alchene trans si può preparare da un alchino interno. L’alchino che ci serve per sintetizzare
l’alchene desiderato si può, a sua volta, preparare per reazione dell’1-butino con un alogenuro
metilico. L’1-butino, infine, si può ottenere dall’etino e da un alogenuro etilico.
CH2CH3
H
H3CH2CC
H3C
CCH3
H3CH2CC
CH
HC
CH
H
SCHEMA DI SINTESI
H
NH2
HC
NH2
H3CH2CC
CH
H3CH2C
Br
NH3
H3CH2CC
CH
H3C
Br
CH2CH
3
CCH3
Na
H3C
H
Esercizi
1)
2)
Indicare il prodotto principale che si forma quando il 4-idrossimetilcicloesene viene riscaldato in presenza di acido
solforico. Illustrare il meccanismo di reazione.
Proporre un meccanismo per ciascuna delle seguenti reazioni:
OH
H2SO4
a)
b)
Br2, H2O, NaCl
Br
+ altri prodotti
Cl
3)
4)
5)
6)
7)
Partendo dal propino e facendo uso di qualsiasi altro reagente, proporre una sintesi del trans-2-butene
Indicare il numero e il tipo di stereoisomeri che si formano quando l’(R)-3-metil-1-pentene viene trattato con Br2 in
CCl4. Illustrare il meccanismo.
Mostrare come è possibile sintetizzare il meso-3,4-dibromoesano dall’etino.
Quali sono i due enoli che si formano quando il 2-pentino viene trattato con acqua in ambiente acido? Scrivi i
chetoni formati da questi enoli dopo tautomerizzazione.
Proporre una strategia sintetica multistadio per realizzare la seguente trasformazione:
OH
CH3
CH3
OH












