CAPITOLO
I gruppi funzionali 1
3
Indice
1. I gruppi funzionali
2. Alogenuri alchilici
3. Proprietà fisiche ed usi degli alogenuri alchilici
4. Proprietà chimiche degli alogenuri alchilici
5. Alcoli
6. Proprietà fisiche degli alcoli
7. Proprietà chimiche degli alcoli
8. Gli alcoli di notevole interesse
9. Fenoli
10. Eteri
11. Aldeidi e chetoni
12. Proprietà fisiche delle aldeidi e dei chetoni
13. Proprietà chimiche delle aldeidi e dei chetoni
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
1
1 I gruppi funzionali
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Per gruppi funzionali s’intendono atomi o raggruppamenti atomici, legati ad una
catena carboniosa, che determinano la reattività chimica dei composti organici.
GRUPPI FUNZIONALI DELLE PRINCIPALI FAMIGLIE ORGANICHE.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
2
2 Alogenuri alchilici
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Gli alogenuri alchilici hanno come formula generale R – X, dove R è un gruppo
alchilico ed X, il gruppo funzionale, è un alogeno.
Possono essere distinti in primari, secondari o terziari a seconda che il carbonio
dell’alogeno sia legato ad uno, due o tre gruppi alchilici.
alogenuro primario
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
alogenuro secondario
alogenuro terziario
3
CAPITOLO 3. I GRUPPI FUNZIONALI 1
2 Alogenuri alchilici
Nella nomenclatura IUPAC gli alogenuri alchilici vengono considerati derivati dagli
idrocarburi. Si numera la catena idrocarburica partendo dal carbonio più vicino
all’alogeno.
Nella nomenclatura tradizionale, il nome dell’alogeno si tramuta nel corrispondente
alogenuro che viene seguito dal nome del gruppo alchilico.
4
3
2
1
–
CH3 − CH2 − CH − CH3
Cl
2-clorobutano
(cloruro di sec-butile)
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
3
2
1
CH3 − CH2 − CH2 − Br
1-bromopropano
(bromuro di n-propile)
4
3 Proprietà fisiche ed usi
degli alogenuri alchilici
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Gli alogenuri alchilici, pur essendo composti polari, in quanto l ’ alogeno è più
elettronegativo del carbonio, non sono solubili in acqua (non si formano legami a
idrogeno), mentre sono solubili nei solventi organici.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
5
4 Proprietà chimiche degli
alogenuri alchilici
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Gli alogenuri alchilici danno reazioni di sostituzione nucleofila.
CH3Br + NaOH(aq) CH3OH + NaBr
bromometano
alcool metilico
(CH3)3CBr + NaOH(aq) (CH3)3COH + NaBr
2-bromo-2-metilpropano
2-metil-2-propanolo
Nelle due reazioni lo ione OH− (reattivo nucleofilo) sostituisce lo ione Br− (reattivo
nucleofilo).
Con NaOH in soluzione alcolica gli alogenuri alchilici danno reazioni di eliminazione.
−
CH3 − CH − CH3 + NaOH CH2 = CH − CH3 + NaBr + H2O
Br
propene
2-bromopropano
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
6
CAPITOLO 3. I GRUPPI FUNZIONALI 1
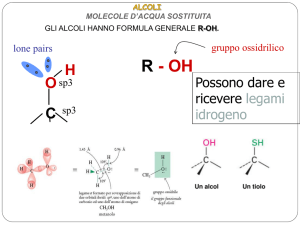
5 Alcoli
Gli alcoli sono composti che presentano il gruppo funzionale ossidrilico −OH legato al
gruppo alchilico:
R − OH
Gli alcoli possono essere distinti in primari, secondari o terziari a seconda che il
carbonio del gruppo − OH sia legato ad uno, due o tre atomi di carbonio.
Alcool primario
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
Alcool secondario
Alcool terziario
7
CAPITOLO 3. I GRUPPI FUNZIONALI 1
5 Alcoli
La nomenclatura IUPAC per gli alcoli considera la catena più lunga comprendente il
gruppo – OH e cambia la desinenza -o degli alcani in -olo.
La nomenclatura tradizionale utilizza la parola alcool seguita dal gruppo alchilico che
termina in -ilico.
CH3 – OH
metanolo (alcool metilico)
CH3 – CH2 – OH
etanolo
CH3 – CH2 – CH2 – OH
propanolo (alcool propilico)
CH3 – CH2 – CH2 – CH2 – OH
butanolo
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
(alcool etilico)
(alcool butilico)
8
6 Proprietà fisiche
degli alcoli
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Gli alcoli presentano alte temperatura di ebollizione perché possono formare legami a
idrogeno intermolecolari.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
9
7 Proprietà chimiche
degli alcoli
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Gli alcoli hanno una acidità molto bassa (Ka = 1016 - 1018), quindi simile a quella
dell’acqua (Ka = 1016).
L ’ acidità degli alcoli, come ricavato sperimentalmente, diminuisce passando
dall’alcool metilico agli alcoli terziari:
alcool metilico alcoli primari alcoli secondari alcoli terziari
Gli alcoli danno reazioni con rottura del legame R – OH.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
10
CAPITOLO 3. I GRUPPI FUNZIONALI 1
7 Proprietà chimiche
degli alcoli
Trattando un alcool con HCl(g) o HCl(conc) il gruppo OH viene sostituito da Cl.
riflusso
C2H5 – OH(ℓ) + HCl(g) C2H5 – Cl(ℓ) + H2O(ℓ)
ZnCl2 cat.
rottura del legame
L’ordine di velocità di reazione è:
alcool terziario secondario primario
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
11
CAPITOLO 3. I GRUPPI FUNZIONALI 1
7 Proprietà chimiche
degli alcoli
In presenza di acido solforico (H2SO4) un alcool si trasforma in un alchene per
disidratazione, cioè per eliminazione di una molecola di acqua.
H2SO4 60%
CH3 – CH2 – CH – CH3 CH3 – CH = CH – CH3
–
OH
alcool sec-butilico
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
100 °C
2-butene
12
CAPITOLO 3. I GRUPPI FUNZIONALI 1
7 Proprietà chimiche
degli alcoli
Gli alcoli danno reazioni di ossidazione.
Per ossidazione degli alcoli primari si ottengono aldeidi o acidi carbossilici, a seconda delle
condizioni sperimentali.
H
CH3 – C = O
OX
=
OX
–
–
CH3 – C – OH
O
H
CH3 – C – OH
–
H
etanolo
(alcool 1°)
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
etanale
(aldeide acetica)
acido etanoico
(acido acetico)
13
7 Proprietà chimiche
degli alcoli
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Un alcool secondario si ossida a chetone.
2-propanolo
acetone
Gli alcoli terziari non possono essere ossidati perché non hanno atomi di idrogeno legati al
carbonio che possiede il gruppo – OH.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
14
8
Gli alcoli di notevole
interesse
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Il metanolo (o alcool metilico) presenta notevoli usi industriali sia come solvente organico
sia per la preparazione della formaldeide.
Il metanolo presenta notevole tossicità per cui, se ingerito, può provocare cecità ed anche
morte.
L’etanolo è un costituente del vino, della birra e, in genere, delle bevande alcoliche.
L’etanolo per uso alimentare si ottiene per fermentazione dei carboidrati:
C6H12O6(aq) 2 C2H5OH(aq) + 2 CO2(g)
glucosio
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
etanolo alimentare
15
8
Gli alcoli di notevole
interesse
CAPITOLO 3. I GRUPPI FUNZIONALI 1
CH2 – OH
Il glicol etilenico
è un alcool con due gruppi ossidrilici.
CH2 – OH
Viene adoperato come anticongelante nei
radiatori delle automobili e, in generale, come
solvente.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
16
8
Gli alcoli di notevole
interesse
La glicerina
CAPITOLO 3. I GRUPPI FUNZIONALI 1
CH2 – OH
CH – OH
CH2 – OH
un alcool con tre gruppi ossidrilici, è usata
nell’industria dei cosmetici.
Un derivato della glicerina, la trinitroglicerina, è un composto instabile (un esplosivo) molto
sensibile agli urti.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
17
9
Fenoli
CAPITOLO 3. I GRUPPI FUNZIONALI 1
I fenoli sono composti che hanno uno o più gruppi ossidrilici – OH legati direttamente ad
atomi di carbonio dell’anello del benzene.
Il fenolo (o idrossibenzene) è il composto più
semplice della serie, C6H5 OH.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
18
9
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Fenoli
I fenoli si ossidano con facilità: l’idrochinone si ossida a benzochinone.
idrochinone
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
benzochinone
19
9
Fenoli
CAPITOLO 3. I GRUPPI FUNZIONALI 1
In campo alimentare alcune sostanze si ossidano a contatto con l’ossigeno dell’aria. Per
evitare il deterioramento delle sostanze, vengono aggiunti ai prodotti alimentari additivi
fenolici, detti antiossidanti, che si ossidano al loro posto.
Questi antiossidanti sono noti in campo alimentare come BHA (butilidrossianisolo) e BHT
(butilidrossitoluene).
La vitamina E è un antiossidante.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
20
CAPITOLO 3. I GRUPPI FUNZIONALI 1
10 Eteri
Gli eteri sono composti in cui ad un atomo di ossigeno sono legati due gruppi (alchilici o
arilici o misti).
Hanno formula generale
R – O – R’
La nomenclatura IUPAC fa seguire la parola etere al nome dei gruppi di questi composti,
messi in ordine alfabetico:
CH3 – CH2 – O – CH2 – CH3
dietiletere
Gli eteri sono ottimi solventi di composti organici, e vengono usati per l’estrazione di questi
composti dai loro prodotti naturali.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
21
11
Aldeidi e chetoni
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Le aldeidi e i chetoni sono composti caratterizzati dal gruppo funzionale carbonilico
La formula generale di un’aldeide è:
quella di un chetone:
dove R ed R’ possono essere gruppi alchilici o aromatici.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
22
11
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Aldeidi e chetoni
La nomenclatura IUPAC trasforma la desinenza terminale -o dell’alcano in -ale per le
aldeidi ed in -one per i chetoni:
O
–
=
H
CH3 – C = O
CH3 – C – CH3
etanale
(aldeide acetica)
propanone
(dimetilchetone o acetone)
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
23
12 Proprietà fisiche
delle aldeidi e dei chetoni
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Le aldeidi e i chetoni hanno temperature di ebollizione superiori a quelle degli alcani di pari
massa molecolare, come conseguenza della polarità del gruppo carbonilico.
La temperatura di ebollizione delle aldeidi e dei chetoni è, invece, inferiore a quella degli
alcoli, in quanto questi composti danno legami a idrogeno intermolecolari.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
24
13 Proprietà chimiche delle
aldeidi e dei chetoni
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Le reazioni delle aldeidi e dei chetoni sono le seguenti:
• reazioni di riduzione
• reazioni del gruppo carbonilico con gli alcoli
• ossidazione delle aldeidi.
Le aldeidi possono essere ridotte ad alcoli primari e i chetoni ad alcoli secondari.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
25
13 Proprietà chimiche delle
aldeidi e dei chetoni
CAPITOLO 3. I GRUPPI FUNZIONALI 1
Le aldeidi reagiscono con gli alcoli per dare composti noti con il nome di emiacetali.
emiacetale
La reazione procede con un meccanismo di addizione nucleofila al gruppo carbonilico.
Un’aldeide, per ossidazione, dà un acido carbossilico con lo stesso numero di atomi di
carbonio.
© Paolo Pistarà
© Istituto Italiano Edizioni Atlas
26