Carboidrati
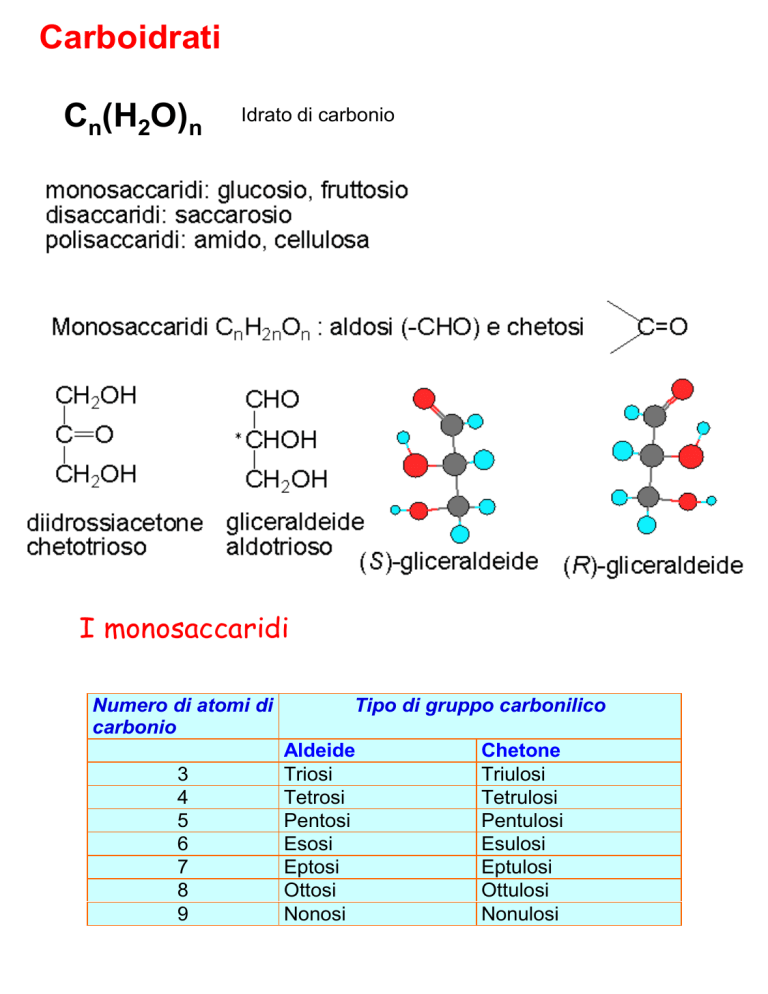
Cn(H2O)n
Idrato di carbonio
I monosaccaridi
Numero di atomi di
carbonio
3
4
5
6
7
8
9
Tipo di gruppo carbonilico
Aldeide
Triosi
Tetrosi
Pentosi
Esosi
Eptosi
Ottosi
Nonosi
Chetone
Triulosi
Tetrulosi
Pentulosi
Esulosi
Eptulosi
Ottulosi
Nonulosi
I monosaccaridi
Utilizzo della denominazione D, L
CHO
HO
CHO
H
H
CH2OH
OH
CH2OH
L-Gliceraldeide
D-Gliceraldeide
Formule di proiezione di Fischer: la catena carboniosa viene
disposta sul braccio verticale (lontano dall’osservatore) ed i
carbonio a più alto stato di ossidazione viene posto in alto.
CHO
H
OH
1
CHO
2
H
OH
3
HO
H
HO
H
H
OH
H 4
OH
H
OH
H 5
OH
CH2OH
formula prospettica
6 CH OH
2
D-Glucosio
proiezione di Fischer
Gruppo ossidrilico
che determina la
serie sterica
CH2OH
O
HO
H
H
OH
H
OH
CH2OH
D-Fruttosio
I monosaccaridi di origine naturale appartengono alla serie
stereogenica D
Relazioni configurazionali tra i D-aldotetrosi, D-aldopentosi e
D-aldoesosi isomerici
CHO
H
OH
CH2OH
D-Gliceraldeide
CHO
CHO
H
HO
OH
H
H
OH
D-Treosio
CHO
CHO
HO
OH
H
OH
H
H
OH
H
H
H
OH
OH
CHO
HO
H
H
H
OH
OH
H
OH
HO
OH HO
H
HO
H
H
H
H
H
OH
H
OH
H
OH
H
OH
HO
H
OH
H
OH
H
OH
H
OH
H
D-Allosio
CH2OH
CH2OH
CH2OH
D-Altrosio
D-Glucosio
D-Mannosio
OH
H
OH
CH2OH
D-Gulosio
HO
H
OH
CH2OH
D-Lixosio
CHO
OH HO
H
H
CH2OH
H
CH2OH
OH
CHO
H
HO
D-Xilosio
CHO
H
HO
H
H
CHO
CHO
OH
HO
D-Arabinosio
D-Ribosio
CHO
CHO
CH2OH
CH2OH
OH
CH2OH
CH2OH
D-Eritrosio
H
H
H
CHO
H
OH HO
H
OH
CH2OH
D-Idosio
HO
H
CHO
OH HO
H
HO
H
OH
CH2OH
D-Galattosio
HO
H
H
H
H
OH
CH2OH
D-Talosio
I monosaccaridi più comuni
Aldoesosi
CHO
CHO
H
OH
HO
HO
H
HO
H
OH
H
OH
CH2OH
CHO
H
H
OH
H
HO
H
H
OH
HO
H
OH
H
CH2OH
D-Glucosio
H
OH
CH2OH
D-Galattosio
D-Mannosio
Epimeri del
glucosio al C-2
e C-4
Chetoesosi
CH2OH
O
HO
H
H
OH
H
OH
CH2OH
D-Fruttosio
Aldopentosi
CHO
H
OH
CHO
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-Ribosio
CH2OH
D-Arabinosio
I carboidrati chiudono intramolecolarmente un
emiacetale o emichetale dando forme cicliche stabili
a 5 o 6 termini dette furanosiche o piranosiche dai
cicli a 5 e 6 termini del furano e pirano
Rappresentazione forme cicliche: formule di Haworth
H
O
H
OH
HO
H
H
OH
H
OH
CH2OH
D-Glucosio
OH
carbonio
anomerico
cis
CH2OH
O OH
1
H
OH
-D-Glucopiranosio
(-D-Glucosio)
O
1
H
HO
H
•
H
5
H
OH
H 5
H
OH
HO
•
•
•
CH2OH
riscritto per mostrare che l'-OH
sul carbonio-5 è vicino al gruppo
aldeidico del carbonio
H
OH
trans
carbonio
anomerico
CH2OH
H 5
H
OH
HO
H
O H
1
OH
OH
-D-Glucopiranosio
(-D-Glucosio)
I gruppi a destra nella proiezione di Fischer puntano in basso nella proiezione di Haworth.
I gruppi a sinistra nella proiezione di Fischer puntano in alto nella propiezione di Haworth.
Per un D-monosaccaride, il gruppo terminale –CH2OH punta in alto nella proiezione di
Haworth.
La configurazione del gruppo-OH anomerico viene specificata in relazione al gruppo –CH2OH
terminale: se il gruppo anomerico –OH è dallo stesso lato del gruppo terminale è : se il gruppo
anomerico-OH è dal lato opposto essa è .
Forme Furaniche
H
CH2OH O
H
H
H
H
OH
OH
OH
-D-Ribofuranosio
(-D-Ribosio)
OH
CH2OH O
H
H
OH
OH
H
-2-Deossi-D-ribofuranosio
(-2-Deossi-D-ribossio)
Formazione di anelli piranosici e furanosici: il caso del fruttosio
CH2OH
CH2OH
O
HO
O
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
D-Fruttosio
HOCH2
HO
H
OH
HO
H O
HO
OH
CH2OH
H
H
H
HOCH2
HO
O
OH
H
H
H
CH2OH
OH
OH
H
CH2OH
OH
O
OH
H
OH
OH
H
H
H
2
CH2OH
1
OH
H
OH
D-Fruttopiranosio
(chetoso)
O
H
HO
C
H2
D-Fruttofuranosio
(chetoso)
5
CH2OH
H
C
H2
HOH2C
O
HO
H
-D-Fruttofuranosio
Il carbonio anomerico è il C-2
e non il C-1 come negli aldosi.
HO
6
H
H
1
O CH2OH
OH
2
OH
OH
H
-D-Fruttopiranosio
La forma piranosica predomina
nei monosaccaridi, mentre nei
disaccaridi è predominante la
forma furanosica.
Rappresentazioni delle conformazioni
6
H
4
CH2OH
5
O
H
OH
H
OH
6
4
1
HO
OH
3
2
H
CH2OH
H
O
5
HO
3
OH
-D-Glucopiranosio
(proiezione di Haworth)
OH
2
OH
1
-D-Glucopiranosio
(conformazione a sedia)
Le forme piraniche non sono planari, ma a sedia,
quella che predomina all’equilibrio ha i sostituenti più
ingombranti equatoriali
CH2OH
CH2OH
O
HO
O
HO HO
HO
OH
OH
OH
-D-Glucosio
-D-Glucosio
OH
Mutarotazione
E’ la spontanea variazione dell’ []D di un anomero puro quando è
messo in soluzione. Essa è dovuta al raggiungimento dell’equilibrio tra
i due anomeri, ciascuno dei quali ha un diverso []D , attraverso la
forma aperta, presente anch’essa all’equilibrio per circa lo 0.03%
OH
H
OH
H
HO
H O
HO
H OH
O
HO
OH
HO
H
H
H
H
OH
H
OH
H
ruota intorno al
legame C-1 - C-2
-D-Glucopiranosio
(-D-Glucosio)
[]D = + 18.7°
OH
H
OH
H
HO
H OH
HO
H
HO
H
H
OH
O
H O
H
HO
H
OH
OH
H
-D-Glucopiranosio
(-D-Glucosio)
[]D = + 112°
+ 52.7:valore dell’[]D della miscela anomerica all’equilibrio
36% anomero (40.32) +64% anomero (11.97)
Zuccheri riducenti
Ossidazione ad acidi aldonici
Gli zuccheri riducenti sono quelli in equilibrio con la forma aperta
aldeidica, che è responsabile dell’attività riducente perché si ossida
facilmente ad acido carbossilico. Gli zuccheri riducenti sono anche
quelli che danno mutarotazione
1 CHO
HO
H
O
HO
1
OH
HO
1 COOH
OH
HO
H
H
OH
H
OH
OH
D-glucosio
ossidante
CH2OH
H
OH
HO
H
H
OH
H
OH
COOH
Acido D-gluconico
Molti saggi di rivelazione degli zuccheri sono basati su questa reazione
H
+
C
O
2 Cu2+ + 4 OH -
Reattivi di Fehling e Benedict
OH
C
O
+ Cu2O + 2 H2O
(precipitato rosso di ossido rameoso)
Determinazione quantitativa del glucosio per via enzimatica
O2
CH2OH
O OH
H
H
OH
H2O
CH2OH
glucosioossidasi H
O
H
HO
H
OH
H
H
Cromogeno ridotto
(incolore)
H
O
HO
OH
-D-Glucosio
H
CH2OH
H2O2
OH
H
OH
OH
H
HO
H
OH
D-Gluconolattone
Perossidasi
O
OH
H
Acido D-Gluconico
Cromogeno ossidato
(colorato)
I glicosidi non sono riducenti né danno mutarotazione perché NON sono in
equilibrio con la forma aperta, a pH neutro.
Ossidazione ad acidi uronici
CHO
H
CHO
OH
HO
H
H
OH
H
ossidazione
enzimatica
H
OH
HO
H
OH
CH2OH
D-Glucosio
H
OH
H
OH
COOH
HO
HO
O
OH
OH
Conformazione a sedia
COOH
Proiezione di Fischer
Acido D-glucuronico
(un acido uronico)
Formazione dei glucuronidi:un meccanismo di detossificazione
COO
HO
HO
_
O
O
HO
OH
Propofolo
Un anestetico
Un glucuronide solubile nell'urina
Acido L-Ascorbico (Vitamina C)
CH2OH
H
OH
CH2OH
H
O
O
HO
ossidazione
riduzione
H
OH
Acido L-ascorbico
(Vitamina C)
OH
O
O
H
O
O
Acido L-deidroascorbico
CHO
CH2OH
O
HO
OH
HO
OH
-D-Glucopiranosio
H
OH
HO
H
CH2OH
HO
H
HO
H
H
OH
H
OH
H
OH
HO
H
OH
H
OH
H
OH
H
OH
D-Glucosio
D-Xilosio
NaBH4
H
CH2OH
D-Mannosio
CH2OH
CH2OH
D-Glucitolo
(Sorbitolo)
Presente in piccole quantità in molti frutti
CH2OH
H
HO
H
OH
H
OH
CH2OH
CH2OH
Mannitolo
Xilitolo
Gli alditoli vengono sintetizzati industrialmente per idrogenazione catalitica degli
aldosi
Vengono impiegati come alternativa agli zuccheri in alimenti dietetici o per diabetici.
Infatti non sono assimilati a livello intestinale e non raggiungono la circolazione
sanguigna.
Disaccaridi ed oligosaccaridi
Sono costituiti da monosaccaridi legati attraverso
legame glicosidico tra il gruppo riducente di un
monosaccaride ed un ossidrile di un’altra unità
monosaccaridica.
Il glucosio può formare diversi disaccaridi per es:
CH2OH
HO
CH2OH
HO
Zucchero riducente
O
O
La configurazione di questo
carbonio non è specificata
OH
O HO
OH
OH
Disaccaride ottenuto
dall’idrolisi dell’amido
Maltosio
Legame -1,4-glicosidico
CH2OH
HO
HO
O
CH2OH
O
OH
HO
O
OH
OH
Disaccaride ottenuto
dall’idrolisi della cellulosa
Cellobiosio
Legame -1,4-glicosidico
Il saccarosio
CH2OH
Legame al glucosio
O
HO
HO
Il comune zucchero da tavola
estratto dalla barbabietola o
dalla canna, presente anche in
molti altri vegetali
OH
HOCH2
O
O
HO
CH2OH
Legame al fruttosio
OH
Saccarosio
Zucchero non riducente
-D- glucopiranosil-(1
2)--D fruttofuranoside
Lo zucchero invertito
In ambiente debolmente acido (industrialmente si usa l’acido citrico) o per
azione dell’enzima invertasi il saccarosio si idrolizza prontamente nei due
monosaccaridi che lo costituiscono.
Questo processo viene detto “inversione” e la miscela che si ottiene
zucchero invertito a causa dell’effetto dell’idrolisi sulle proprietà di rotazione
ottica della soluzione.
Infatti i valori di rotazione specifica per saccarosio, glucosio e fruttosio sono
uguali a +66.5°, +52.7° e –92.4° per cui si osserva il passaggio da una
soluzione di saccarosio con proprietà destrorotatorie ad una di zucchero
invertito con proprietà levorotatorie, con una rotazione specifica data dalla
somma algebrica dei contributi dei due monomeri e cioè pari a –39.7°.
Il lattosio
4.5% nel latte vaccino;
6.5% nel latte umano
Glucosio
Galattosio
OH
CH2OH
HO
O
CH2OH
O
OH
HO
O
OH
OH
Lattosio
Legame -1,4-glicosidico
Intolleranza al lattosio:La
perdita temporanea o
permanente della lattasi
intestinale, l’enzima capace di
idrolizzare il legame
glicosidico del lattosio, porta
a gravi problemi digestivi
poiché solo i monosaccaridi
possono passare nel circolo
sanguigno e il lattosio passa
nell’intestino non digerito
Gruppi Sanguigni
Oligosaccaridi legati alla
superficie delle cellule rosse
del sangue,sono implicati nei
meccanismi di riconoscimento
OH
-D-Galp
OH
O
Gruppo sanguigno O
HO
O
2 O
HO
1
antigene H
-L-Fucp
OH
O
OH
H3C
OH
O
Gruppo sanguigno
A e AB
OH
HO
CH3COHN
-D-GalpNAc
1 OH
-D-Galp
OH
O
O
-L-Fucp
O
2 O
HO
1
3
antigene A
OH
O
H3 C
OH
-D-Galp
OH
OH
O
Gruppo sanguigno
B e AB
antigene B
HO
OH
OH
-D-Galp
OH
O
O
O
3
2 O
HO
1
O
-L-Fucp
OH
H3 C
OH
Polisaccaridi
Sono costituiti da un elevato numero di monosaccaridi
legati da legame glicosidico
I principali sono:
Amido
Glicogeno
Cellulosa
Amido
E’ una miscela di due polimeri del glucosio
p.m. medio 105-106
Amilosio
20-25%
CH2OH
O
legame -1,4-glicosidico
O
CH2OH
HO
OH
O
HO
O
O
Amilopectina
75-80%
CH2OH
O
HO
O
OH
O
p.m. medio 108
O
CH2OH
HO
CH2OH
OH
OH
O
HO
CH2OH
O
HO
O
OH
O
O
legame -1,6-glicosidico su 4-5% delle unità
CH2
OH
O
HO
O
CH2OH
OH
O
Modello di amilopectina
HO
O
OH
O
legame -1,4-glicosidico
legame -1,6-glicosidico
Glicogeno
E’ la riserva di carboidrati degli animali.
Ha struttura ramificata analoga all’amilopectina
Cellulosa
E’ costituita da catene lineari formate da almeno 3000
unità di glucopiranosio unite tramite un legame 1-4 che
determina un arrangiamento a nastro stabilizzato da
ponti idrogeno intramolecolari
H
O
O
H
CH2OH O
H
H
H
H
OHH
H
OH
O
H
O
H
CH2OH O
Legame 1,4-glicosidico
H
H
O
H
CH2OH
O
H
O
O
H
OH
H
H
Legami idrogeno
Nei tessuti vegetali le molecole di cellulosa sono
allineate a formare delle microfibrille. Questa
organizzazione rende la cellulosa insolubile in
qualsiasi solvente e conferisce notevole resistenza
meccanica alle microfibrille.
Gli erbivori ed in particolare i ruminanti
sono in grado di utilizzare la cellulosa
grazie a microorganismi presenti
nell’apparato digerente che possiedono
enzimi cellulolitici. In questo modo
liberano glucosio che fornisce loro
energia mediante trasformazione ad
acidi grassi che sono poi assorbiti ed
utilizzati dagli animali ospiti.










