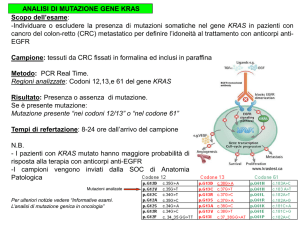
LE MUTAZIONI
1
Mutazione
Qualsiasi cambiamento PERMANENTE del patrimonio genetico
E’ un evento CASUALE, RARO
tasso di mutazione nell’uomo: 1 gamete su un milione è portatore di una
mutazione a un determinato locus
2
Tasso di mutazione
1 gamete su 106 porta una mutazione a un determinato locus
Nel genoma umano ci sono c.a. 20.000 geni
In totale i gameti portatori di mutazione a un qualsiasi locus
codificante saranno 20.000 x 10-6 = 2%
3
Tasso di mutazione e frequenza di
mutazione
Il tasso di mutazione misura la frequenza con cui una mutazione si origina ex
novo in un’unità di tempo “biologico” (di solito una generazione)
La frequenza di mutazione misura la frequenza della mutazione in una
popolazione nel momento dell’osservazione
Il tasso di
mutazione è
di una nuova
mutazione
ogni 7
divisioni
cellulari
La frequenza
di mutazione
nella 4°
generazione è
di 2 mutanti
su 8 cellule
Mutazioni e selezione
Dal punto di vista selettivo una mutazione può risultare:
Vantaggiosa
l’organismo che la porta ha una “fitness”
(capacità riproduttiva) maggiore
Svantaggiosa
l’organismo che la porta ha una fitness minore
Neutra
non influenza la fitness di chi la porta
5
Esistono centinaia di diverse emoglobine mutanti in tutta la popolazione
umana. Molte di queste forme mutanti sono dannose e danno origine a forme
patologiche. Altre sono "neutre" e non sembra arrechino ai portatori nè
vantaggi ne svantaggi.
6
Mutazioni e selezione
L’effetto
delle
mutazioni
va
sempre
correlato all’ambiente in cui l’organismo si
trova: una data mutazione può rivelarsi
svantaggiosa (o neutra) in un dato ambiente,
vantaggiosa in un altro.
7
Melanismo industriale e selezione naturale
Prima della rivoluzione industriale
uno strato di licheni di colore grigio
chiaro ricopriva i tronchi degli alberi
in gran parte dell’Inghilterra. Molte
specie di insetti tra cui le falene
(Biston betularia), vivevano sui
licheni ben mimetizzate alla vista dei
predatori.
In seguito alla industrializzazione
molti dei licheni scomparvero per
inquinamento ambientale, ed alberi e
rocce annerirono a causa dei fumi
inquinanti.
8
Melanismo industriale e selezione naturale
Le falene maculate che a maggioranza
popolavano le campagne inglesi
vennero così a trovarsi completamente
esposte allo sfondo scuro dei tronchi.
Nel 1948 la percentuale di individui
scuri di falena cominciò ad aumentare
nei sobborghi cittadini fino ad arrivare
al 98% nei sobborghi di Manchester, ed
il fenomeno fu definito “melanismo
industriale”. L’apparire delle falene
melanizzate era dovuto ad una
mutazione spontanea in un gene,
seguito dalla selezione naturale in un
ambiente in cui il mancato mimetismo
sfavoriva la sopravvivenza delle falene
maculate a causa di uccelli predatori.
9
Mutazioni e selezione
Mutazione anemia falciforme (sostituzione Glu-Val in catena b
dell’emoglobina) vantaggiosa o svantaggiosa?
10
Fenotipo degli omozigoti per la mutazione bS
(anemia falciforme)
un gene mutato, molti sintomi
Un unica sostituzione aminoacidica
nell’emoglobina
Dolore, ulcere alle gambe, danni a ossa, polmoni, reni, occhi, calcoli
biliari, ittero, anemia, ritardo di crescita
Gli omozigoti SS non si riproducono a causa della grave malattia
genetica; in omozigosi è sicuramente svantaggiosa in qualsiasi
11
ambiente.
Selezione a favore dell’eterozigote
In zone malariche i portatori (eterozigoti per la mutazione bS)
sono avvantaggiati rispetto agli omozigoti selvatici. In ambiente
non malarico i portatori e gli omozigoti per l’allele selvatico
hanno la stessa fitness.
Portatori sani
Affetto
Selvatico
La resistenza alla malaria degli eterozigoti è dovuta al fatto che il
Plasmodio non riesce a completare il suo ciclo nei loro globuli rossi,
a vita breve
12
Il vantaggio dell’eterozigote nelle regioni malariche
Alcune varianti alleliche del gene b (la variante bS in
Africa, le varianti bThal nel Mediterraneo) di per sé
dannose, hanno frequenze elevate in regioni
malariche (o ex malariche).
L’alta frequenza (fino al 30%) dell’allele S o
dell’allele bThal nelle regioni malariche, è dovuta al
fatto che l’eterozigote, a differenza dell’omozigote
sano (che possiede due alleli b normali), non si
ammala di malaria quindi ha > probabilità di
riprodursi trasmettendo i suoi geni (quindi anche
l’allele S o bThal) alla progenie rispetto al wild type
13
Mutazioni germinali e somatiche
Per quanto riguarda la sede della mutazione è necessario
distinguere:
a)
mutazioni germinali che colpiscono i gameti e possono
essere trasmesse alla prole
14
Mutazioni germinali
Mutazioni germinali possono presentarsi in tutte le cellule germinali
o solo in una proporzione di esse (mosaicismo germinale) a seconda
dello stadio di sviluppo dell’embrione in cui sono avvenute, e una
volta trasmesse alla prole diventano “stabili”
Tutte le cellule (tutte le
germinali + tutte le
somatiche) portano la
mutazione
15
Mosaicismo
Coesistenza di 2 o + linee cellulari geneticamente distinte nello stesso
individuo
Mutazione che interviene in una cellula dello zigote o dell’embrione
Tutte le cellule che originano da questa cellula porteranno la mutazione
L’individuo risulterà essere un mosaico di cellule normali e di cellule
mutate
16
Mutazioni germinali e somatiche
Per quanto riguarda la sede della mutazione è necessario
distinguere:
a)
mutazioni germinali che colpiscono i gameti e possono
essere trasmesse alla prole
b)
mutazioni somatiche che colpiscono le cellule somatiche e
si esauriscono nell’individuo. La mutazione viene trasmessa
attraverso la mitosi alla progenie della cellula colpita in
origine = l’individuo sarà un mosaico
17
Mosaicismo somatico
La pigmentazione asimmetrica della
pelle osservata nella sindrome di Cune
Albright è associata a mutazioni nel
gene GNAS1 in alcune ma non in tutte
le cellule
18
Mutazione
Può essere minima, riguardare cioè una singola coppia di basi nel DNA
MUTAZIONE PUNTIFORME
oppure implicare regioni piu’ estese dentro un gene
MUTAZIONE GENICA
fino anche a grosse porzioni del genoma
MUTAZIONE CROMOSOMICA
19
Mutazioni cromosomiche
- anomalie di numero (POLIPLOIDIE, ANEUPLOIDIE)
conseguenza di anomalie nella fecondazione o di errori di
segregazione dei cromosomi durante la formazione dei
gameti
20
Poliploidia
presenza di un numero di cromosomi corrispondente a un multiplo del
corredo aploide (n)
21
Poliploidia
presenza di un numero di cromosomi corrispondente a un multiplo del
corredo aploide (n). Es: triploidia 3n
Origine della triploidia: difetto di fertilizzazione
uovo aploide fecondato da due spermatozoi aploidi
fecondazione tra gamete diploide e gamete aploide
22
Nelle piante è possibile indurre la poliploidia usando
determinate sostanze chimiche
colchicina
Non disgiunzione meiotica
Gameti diploidi
23
La poliploidia è comune nelle felci, nelle piante da fiore, nel
frumento, sia in natura che nelle varietà selezionate dall’uomo
24
La poliploidia è rara negli animali, nei
mammiferi è sempre incompatibile con la vita
25
Aneuploidia
Aneuploidia: presenza di cromosomi in più o in meno rispetto
al corredo diploide (2n+1, 2n-1…)
26
Effetto aneuploidie
2n - 1
2n
2n + 1
Diminuisce o aumenta la quantità di mRNA e quindi di proteine
sintetizzate (vale per tutti i geni localizzati sul cromosoma
interessato)
Sbilanciamento del dosaggio genico
27
Mutazioni cromosomiche
- anomalie di numero (ANEUPLOIDIE, POLIPLOIDIE)
conseguenza di errori di segregazione dei cromosomi
durante la formazione dei gameti, o di anomalie nella
fecondazione
- anomalie di struttura
conseguenza di rotture cromosomiche
28
Anomalie di struttura dei cromosomi
*
29
Conseguenze delle anomalie strutturali
Duplicazioni/delezioni: sbilanciamento del
dosaggio genico (monosomia / trisomia
parziale)
Inversioni/traslocazioni:
potrebbe esserci
rottura genica (la rottura avviene proprio
all’interno di un gene)
30
Esempio di traslocazione reciproca 9-22 in
CML (leucemia mieloide cronica)
Avviene nelle cellule staminali ematopoietiche
La rottura avviene a livello di due geni, con formazione di un gene di fusione
La proteina di fusione bcr-abl porta a crescita cellulare incontrollata
31
Mutazione
Può essere minima, riguardare cioè una singola coppia di basi nel DNA
MUTAZIONE PUNTIFORME
33
Mutazioni conseguenze (1)
Un’alta % (98%) del nostro genoma contiene regioni non
codificanti.
Le mutazioni che riguardano queste regioni non hanno di solito
alcuna particolare conseguenza sul fenotipo, sono quindi
selettivamente neutre
34
Negli eucarioti i singoli geni sono separati da lunghissime
sequenze non codificanti
Gene 1
Gene 2
Gene 3
mutazione
35
Queste mutazioni sono selettivamente neutre,
determinano la variabilità genetica individuale
polimorfismi del DNA
(SNP, VNTR, SSRs)
Identificazione
individuale
(medicina forense,
paternità)
I polimorfismi si trovano in zone del DNA che non hanno alcuna
funzione
codificante:
rappresentano
delle
varianti
fenotipicamente invisibili che hanno l’utilità di marcare
molecolarmente la variabilità fra individuo e individuo.
36
Polimorfismi del DNA esempio: Microsatelliti (o Short Tandem Repeats)
sequenze ripetute di DNA non codificante costituiti da unità di ripetizione
molto corte (1-5 bp). Per un determinato microsatellite possono esistere
numerosi alleli diversi, che differiscono tra loro per il numero di ripetizioni
Trinucleotide repeat CTT
Gli alleli differiscono per il numero delle ripetizioni CTT
37
Poiché il numero di varianti alleliche (numero di ripetizioni) al singolo locus
(microsatellite) presenti nella popolazione è elevato, è probabile che individui
diversi abbiano genotipi diversi
6,10
7,8
8,8
8,9
7,9
6,8
38
Applicazioni in medicina legale
L’analisi contemporanea di tanti polimorfismi permette di identificare un
singolo individuo in modo pressochè univoco
polimorfismo A
polimorfismo B
Genotipo individuo sospetto 1 al locus A: A2/A4 , al locus B: B3/B7
Genotipo individuo sospetto 2 al locus A: A2/A5, al locus B: B4/B4
Genotipo tracce biologiche sul luogo del delitto: A2/A5 B4/B4
39
Mutazioni intrageniche
promotore
Gene
mutazione mutazione
Una mutazione che cade in sequenze regolatrici potrebbe alterare
il legame coi fattori di trascrizione, influendo sul
livello di trascrizione del gene (quantità di mRNA)
40
Mutazioni intrageniche
Esone
introne
Esone
introne
Esone
splicing
mutazione
Mutazioni che avvengono nelle sequenze introniche di solito non hanno
effetto sul fenotipo, a meno che non cadano in particolari sequenze
localizzate ai confini tra esone e introne
mutazioni di splicing
41
Intron retention
Exon skipping
42
Mutazioni intrageniche
Esone
introne
Esone
introne
Esone
splicing
mutazione
43
Mutazioni conseguenze (2)
Le mutazioni che riguardano porzioni codificanti di geni
(ESONI) di solito hanno delle conseguenze fenotipiche perché
possono comportare cambiamenti nella sequenza aminoacidica
codificata.
Es:SOSTITUZIONI DI SINGOLE BASI
MUTAZIONE MISSENSO GAAGAT (glu-asp)
MUTAZIONE NONSENSO GAGTAG (glu-stop)
N.B. spesso però una mutazione riguardante la terza base di un
codone non ne cambia il significato (ridondanza codice genetico):
MUTAZIONE SINONIMA (NEUTRA): GAAGAG (glu-glu)
44
nonsenso
GAGTAG (glu-stop)
sinonima GAAGAG
missenso
GAAGAT (glu-asp)
45
Mutazioni in sequenza codificante e conseguenze sulla
traduzione: mutazione missenso
46
Effetto di una mutazione missenso
La mutazione potrà inserire un aminoacido con le stesse
caratteristiche chimiche (ingombro sterico, carica elettrica) di
quello originario. In questo caso gli effetti sulla proteina saranno
minimi.
La sostituzione con un aminoacido con caratteristiche chimiche
diverse produrrà invece un cambiamento nella struttura della
proteina e di conseguenza della sua funzione
47
Esempio di mutazione missenso
Anemia falciforme: mutazione missenso nel gene bglobina. L’acido
glutammico in posizione 6 (carico negativamente) viene sostituito
da valina (idrofobico)
48
Esempio di mutazione missenso
La valina in posizione 6 interagisce con una valina di un’ altra molecola
di emoglobina, formando aggregati molecolari che precipitano nel
globulo rosso
49
Mutazioni in sequenza codificante e conseguenze sulla
traduzione: mutazione nonsenso
Una mutazione nonsenso porterà alla sintesi di una proteina tronca
50
Mutazioni conseguenze (3)
Mutazioni
in
sequenze
INSERZIONE/DELEZIONE
codificanti
che
comportano
di basi (in n° ≠ 3) causano
slittamento della cornice di lettura e hanno sempre conseguenze
fenotipiche (di solito svantaggiose):
proteina diversa e terminazione prematura.
Sono dette MUTAZIONI FRAMESHIFT
51
Mutazioni “frameshift”
Viene alterata la lettura di tutti i codoni a valle dell’inserzione /delezione
Delezione di 3nt non provoca frameshift
52
Antigeni di superficie: il gruppo sanguigno AB0
Gli alleli A e B codificano per due glicosiltransferasi con diversa
specificità
L’allele 0 codifica per una forma inattiva di glicosiltransferasi
53
Esempio mutazione frameshift
Delezione di singolo nucleotide nell’ allele 0 del locus AB0
provoca cambiamento del modulo di lettura dal codone 86 e
terminazione prematura 30 aa dopo. La glicosiltransferasi
codificata dall’allele 0 è inattiva.
54
Esempio di delezione di 3 nucleotidi
Fibrosi Cistica: delezione di un codone nel gene CFTR che
porta alla sintesi di un polipeptide mancante di un aminoacido
55
MUTAZIONICAUSE
SPONTANEA
insorge in assenza di agenti mutageni esterni ed è prodotta da errori
nei processi di ricombinazione, replicazione e/o riparazione del
DNA
INDOTTA
da agenti mutageni chimici o fisici
56
Mutazione da errore di ricombinazione:
crossing over ineguale
57
Mutazione da errore di replicazione
Il processo di replicazione del DNA rappresenta la principale fonte di
mutazioni. Tutti gli organismi possiedono due meccanismi fondamentali di
salvaguardia della fedeltà dell’informazione molecolare:
Correzione di bozze (corregge gli errori di appaiamento commessi dalla
DNA polimerasi mentre la replicazione è in corso)
C G T GAACTG
G CAT
C G T GAACTG
GCA CTT . . .
T
Riparazione
degli appaiamenti errati dopo replicazione del DNA
58
Mutazioni indotte da agenti mutageni
Il tasso naturale di mutazione del DNA viene
incrementato dall’interazione ambientale con agenti
chimici e fisici
MUTAGENI
59
Mutageni chimici
Esistono
varie
sostanze
chimiche
che interagiscono con il DNA modificando e/o
danneggiando le basi azotate e causano appaiamenti
errati
60
Mutageni chimici
I mutageni chimici possono causare sostituzioni di nucleotidi
esempio: aflatossina B1
micotossina presente in alcune muffe. In condizioni ambientali
favorevoli
le
spore
degli
Aspergillus
germinano
e
successivamente colonizzano svariate tipologie di alimenti, quali
mais, arachidi ed altri semi oleosi.
61
Mutageni chimici
I mutageni chimici possono causare inserzioni o delezioni di
nucleotide
Esempio: benzopirene
nel fumo di sigaretta, nello scarico dei motori Diesel, nella
carbonizzazione dei cibi…
62
Fumo, cancro e riparazione del DNA
La capacità di riparare i danni al DNA arrecati dal
fumo (ossidazione delle guanine) dipende dall’
enzima OGG (8-oxoguanine DNA N-glycosylase).
Esiste una variabilità individuale nella produzione
dell’enzima.
La variante allelica 326 Ser del gene hOGG1 ha
un’attività enzimatica maggiore della variante 326
Cys.
I fumatori non hanno tutti lo stesso rischio di
cancro: chi ha bassa attività di OGG ha un rischio
decisamente maggiore (30-120 volte) di chi, a
parità di n° sigarette fumate, ha naturalmente alti
livelli di OGG
Il danno finale è il risultato di due fattori di rischio indipendenti:
Il fumo + la ridotta capacità di riparare le guanine modificate 63
Mutageni fisici
Radiazioni UV a bassa energia, poco penetranti
Radiazioni ionizzanti (raggi X, raggi a, b, g), ad alta
energia, altamente penetranti
64
Meccanismo di mutagenicità UV
Il danno è localizzato a livello superficiale
(pelle)
Inducono la formazione di dimeri di timina
(formazione di legame covalente tra due T
adiacenti sullo stesso filamento)
Per ogni secondo di esposizione al sole si producono 50-100
dimeri in ogni cellula della pelle di cui il 2% cadono in coding
sequences
65
Meccanismo di mutagenicità radiazioni
ionizzanti
A causa della loro alta energia hanno un forte potere
penetrante
Trasferiscono energia alle molecole biologiche con cui
collidono (DNA, lipidi, proteine) modificandole e
danneggiandole
66
Danni al DNA da radiazioni ionizzanti
a
a)
Rottura di singolo
filamento
b)
Rottura del doppio
filamento
c)
Modificazione
chimica delle basi
d)
Rimozione di
singole basi
b
c
d
67