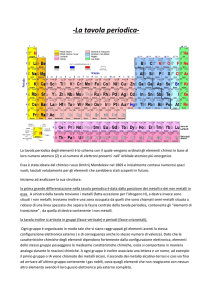
LA TAVOLA PERIODICA DEGLI ELEMENTI
INTRODUZIONE
Fin dalla seconda metà del XVII secolo, gli elementi conosciuti erano circa sessanta e già si poneva il
problema di classificarli: si notò, infatti, che elencando gli elementi in ordine di massa atomica crescente,
essi avevano proprietà chimiche regolari e comparivano nell’elenco a intervalli ben definiti, mai vicini tra
loro. Questa periodicità delle caratteristiche chimiche venne considerata come una pura curiosità senza
particolare importanza, fino a quando il chimico russo Dmitrij Ivanovic Mendeleev cominciò ad ipotizzare
che questo comportamento fosse dovuto alla struttura atomica dei singoli elementi e pose i 60 elementi
conosciuti secondo uno schema ben preciso:
o sistemazione in righe orizzontali (PERIODI) secondo la massa atomica crescente;
o sistemazione in colonne verticali (GRUPPI) secondo le proprietà chimiche simili.
Così facendo, Mendeleev costruì una tabella in cui il 1° periodo era formato solo da due elementi (Idrogeno
ed Elio) ed i periodi successivi erano costituiti da sette elementi (dal Litio al Fluoro; dal Sodio al Cloro…);
inoltre, egli introdusse un VIII° gruppo per sistemare i metalli pesanti. Convinto della periodicità rilevata, lo
studioso russo lasciò anche delle caselle vuote (alcuni elementi sembravano fuori posto!) che sarebbero
state occupate successivamente da nuovi elementi scoperti in seguito. Quindi, egli previde l’esistenza di
elementi non ancora scoperte e le loro proprietà proprio in base alla periodicità delle caratteristiche
chimiche.
Prima Tavola Periodica di Mendeleev (1869)
Negli stessi anni in cui Mendeleev elaborò la sua tavola periodica, vennero scoperti i gas nobili
(chimicamente inerti e stabili) ai quali fu attribuito il gruppo “zero” e vennero inseriti mano a mano i nuovi
elementi scoperti; i metalli del gruppo VIII° furono ulteriormente suddivisi nei due sottogruppi A e B,
sempre in base alle loro proprietà chimiche.
1
La suddivisione degli elementi in GRUPPI era basata sulla forma degli ossidi che si ottenevano facendo
reagire i vari elementi con l’ossigeno e dei cloruri ottenuti per reazione con il cloro:
a) gli elementi del I° gruppo davano ossidi del tipo M2O (Na2O, K2O…) e cloruri del tipo MCl (NaCl, KCl…);
b) gli elementi del II° gruppo davano ossidi del tipo MO (MgO, CaO, BaO…) e cloruri del tipo MCl2 (MgCl2,
CaCl2, BaCl2…);
c) gli elementi del III° gruppo davano ossidi del tipo M2O3 (Al2O3, B2O3…) e cloruri del tipo MCl3 (AlCl3…).
La successiva suddivisione dei vari gruppi in sottogruppi A e B è basata sempre sulle proprietà chimiche; ad
esempio, Rame, Argento ed Oro (sottogruppo IB), pur generando ossidi del tipo M2O come gli elementi del
sottogruppo IA, sono molto meno reattivi e si ossidano difficilmente.
Negli anni successivi, la tavola periodica subì ulteriori modifiche fino alla forma attuale in cui gli elementi
dei sottogruppi B sono inseriti tra il II° ed il III° sottogruppo A. Per essere più precisi, la moderna tavola
periodica prevede una numerazione dei gruppi da 1 a 18 con 7 periodi di cui due, originati dagli elementi
Lantanio ed Attinio, sono posti esternamente al blocco compatto della successione degli elementi secondo
il numero atomico Z crescente.
Gli elementi rappresentativi della tavola periodica si trovano nei sottogruppi A, mentre gli elementi dei
sottogruppi B si rifanno sotto certi aspetti a quelli dei sottogruppi A. Da sottolineare che tra elementi di
diversi gruppi A esistono notevoli differenze.
2
La prima distinzione che risulta evidente è quella tra METALLI (solidi lucenti, buoni conduttori di calore ed
elettricità) e NON METALLI (solitamente gassosi, con caratteristiche opposte a quelle dei metalli), indicata
da una linea a gradini che va dal Boro all’Astato (gli elementi addossati contro questa linea sono detti SEMIMETALLI ed hanno caratteristiche intermedie tra quelle dei metalli e dei non metalli).
Dato che gli elementi riportati nella tavola periodica presentano caratteristiche chimico – fisiche regolari,
essi risultano suddivisi nei seguenti gruppi:
Gruppo I metalli alcalini: a parte l’Idrogeno, sono elementi monovalenti che danno idruri del tipo MH
ed ossidi del tipo M2O; reagiscono violentemente con l’acqua originando gli idrossidi del tipi
MOH.
Gruppo II metalli alcalino – terrosi: sono elementi bivalenti che danno idruri del tipo MH2 ed ossidi
del tipo MO; sono tutti metalli teneri, malleabili e buoni conduttori di calore.
Gruppo III sono elementi trivalenti con caratteristiche metalliche che aumentano andando dall’alto
verso il basso lungo il gruppo, ovvero il Boro è un non metallo, Alluminio e Gallio sono
semimetalli (comportamento anfotero) mentre il Tallio è un metallo.
Gruppo IV sono elementi che possono avere valenze diverse, ma la valenza massima rispetto
all’idrogeno e all’ossigeno è sempre 4; in analogia al gruppo precedente, il Carbonio è un
tipico non metallo, Silicio e Germanio sono semimetalli e Stagno e Piombo sono metalli.
Gruppo V sono elementi prevalentemente non metallici (Azoto e Fosforo) e semimetallici (Arsenico
ed Antimonio hanno comportamento anfotero). Sono metalli solo gli elementi più pesanti
(Bismuto). La valenza massima rispetto all’ossigeno è 5, quella rispetto all’idrogeno è 3.
Gruppo VI gli elementi più leggeri sono non metalli (Ossigeno e Zolfo), mentre il Polonio è un vero
metallo. Hanno valenza massima rispetto all’ossigeno uguale a 6 e rispetto all’idrogeno
uguale a due.
3
Gruppo VII alogeni: sono tutti non metalli che si trovano in natura sottoforma di sali; hanno valenza
massima rispetto all’ossigeno uguale a 7 e valenza 1 rispetto all’idrogeno.
Gruppo VIII gas nobili: sono elementi chimicamente inerti, perciò molto stabili; non legandosi ad altri
elementi essi posseggono valenza nulla.
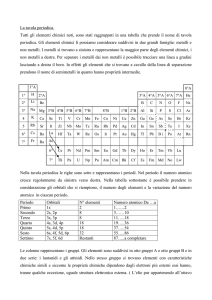
LA MODERNA TAVOLA PERIODICA
Alla prima classificazione degli elementi si arrivò semplicemente studiando la periodicità delle proprietà
chimiche degli elementi, periodicità che venne completamente interpretata nei primi decenni del 1900
grazie agli studi sulla struttura elettronica degli atomi e che portò alla definitiva compilazione della
moderna tavola periodica secondo i seguenti concetti fondamentali:
1) il posto occupato da ciascun elemento nel sistema periodico è stabilito dal numero atomico Z che
indica il numero di protoni presenti nel nucleo, ovvero, per la neutralità elettrica della materia, il
numero di elettroni che si trovano intorno al nucleo di un atomo neutro; questo indica che la
periodicità riscontrata nelle proprietà chimiche lungo il gruppo dipende dalla struttura elettronica
degli atomi, cioè dal numero e dalla disposizione degli elettroni sul livello più esterno (elettroni di
valenza);
2) le righe orizzontali formano 7 PERIODI ed il numero di ogni periodo indica il livello principale di
energia (determinato dal numero quantico principale n) sul quale è possibile trovare gli elettroni di
valenza; ad esempio, gli elementi del periodo 4 possiedono gli elettroni di valenza sul livello
energetico identificato da n = 4. All’interno di ogni periodo, il numero di elettroni di valenza
aumenta procedendo da sinistra verso destra per cui le proprietà chimiche cambiano notevolmente
lungo il periodo;
4
3) le colonne verticali formano i cosiddetti GRUPPI numerati ,secondo la IUPAC, da 1 a 18 in modo
sequenziale; in alternativa, i gruppi principali sono indicati con numeri romani (ad ogni numero
romano corrisponde il numero di elettroni di valenza), per cui si hanno otto gruppi principali in cui
avviene il riempimento sequenziale degli orbitali s e p; ne deriva che gli elementi appartenenti allo
stesso gruppo hanno proprietà chimiche simili in quanto hanno lo stesso numero di elettroni di
valenza;
4) tra il II ed il III gruppo si trovano gli elementi di transizione suddivisi in gruppi numerati dal 3 al 12;
in questi atomi, gli elettroni si trovano negli orbitali d;
5) distaccati dal blocco principale si trovano due file di 14 elementi (serie dei LANTANIDI e serie degli
ATTINIDI) che presentano gli elettroni di valenza negli orbitali f.
Quindi,si può affermare che gli elementi della tavola periodica possono essere considerati come
appartenenti a quattro blocchi diversi,a seconda degli orbitali occupati dagli elettroni di valenza,
denominati blocco s (all’estrema sinistra della tavola, comprende i metalli alcalini e alcalino – terrosi),
blocco p ( all’estrema destra della tavola, comprendente i gruppi dal III al VIII), blocco d (al centro della
tavola, comprende gli elementi di transizione) e blocco f (serie distaccate dei lantanidi e degli attinidi, detti
anche terre rare).
In base a quanto detto finora, è molto semplice risalire alla struttura elettronica di qualsiasi elemento
conoscendo la sua posizione sulla tavola periodica. Ad esempio, il Bismuto che appartiene al 6° periodo ed
al V gruppo ha cinque elettroni di valenza nel livello di energia identificato da n = 6; più precisamente,
appartenendo al blocco p, i suoi cinque elettroni si trovano in numero di due nell’orbitale 6s ed i rimanenti
tre negli orbitali 6p. Altrettanto semplice è effettuare l’operazione inversa, cioè assegnare il posto ad un
atomo conoscendone il numero di elettroni; ad esempio lo zolfo possiede 16 elettroni, per cui la sua
configurazione elettronica sarà 1s22s22p63s23p4 lo zolfo si trova nel blocco p, all’intersezione tra il 3°
periodo ed il gruppo VI.
5
LE PROPRIETA’ PERIODICHE DEGLI ELEMENTI
RAGGIO ATOMICO E VOLUME ATOMICO
Il volume degli atomi è dovuto agli elettroni che si muovono negli orbitali atomici intorno al nucleo ed è
definito come lo spazio occupato da una mole dell’elemento , ovvero come il rapporto tra il peso atomico e
la densità dell’elemento allo stato solido. Con raggio atomico, invece, si intende la metà della distanza di
minimo avvicinamento tra due atomi. Entrambe queste grandezze decrescono lungo il periodo ed
aumentano lungo il gruppo; infatti, il numero quantico principale n che definisce l’energia dell’orbitale,
tanto maggiore quanto più l’orbitale si estende nello spazio lontano dal nucleo, rimane invariato lungo il
periodo, ma aumenta lungo il gruppo aumento del raggio atomico lungo il gruppo. Invece, il raggio
atomico diminuisce lungo il periodo poiché, man mano che gli elettroni si aggiungono sullo stesso livello di
energia (che corrisponde anche ad un aumento della carica nucleare positiva), si verifica una contrazione
della nube elettronica intorno al nucleo.
ENERGIA DI IONIZZAZIONE
L’energia di ionizzazione è definita come l’energia necessaria per strappare un elettrone da un atomo in
fase gassosa e portarlo a distanza infinita:
A + energia A+ + eInfatti, fornendo energia ad un atomo, i suoi elettroni saltano su livelli energetici superiori (salti quantici)
finché, con energia ancora maggiore, è possibile l’espulsione di un elettrone dal guscio più esterno di un
atomo con formazione di uno ione positivo o CATIONE (di dimensioni minori rispetto all’atomo neutro).
Tale energia aumenta lungo il periodo (aumentando il numero atomico, aumenta la carica nucleare e gli
elettroni sono maggiormente trattenuti) e diminuisce lungo il gruppo poiché gli elettroni più esterni si
trovano sempre più lontani dal nucleo poiché occupano orbitali più esterni (risentono meno fortemente
dell’attrazione esercitata dal nucleo).
CATIONE SODIO
ANIONE CLORO
6
AFFINITA’ ELETTRONICA
L’affinità elettronica è l’energia che viene liberata quando una atomo in fase gassosa cattura un elettrone:
A + e- A- + energia
Tale energia rappresenta una misura della tendenza degli atomi a formare ioni negativi o ANIONI (di
dimensioni maggiori rispetto all’atomo neutro. E’ massima per gli elementi in alto a destra della tavola
periodica (ossigeno, fluoro, zolfo, cloro, bromo) e segue lo stesso andamento dell’energia di ionizzazione.
ELETTRONEGATIVITA’
L’elettronegatività è la misura della tendenza di un atomo coinvolto in un legame ad attrarre su di sé gli
elettroni di legame. Essa aumenta lungo il periodo e diminuisce lungo il gruppo, per cui gli atomi più
elettronegativi si trovano in alto a destra della tavola periodica (Fluoro, Ossigeno…), mentre quelli meno
elettronegativi si trovano in basso a sinistra (Francio, Cesio…). La spiegazione di questo andamento è molto
semplice: procedendo lungo il periodo, aumenta il numero di protoni e gli elettroni si trovano sempre nello
stesso livello di energia; ne deriva che il nucleo esercita una maggiore attrazione sugli elettroni. Scendendo,
invece, lungo il gruppo, l’atomo diviene sempre più grande poiché aumenta il numero di livelli energetici;
ne segue che il nucleo esercita una forza attrattiva verso gli elettroni esterni sempre minore.
7
VARIAZIONE DELLE PROPRIETA’ PERIODICHE DEGLI ELEMENTI
I
VIII
II
III
IV V
VI VII
1
2
3
4
5
6
7
8
9
10 11 12
3
5
Blocco p
Blocco s
4
Blocco d
6
7
Blocco f
ELETTRONEGATIVITA’
ENERGIA DI IONIZZAZIONE/ AFFINITA’ ELETTRONICA
RAGGIO ATOMICO
il verso della freccia
indica l’aumento della
grandezza
CARATTERE METALLICO
8
9