Prof.ssa Patrizia Gallucci
https://www.youtube.com/watch?v=EN__Dkkz3TQ
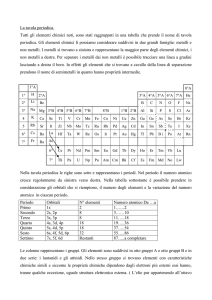
GRUPPO
PERIODO
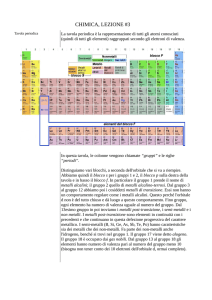
TAVOLA PERIODICA
Gli elementi di uno stesso gruppo hanno ugual
numero di elettroni esterni (di valenza)
Esiste corrispondenza tra numero quantico dello
strato esterno e periodo
Esiste corrispondenza tra numero di elettroni
esterni e il numero del gruppo A di appartenenza
In base al tipo di orbitale che si va riempiendo si
possono suddividere gli elementi in 4 blocchi:
blocco s (I e II gruppo A),
blocco p (III,IV;V,VI,VII,VIII gruppo A),
blocco d (elementi di transizione)
blocco f (attinidi e lantanidi)
BLOCCO s :metalli alcalini (I A) e
metalli alcalino-terrosi (II A)
NON METALLI :
ALOGENI (VII A)
GAS NOBILI (VIII) A
AFFINITA’ ELETTRONICA
RAGGIO ATOMICO
CARATTERE METALLICO
ELETTRONEGATIVITA’
L’ AFFINITA’ ELETTRONICA è l’energia in gioco
quando un atomo neutro prende un elettrone.
Aumenta in un periodo andando da sinistra verso
destra e diminuisce in un gruppo andando verso il
basso.
RAGGIO
ATOMICO: è la
metà della distanza tra due
atomi
di
uno
stesso
elemento legati tra loro.
Aumenta lungo un gruppo
dall’alto verso il basso e
diminuisce in un periodo
andando da sinistra verso
destra.
L’ELETTRONEGATIVITA’ è la tendenza di un
atomo che ha formato un legame di attrarre
più vicini a sé gli elettroni di legame.
Il suo valore diminuisce in un gruppo
andando verso il basso. Aumenta in un
periodo andando verso destra.
AFFINITA’ ELETTRONICA
ELETTRONEGATIVITA’
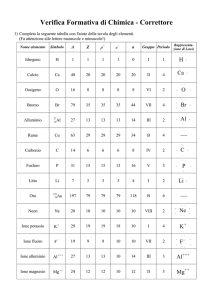
Gli elementi di uno stesso gruppo hanno la
stessa configurazione elettronica esterna
( elettroni di valenza) e quindi proprietà
chimiche simili.
I gas nobili sono stabili e non formano
legami,perché hanno 8 elettroni nel livello
più esterno (ottetto).
• I metalli cedono gli elettroni dell’ultimo
strato e raggiungono la configurazione del
gas nobile che li precede nella tavola
periodica.
• I non metalli tendono invece a raggiungere
l’ottetto del gas nobile che li segue,
acquistando o mettendo in comune gli
elettroni di valenza.