Dottorato di Ricerca in Tecnologie Biomediche in Medicina Clinica
Dosaggio del PTH post tiroidectomia e suo
valore predittivo di ipocalcemia e terapia
sostitutiva a lungo termine
Relatore
Candidato
Chiar.mo Prof. Giorgio De Toma
Dott.ssa Ursula Basile
ANNO ACCADEMICO 2010 – 2011
INTRODUZIONE
Note di embriologia e anatomia chirurgica delle paratiroidi
Accenni di tecnica chirurgica
Ruolo del paratormone nell’omeostasi del calcio-fosforo
Clinica dell’ipoparatiroidismo
Trattamento nell’ipoparatiroidismo postoperatorio
MATERIALI E METODI
RISULTATI E DISCUSSIONE
CONCLUSIONI
GRAFICI
BIBLIOGRAFIA
2
INTRODUZIONE
La prima descrizione di casi di tetania, conseguenti a complicanza iatrogena
dell’intervento di tiroidectomia, venne effettuata da Kocher alla fine dell’800,
ma restava oscuro il movente alla base di tale evento. Dobbiamo aspettare,
dopo qualche anno, le brillanti osservazioni del francese Gley, il quale si
accorse che la tetania post tiroidectomia, nei cani operati, era secondaria
all’asportazione delle paratiroidi; tutto ciò, pur tuttavia, non bastava a
spiegarne il fenomeno. Furono Mc Callum e Voegtlin a scoprire, agli inizi del
secolo scorso, che quelle quattro piccole ghiandole, situate in posizione
simmetrica rispetto alla tiroide, regolavano la calcemia, e da ciò furono in
grado di trattare l’evento avverso con la somministrazione terapeutica di tale
elettrolita. Attualmente, divenuta ormai un intervento di routine, la
tiroidectomia totale ha un ruolo ben definito nel trattamento delle patologie
benigne e maligne della tiroide, con una bassa incidenza di complicanze e di
mortalità operatoria. La maggior parte delle complicanze rappresentata dalgli
squilibri metabolici in particolare l’ ipocalcemia si presenta con notevoli
variazioni nelle varie casistiche con un’incidenza massima del 64% dei casi,
contro il 22% dei casi di lesione del nervo laringeo ricorrente, l’8% delle
3
emorragie, il 3% delle lesioni del nervo laringeo superiore, e il 2% delle
complicanze settiche. L’ipocalcemia peraltro sebbene in vari studi presenti il
nadir entro le 24–48 ore può presentarsi anche in IV-V giornata post
operatoria. Mentre eventuali emorragie o lesioni ricorrenziali si manifestano
entro le prime ore dall’intervento. Il potenziale manifestarsi di ipocalcemia
pertanto condiziona più di ogni altra possibile complicanza l’allungamento
del tempo di degenza post’operatoria.
Va precisato che l’ipocalcemia si distingue in transitoria o definitiva a seconda
della durata della sintomatologia: in genere viene considerata definitiva
un’ipocalcemia che si protragga per più di 6 mesi dall’intervento e che
necessiti di un adeguato supporto farmacologico. Molteplici sono le ipotesi per
spiegare l’insorgenza dell’ipocalcemia transitoria: tra queste l’alterazione
dell’integrità anatomica e della vascolarizzazione delle paratiroidi da
traumatismo (“stordimento” paratiroideo); l’increzione di calcitonina dovuta
alla manipolazione intraoperatoria della ghiandola tiroide; l’ipotiroidismo
temporaneo postoperatorio, che determinerebbe una resistenza periferica al
PTH con conseguente ipocalcemia (questa teoria spiegherebbe il motivo per
cui un paziente, assumendo la terapia ormonale sostitutiva, ritorna eutiroideo e
spesso ridiventa anche normocalcemico); la cosiddetta bone hungry syndrome,
4
che sembra essere alla base dell’ipocalcemia che si verifica dopo gli interventi
di tiroidectomia in pazienti ipertiroidei che avevano sviluppato un quadro
patologico di osteodistrofia documentata dall’aumento dell’isoenzima osseo
della fosfatasi alcalina e dall’idrossiprolinuria, e per cui l’improvviso calo dei
livelli di ormone tiroideo post tiroidectomia favorirebbe il passaggio del calcio
ematico all’osso, determinandone così un calo in valore assoluto del valore
dosabile nel sangue; l’emodiluizione perioperatoria del calcio; l’alcalosi
intraoperatoria che si appalesa negli interventi di media e lunga durata. Se
l’ipocalcemia transitoria non è pertanto necessariamente conseguenza di un
danno alle ghiandole paratiroidi, l’ipocalcemia permanente è conseguente alla
loro accidentale asportazione o ad una compromissione della loro funzionalità.
Ricordiamo brevemente l’origine embriologica e l’anatomia chirurgica delle
paratiroidi per evidenziarne la stretta connessione con il tessuto tiroideo e la
variabilità di posizione che ne conseguono.
Note di embriologia e anatomia chirurgica delle paratiroidi
Le
2 paratiroidi superiori originano dalla quarta tasca branchiale, e le 2
inferiori dalla terza tasca; in entrambi i casi le ghiandole sono intimamente
associate ai derivati delle rispettive tasche (le paratiroidi inferiori al timo, le
5
superiori al complesso tiroideo laterale). Quando l’embrione matura e la corda
timica scende, le paratiroidi inferiori migrano caudalmente. Questa migrazione
è estremamente variabile determinando una frequente localizzazione ectopica
che va dalla mucosa faringea ad una localizzazione peri timica all’interno della
cavità toracica, mentre le paratiroidi superiori, soggette a minor variabilità di
localizzazione, raramente restano
completamente incluse nel parenchima
tiroideo. Circa il 50% di tutte le paratiroidi sono adiacenti all’area in cui
l’arteria tiroidea inferiore entra nel parenchima tiroideo, situate nell’atmosfera
cellulo-adiposa compresa tra la guaina peritiroidea e la capsula del corpo della
tiroide. Le paratiroidi superiori si trovano generalmente tra 1/3 superiore e 1/3
medio del margine postero-mediale della tiroide, in posizione posteriore
rispetto al nervo ricorrente, proprio sopra il ramo più alto dell’arteria tiroidea
inferiore; in un 75% dei casi in posizione media a livello del II anello tracheale
tra i rami di divisione dell’a. tiroidea inferiore e nel restante 25 % dei casi in
posizione alta in relazione con il piccolo corno della cartilagine tiroide, il
muscolo cricofaringeo e la zona di penetrazione dei nervi ricorrenti. Le
paratiroidi inferiori si possono trovare in un area di maggior dispersione ma
nella maggior parte dei casi in posizione bassa a livello di IV–V anello
tracheale, al limite del polo inferiore del lobo tiroideo o all’apice della loggia
6
timica o in un 20 % dei casi in posizione media peri ricorrenziale tra i rami di
divisione arteriosi. Misurano in media
mm. 5-7 x 3-4 x 0,5-2. Il peso
complessivo delle paratiroidi varia fra 90 e 200 mg, e le superiori sono in
genere più piccole delle inferiori; sono di solito color camoscio o gialle, di
consistenza lievemente superiore a quella della ghiandola tiroidea. Dal punto
di vista istologico sono costituite da parenchima contenente cellule principali e
ossifile, organizzate in trabecole o isole in uno stroma adiposo. I vasi
responsabili dell’irrorazione di ciascuna ghiandola costituiscono una vera e
propria struttura ilare. Le paratiroidi
presentano una vascolarizzazione
arteriosa di tipo terminale quasi esclusivamente da parte dell’arteria tiroidea
inferiore. Le paratiroidi in sede media ed alta possono essere vascolarizzate sia
da una lunga e sottile branca dell’arcata anastomotica marginale posteriore di
Halsted ed Evans, tesa nel bordo posteromediale del lobo tiroideo, tra l’arteria
tiroidea inferiore e il ramo di triforcazione posteriore dell’arteria tiroidea
superiore, sia da una branca dell’arteria tiroidea superiore (5%). Il drenaggio
venoso è assicurato da una rete superficiale sottocapsulare che confluisce verso
l’ilo e da una rete profonda a distribuzione più variabile, non sistematizzata. In
realtà, le paratiroidi superiori drenano esclusivamente nella ghiandola tiroide
ed ogni tiroidectomia totale, eliminando questo scarico venoso, comporta il
7
loro infarcimento; ciò spiega le ipocalcemie dopo tiroidectomia totale con
conservazione delle sole paratiroidi superiori. Le paratiroidi in sede media o
inferiore drenano rispettivamente nelle vene tiroidee medie ed inferiori.
Accenni di tecnica chirurgica
Per quanto concerne la ricerca intraoperatoria delle ghiandole paratiroidi, in
modo molto pratico, siamo abituati a suddividere schematicamente e
virtualmente l’area di ricerca in tre zone che verranno successivamente
esplorate: la faccia posteriore del lobo tiroideo; il tragitto del nervo ricorrente;
infine la loggia timica. La stragrande maggioranza delle ghiandole paratiroidi
verrà scoperta a livello di una di queste zone; si parlerà quindi di paratiroide
“tiroidea”, di paratiroide “ricorrenziale”, o di paratiroide “timica”. In pratica, al
momento dell’apertura del tessuto cellulo-adiposo che lo condurrà al nervo
ricorrente, il chirurgo deve identificare ogni struttura somigliante alle
paratiroidi. Queste si presentano in forma di piccoli ammassi di colore ocra o
giallo camoscio, lisci e brillanti, compatti o appiattiti, di consistenza elastica.
La loro conservazione è condizionata da un accesso prudente alla faccia
posteriore della tiroide e, d’altro canto, dal controllo dei peduncoli arteriosi a
contatto della ghiandola. Infatti il rispetto della loro vascolarizzazione
terminale impone: per le paratiroidi in posizione inferiore, la legatura o la
8
coagulazione delle branche terminali dell’arteria tiroidea inferiore a contatto
del parenchima tiroideo; per le paratiroidi in posizione media o alta, il rispetto
dell’arcata anastomotica marginale posteriore. Di conseguenza, la legatura
anche unilaterale del tronco dell’arteria tiroidea inferiore è proscritta in
qualunque tipo di tiroidectomia. Anche la conservazione del drenaggio venoso
è essenziale; all’atto della liberazione del polo inferiore la paratiroide inferiore
si trova praticamente a contatto con le vene tiroidee inferiori. Bisogna dunque
legare a contatto del parenchima tiroideo i vasi che ne fuoriescono e riuscire ad
abbassare la struttura ghiandolare con prudenza, avvalendosi di una garza. La
paratiroide superiore è sempre situata al disotto del punto di penetrazione
laringea del nervo ricorrente e più profondamente di esso. Il rischio di
incidente è più elevato lungo il margine postero-interno e sulla faccia
posteriore del polo inferiore, laddove il lobo aderisce ai primi due anelli
tracheali. La sezione di questa area di aderenza, cioè del legamento di Gruber e
dell’arteriola che vi decorre, scopre la parte terminale del ricorrente e l’arteria
della paratiroide nella sua posizione media. Nei casi difficili e quando il
chirurgo non è sicuro di aver risparmiato almeno due paratiroidi funzionanti,
alcuni autori consigliano il trapianto sistematico ed immediato in una tasca del
muscolo sternocleidomastoideo suturata poi con filo non riassorbibile come
9
repere. In ausilio al chirurgo esistono oggi vari sistemi lenticolari di
ingrandimento che assicurano una magnificazione di immagine all’interno del
campo operatorio per meglio garantire la preservazione di strutture e rapporti
importanti, ed eventualmente permettere una ricostruzione microchirurgica di
eventuali lesioni accidentali. La MIVAT non ha peraltro riportato nessun
vantaggio reale nella riduzione dell’incidenza dell’ipoparatorioidismo essendo
fondamentale piuttosto l’abilità e l’esperienza del chirurgo che garantiscono la
scrupolosa ricerca e preservazione delle paratiroidi.
10
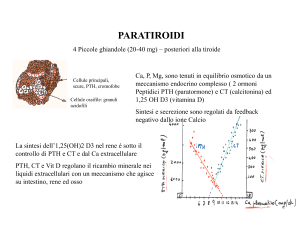
Ruolo del paratormone nell’omeostasi del calcio-fosforo
L’omeostasi minerale è regolata da due ormoni peptidici, il paratormone (PTH)
e la calcitonina (CT), e da un ormone sterolico, l’1,25-diidrossicolecalciferolo,
che rappresenta il metabolita attivo della vitamina D. Questi ormoni sono
integrati in un sistema complesso la cui funzione fisiologica principale è quella
di mantenere costante la concentrazione di calcio, fosforo e magnesio nei
liquidi extracellulari. La biosintesi e la secrezione di PTH e CT sono regolate
dalla concentrazione di ioni calcio nei liquidi extracellulari. La biosintesi della
vitamina D, a partire dai precursori inattivi ha luogo a livello del rene, ed è
regolata dal PTH, dalla CT e dalla concentrazione di calcio e fosforo circolanti.
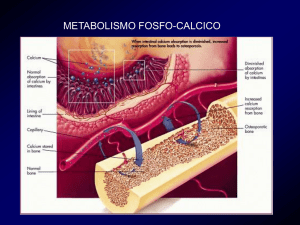
Paratormone, calcitonina e vitamina D regolano l’afflusso e l’efflusso del
calcio e del fosforo nel compartimento extracellulare, agendo a livello di vari
organi: intestino, rene e tessuto osseo. Il PTH è responsabile istante per istante
dei livelli di calcio nei liquidi extracellulari, ed assolve a questo compito
stimolando il riassorbimento di calcio nel rene e nella matrice ossea, attivando
a livello renale l’enzima 1 alfaidrossilasi, che converte la vitamina D nella sua
isoforma metabolicamente attiva. La cellula paratiroidea secerne il
paratormone in risposta ad una riduzione del calcio ionizzato. Una riduzione
della calcemia stimola acutamente la liberazione di PTH preformato; se
11
l’ipocalcemia perdura, aumenta anche la corrispondente biosintesi dell’ormone,
e compare ipertrofia ed iperplasia delle paratiroidi. La relazione tra le
concentrazioni di calcio ionizzato e quelle del PTH è di tipo sigmoidale, dove
la parte ripida della curva corrisponde all’intervallo di normalità del calcio
ionizzato. Non appena la calcemia scende sotto i 9 mg/dL, compare un
incremento netto nella increzione del PTH, che diventa massimale con un
livello di 5 volte il normale tasso di secrezione per livelli di 8 mg/dL di calcio
plasmatico. La vitamina D che non produce un effetto diretto sulla secrezione
del PTH, ne inibisce fortemente la trascrizione genetica ma non
nell’ipocalcemia cronica probabilmente a causa della diminuzione dei recettori
per la vitamina D che rappresenta un importante sistema di difesa, poiché
fornisce un modo per rendere disponibili nello stesso momento elevate quantità
di PTH e di vitamina D. Il fosfato provoca un aumento della secrezione di
PTH. Anche la concentrazione del magnesio può influenzare la secrezione di
PTH, ma mentre l’aumento della magnesiemia inibisce la secrezione di PTH in
modo simile a quanto avviene per l’ipercalcemia, la situazione è del tutto
diversa
in
condizioni
di
ipomagnesiemia
estrema
(sindromi
da
malassorbimento, alcolismo cronico, difetto selettivo dell’assorbimento di
magnesio) nelle quali si assiste ad un’inibizione, sia in condizioni sperimentali
12
che
nell’uomo,
della
secrezione
di
PTH.
L’1,25(OH)2D,
diidrossicolecalciferolo o calcitriolo, rappresenta la forma biologicamente
attiva della vitamina D prodotta a livello del fegato e del rene, mediante
processi successivi di idrossilazione di precursori inattivi: vitamina D2 assunta
con la dieta vitamina D3 prodotta a livello cutaneo. Il principale meccanismo
fisiologico di regolazione della produzione di 1,25(OH)2D è rappresentato dal
paratormone che ne stimola la produzione, inibita invece dal calcio. Anche la
concentrazione di fosforo, a livello dei tubuli renali, influenza la sintesi di
1,25(OH)2D. Come abbiamo visto in rapporto alla funzione omeostatica del
calcio operata dal PTH
la sua carenza comporta una serie di alterazioni
clinico-metaboliche: riduzione dei processi di rimodellamento osseo con
ridotta cessione di calcio al plasma ed aumento della densità ossea; ridotta
eliminazione urinaria dei fosfati con conseguente iperfosforemia e tendenza del
fosforo a depositarsi come fosfato tricalcico a livello di vari tessuti; diminuita
formazione di 1,25(OH)2D3 causata dall’aumento della fosforemia, con
conseguente riduzione dell’assorbimento intestinale di calcio; aumentata
eliminazione urinaria di calcio.
13
Cinica dell’ipoparatiroidismo
L’ipocalcemia determina un abbassamento della soglia di eccitabilità delle
fibre nervose motorie e sensitive. La stimolazione delle terminazioni nervose
provoca una risposta di tipo ripetitivo, fino all’attività continua la cui
manifestazione più grave è rappresentata dalla crisi tetanica. Le manifestazioni
cliniche dell’ipoparatiroidismo sono in gran parte correlate all’entità ed alla
rapidità di insorgenza dell’ipocalcemia. Nelle forme acute predominano la
tetania e gli altri sintomi e segni addebitabili ad una rapida diminuzione dei
livelli di calcio circolante; nelle forme croniche o parziali tali manifestazioni
sono più sfumate e predominano le conseguenze della deposizione di sali di
calcio in vari organi e/o disturbi trofici coinvolgenti molteplici tessuti. Le
manifestazioni motorie della tetania sono in genere precedute da disturbi
sensitivi, consistenti in formicolii e parestesie degli arti, della regione periorale
e della lingua. La contrazione spastica interessa inizialmente i muscoli distali
degli arti spasmo carpo-podale con mani “da ostetrico” e piedi iperestesi, può
progressivamente
coinvolgere
i
muscoli
prossimali
degli
arti,
con
iperestensione dei gomiti e delle ginocchia, i muscoli periorbicolari, con
protrusione delle labbra (muso di carpa) e i muscoli del tronco, con opistotono.
Possono essere interessati anche i muscoli della laringe, con spasmo della
14
glottide e dispnea inspiratoria (tirage). Talvolta la crisi tetanica assume un
carattere tonico-clonico, con convulsioni generalizzate. Negli intervalli tra gli
episodi di acuzie permane uno stato di ipereccitabilità sia periferica sia
centrale, che viene definito come “tetania latente” evidenziabile mediante
manovre semeiologiche: segno di Chvostek e di Trousseau. L’ipereccitabilità
neuromuscolare causata dall’ipocalcemia può manifestarsi anche solo con
parestesie, facile esauribilità, crampi muscolari. Nell’ipoparatiroidismo cronico
prevalgono invece segni e sintomi derivanti dalla deposizione di fosfato
tricalcico. Le sedi colpite in modo preferenziale sono le seguenti: il sistema
nervoso centrale, ed in particolare i nuclei della base, con manifestazioni di
tipo extrapiramidale e nei pazienti più giovani ritardo psichico; il cristallino,
con instaurarsi di cataratta posteriore; il tessuto sottocutaneo e i tendini, o a
livello dell’apparato dentario con alterazioni della dentina e dello smalto e
tendenza alla caduta precoce o ritardo nella dentizione. L’ipocalcemia può
inoltre provocare: edema della papilla; alterazioni elettrocardiografiche
caratterizzate da allungamento dell’intervallo Q-T e più raramente da blocchi
atrio-ventricolari; malassorbimento intestinale e manifestazioni psichiche.
L’ipoparatiroidismo è caratterizzato, dal punto di vista biochimico, da
ipocalcemia ed iperfosforemia.
15
Trattamento dell’ipoparatiroidismo postoperatorio
Se è presente un’ ipocalcemia sintomatica conviene iniziare una terapia
endovenosa con calcio gluconato (2 fiale ev per 2-3 volte al dì), e
contemporaneamente la somministrazione orale di calcio carbonato (2-6 g) in
dosi frazionate, e calcitriolo (0.5-1.5 mcg). Se è presente un’ ipocalcemia
laboratoristica minore di 8 mg/dL, asintomatica, è sufficiente invece
somministrare calcio carbonato per os e calcitriolo alle stesse dosi. Lo
svezzamento si otterrà dimezzando di settimana in settimana le dosi di calcio
carbonato/gluconato e di calcitriolo, fino alla loro sospensione previo controllo
a cadenza settimanale della calcemia. Essendo l’ipocalcemia
il principale
stimolo iperplasiogeno per il tessuto ghiandolare paratiroideo è consigliabile
somministrare la vitamina D e il calcio a dosi tali da non superare la
concentrazione di 8 mg/dL di calcemia sierica.
Nel monitorare la calcemia
occorre ricordare l’interferenza di vari farmaci sui livelli del calcio ematico
dagli anticonvulsivanti agli anticoncezionali ai diuretici.
16
MATERIALI E METODI
I dati del presente studio riguardano la casistica delle tiroidectomie totali
operate nel biennio mag 2009 - mag 2011 presso la UOC di Chirurgia
Generale B, diretta dal prof. Giorgio De Toma, presso il Dipartimento di
Chirurgia “Pietro Valdoni” dell’Università “Sapienza” - Azienda Policlinico
Umberto I di Roma. Essi si basano sul dosaggio dei valori sierici di calcio,
fosforo e del PTH postoperatorio a 18 ore e a 6 mesi dall’intervento di
tiroidectomia. L'importanza dello studio sta nel prevedere quali pazienti
presenteranno ipocalcemia per un loro trattamento precoce e selettivo e per la
prevenzione delle conseguenze dell'ipoparatiroidismo a lungo termine. Nello
studio sono stati arruolati 156 Pazienti, 102 (65.38 %) di sesso femminile e 54
(34.62 %) di sesso maschile, di età compresa tra 19 e 80 anni (età media 56
anni), che presentavano diagnosi di ammissione di iperplasia plurinodulare
della tiroide (107 pz - 68.58%) o di neoformazione tiroidea - adenoma o
carcinoma (49 pz -31.42%). Solo 1 pz (0.64%) aveva già subito una
emitiroidectomia, che è stata quindi totalizzata. La prevalenza di patologia, era
nelle donne della fascia di età compresa tra i 35 e i 55 anni. Tutti i pazienti
erano stati sottoposti precedentemente al ricovero ad eame ecotomografico
17
tiroideo ed esami laboratoristici della funzionalità tiroidea e videat
endocrinologico. Del totale, 10 Pazienti (6.41%), oltre alla tiroidectomia totale,
sono stati sottoposti anche a linfoadenectomia del comparto centrale. I valori
post operatori della calcemia oscillavano tra 6.7 mg/dL e 10.2 mg/dL (valore
medio di 8.57mg/dL) e, della fosforemia tra 2.2 mg/dL e 5.7 mg/dL (valore
medio di 3.47mg/dL), Il valore del PTH a 18 ore dall’intervento chirurgico
oscillava tra 5.4 pg/mL e 52.2 pg/mL (valore medio di 36.71pg/mL). E’ stato,
infine, programmato un follow-up a 6 mesi per tutti i pazienti tiroidectomizzati.
18
RISULTATI E DISCUSSIONE
Dopo tiroidectomia totale, in 35 pazienti (22,4%) è stata osservata una
condizione laboratoristica di ipocalcemia postoperatoria, con un valore sierico
di Calcio totale, compreso tra 6.7 e 8.5 mg/dL (valore medio di 7.8 mg/dL).
Dei pazienti ipocalcemici 27 (17,3 % del totale) sono risultati sintomatici già
entro le prime 48 ore riferendo parestesie peri orali e a livello degli arti con in
7 casi segno di Chwostek e Trusseau debolmente positivi. In 25 pazienti (16%
del totale, 100% degli ipocalcemici) il valore del PTH a 18ore dall’ intervento
chirurgico è risultato inferiore al range di normalità (<15pg/ml) compreso tra
7.3pg/mL e 14,8 pg/mL. Di questi pazienti con PTH inferiore al valore
normale, 23 appartenevano al gruppo dei pazienti sintomatici (85,1% ) 2 invece
al gruppo degli ipocalcemici asintomatici (13,33 %). Tutti i pazienti con ridotto
PTH post operatorio erano pertanto ipocalcemici.
Al follow up a 6 mesi sono pervenuti tutti i 156 pazienti, ed il quadro clinicolaboratoristico riscontrato circa i livelli di calcemia, fosfatemia e PTHemia era
ritornato nei range di riferimento normali in tutta la popolazione campionaria,
ad eccezione di 1 dei 25 pazienti che avevano presentato ipo PTHemia (0.64%
rispetto al totale di 156 pz) (il quale aveva presentato un quadro postoperatorio
a 18 ore di calcemia pari a 6,4mg/dL, e di PTH pari a 5,4 pg/mL). Il paziente
19
presentava una condizione persistente di ipoparatiroidismo cronico (PTH =
10,3 pg/ml) ed era in terapia con calcio carbonato e calcitriolo per os.
L’ipocalcemia transitoria post tiroidectomia è riportata in Letteratura con
un’incidenza che varia dallo 0.5 al 62%, non tenendo conto però dei diversi
criteri adottati per definire lo stato di patologia rilevata nei vari studi; inoltre,
le percentuali più basse sono sovente vantate da chi ha tenuto conto solo delle
manifestazioni ipocalcemiche sintomatiche, nel contesto di interventi sia di
tiroidectomia totale sia parziale. Di converso, le percentuali più alte sono state
ottenute in quegli studi che tengono conto solo delle tiroidectomie totali e di
tutte le forme di ipocalcemia, incluse le subcliniche. Per prevedere l’entità e
l’evoluzione dell’ipocalcemia post operatoria,
come abbiamo visto, il
dosaggio del PTH trova il suo razionale nel riflettere il reale stato di
funzionalità delle paratiroidi vista la sua breve emivita. Tenere in
considerazione tale valore piuttosto che il solo valore di calcemia mette al
riparo dal trattamento di quelle forme di ipocalcemia transitoria non dovute a
ipoparatiroidismo. L’incidenza dell’ipoparatiroidismo definitivo ha dati più
omogenei nelle diverse casistiche
variando da uno 0,07% dopo lobo-
istmectomie, 0,6-1 % dopo resezioni subtotali al 2-4 % dopo tiroidectomia
totale. Nella nostra casistica abbiamo preso in considerazione solo
20
tiroidectomie totali. In caso di carcinoma è però stata associata la
linfoadenectomia del comparto centrale. Analizzando i nostri dati emerge in
conformità con i risultati di altri studi che il rischio di ipoparatiroidismo
dipende dall’estensione della chirurgia tiroidea, e dalla patologia di base. La
maggior frequenza di ipoparatiroidismo è stata riscontrata infatti nei pazienti
con carcinoma tiroideo (11 dei pazienti con ridotto PTH a 18 ore) e nei
pazienti affetti da malattia di Graves, vista la maggior vascolarizzazione del
parenchima rispetto al gozzo e al carcinoma
(4 dei pazienti con
ipoparatorioidismo).
Abbiamo già analizzato nel dettaglio la corretta tecnica operatoria in grado di
preservare l’integrità anatomica e funzionale delle paratiroidi. Peraltro una
paratiroide francamente devascolarizzata, ovviamente, non andrà più lasciata
in sede, nella speranza di una possibile ripresa funzionale e metabolica
successiva, ma si dovrà procede al suo reimpianto in una tasca del muscolo
sternocleidomastoideo. È stato infatti dimostrato che il reimpianto riduce
l’incidenza, in termini assoluti, di ipocalcemia definitiva iatrogena, mentre,
come è ovvio attendersi per la necessità di un dato lasso di tempo affinché
l’innesto attecchisca e sia ben funzionante, non incide sull’ ipocalcemia
temporanea. Non ha alcuna logica, d’altra parte, effettuare in ogni caso
21
l’autotrapianto di almeno una paratiroide in corso di tiroidectomia totale,
nell’ipotesi, non confermata, che la funzione di una ghiandola paratiroide
trapiantata sia maggiormente prevedibile rispetto a quella di una paratiroide
lasciata beante in situ.
In letteratura numerosi studi sono stati svolti con l’intento di prefissare un cutoff di valori predittivi a breve e lungo termine di paratireopatia secondaria
post-chirurgica, ognuno dei quali avvalorato dalle casistiche dei singoli centri
od anche di quelle multicentriche, talvolta stilando delle review sistematiche e
metanalisi sull’argomento, ma in definitiva senza giungere ad un consensus
universalmente accettato. Alcuni autori infatti hanno analizzato il valore di
PTH intra operatorio o precoce post operatorio (entro 1 ora) come precoce
marker di ipocalcemia, risultato poco specifico visto il frequente iniziale
stupor paratiroideo da manipolazione; altri hanno analizzato la percentuale di
riduzione del PTH post operatorio rispetto al pre operatorio ottenendo una
sensibilità pari al 95% per riduzioni percentuali > 80% (del Rio et al), o > del
50% secondo altri autori. Uno studio australiano su 458 pazienti ha invece
evidenziato un’ elevata sensibilità e valore predittivo di normocalcemia (92%)
da parte di un valore di PTH entro il range di normalità. Minore sensibilità
22
(71%) e valore predittivo positivo di ipocalcemia è stato invece mostrato da un
ipo PTHemia.
Youngwirth et al. hanno valutato invece l’impatto dell’uso del dosaggio
precoce di PTH sul numero di ipocalcemie sintomatiche e sul numero di
accessi al Pronto Soccorso per ipocalcemia su 271 pazienti. Hanno trattato il
gruppo 1 con metodo “sperimentale” (dosaggio di PTH a 4 ore e trattamento
con calcitriolo + calcio se PTH < 10 pg/mL) e il gruppo 2 con metodo
tradizionale (senza dosaggio precoce di PTH e trattamento con calcio e/o
vitamina D in base al valore della calcemia). Il numero di ipocalcemie
sintomatiche è risultato del 7% nel gruppo 1 vs. il 17% nel gruppo 2 così come
il numero degli accessi al Pronto Soccorso è sceso dall’8% all’1.8%
utilizzando la strategia predittiva basata sul dosaggio precoce del PTH.
Secondo questi studi il PTH risulta essere un marker valido della funzionalità
paratiroidea post tiroidectomia e più affidabile del solo valore della calcemia
che subisce l’influenza di altri fattori essendo l’omeostasi di questo elettrolita
strettamente regolata anche da altri organi quali osso, rene e intestino e dal
rapporto del valore intra/extracellulare tali da poterlo mantenere in un range di
sicurezza anche in acuzie.
23
Nell’analizzare i nostri dati abbiamo voluto valutare la predittività da parte di
un ridotto PTH di ipocalcemia sintomatica poiché gli 8 pazienti con
ipocalcemia solo laboratoristica avevano solo una lieve riduzione del calcio
rispetto al range di riferimento (Ca >/= 8 mg/dl) che in seconda giornata era
tornato entro i valori normali essendo probabilmente da addebitare alle altre
cause di ipocalcemia transitoria.
Un valore di PTH inferiore al range di normalità è risultato avere una
sensibilità dell’ 85,2% nel riconoscere l’ipocalcemia sintomatica ed una
specificità invece del 98,4%. Il suo valore predittivo positivo (probabilità che
un soggetto positivo sia realmente ipocalcemico) è risultato del 92 % mentre il
valore predittivo negativo (probabilità che un soggetto negativo sia realmente
asintomatico) è risultato del 96,9%.
laboratoristiche permette di individuare
Pertanto combinare le metodiche
i pazienti sia ipocalcemici che
ipoparatiroidei (in particolare per valori medi di calcemia inferiori a 7.8 mg/dL
e di PTH a inferiori a 13.4 pg/mL) come pazienti a rischio di sviluppare
complicanze ormono-metaboliche acute, subacute e croniche post chirurgia
della tiroide, già nell’immediato post operatorio. Questo consente un
trattamento precoce a base di calcio carbonato e calcitriolo selettivo per i
pazienti sintomatici e ipoparatiroidei e consente di abbandonare la strategia
24
preventiva,
troppo
largamente
adottata,
che
portava
a
trattare
indiscriminatamente tutti i pazienti ritardando una spontanea correzione
dell’omeostasi del calcio. Il dosaggio a 18 ore del PTH ha mostrato infatti
un’accuratezza del 96,15% dimostrandosi un valido test in grado di individuare
i pazienti a rischio di ipocalcemia sintomatica. Le dirette conseguenze sono
non solo un risparmio in termini di somministrazione terapica selettiva, ma
anche e soprattutto, in termini di ridotta degenza post operatoria e ridotti costi
di esami di laboratorio. Infatti un solo dosaggio di PTH a 18 ore evita controlli
seriati della calcemia a tutti i pazienti. Ricordando che l’ipocalcemia
rappresenta non solo la complicanza più frequente in caso di tiroidectomia
totale ma anche quella potenzialmente più tardiva, l’individuazione di quei
pazienti che mostrano una normale funzione paratiroidea, e quindi hanno un
bassissimo rischio di sviluppare ipocalcemia precoce né tardiva, permette la
loro dimissione in tutta sicurezza in I–II giornata post operatoria visto l’alto
valore predittivo negativo del dosaggio del PTH a 18 ore dall’intervento.
25
CONCLUSIONI
• L’ipocalcemia rappresenta la complicanza più frequente post tiroidectomia ed
è potenzialmente la più tardiva tanto da condizionare realmente i tempi di
degenza post-operatoria.
• L’ipocalcemia permanente è una complicanza temibile ed è dovuta ad un
ipoparatiroidismo iatrogeno.
• La tecnica operatoria, l’abilità e l’esperienza del chirurgo sono fondamentali
per la sua prevenzione.
• L’identificazione precoce dei pazienti a rischio di ipocalcemia sintomatica
permette un precoce trattamento farmacologico selettivo evitando danni acuti e
permanenti.
• L’identificazione di pazienti che non presentano un reale rischio di
ipocalcemia sintomatica permette di evitare controlli seriati del calcio e
consente una loro dimissione in I-II giornata post-operatoria riducendo
notevolmente i costi.
• Il dosaggio del PTH post operatorio a 18 ore si è dimostrato un valido test in
grado di identificare i pazienti a rischio di ipocalcemia sintomatica con un
valore predittivo positivo del 92% e valore predittivo negativo del 96,9%.
26
GRAFICI
27
140
120
100
Pazienti normocalcemici
80
60
Pazienti ipocalcemici
asintomatici
40
pazienti ipocalcemici
sintomatici
20
0
Totale dei
pazienti (156)
Pazienti con PTH
< 15 (25)
Predittività di ipocalcemia sintomatica del
ipoPTHemia a 18 ore
100,00%
95,00%
90,00%
85,00%
80,00%
75,00%
Sensibilità
Specificità
Valore
predittivo
positivo
28
Valore
predittivo
negativo
Accuratezza
BIBLIOGRAFIA
Bhattacharyya N, Fried MP. Assessment of the morbidity and complications of
total thyroidectomy. Arch Otolaryngol Head Neck Surg. 2002 Apr;128(4):38992.
Bohrer T, Hagemeister M, Elert O. A clinical chameleon: postoperative
hypoparathyroidism. Langenbecks Arch Surg. 2007 Jul;392(4):423-6. Epub
2006 Nov 28.
Bozec A, Guevara N, Bailleux S, Castillo L, Santini J.Early PTH assay after
total thyroidectomy: predictive factor for post operative hypocalcemia. Rev
Laryngol Otol Rhinol (Bord). 2006;127(3):141-4.
Burge MR, Zeise TM, Johnsen MW, Conway MJ, Qualls CR. Risks of
complication following thyroidectomy. J Gen Intern Med. 1998 Jan;13(1):2431.
Capponi MG, Bellotti C, Cancrini G, Mezzetti G, Scicchitano F, Cancrini A.
Intraoperative quick parathyroid hormone assay in thyroid surgery: preliminary
experience on 36 cases. G Chir. 2006 Mar;27(3):85-9.
Chaudhary IA, Afridi ZD, Samiullah, Masood R, Mallhi AA To ligate or not
the inferior thyroid artery to avoid hypocalcaemia after thyroid surgery. J Ayub
Med Coll Abbottabad. 2007 Apr-Jun;19(2):19-22.
Costanzo M, Caruso LA, Messina DC, Palumbo A, Arcerito MC, Cannizzaro
MA. Post-thyroidectomy hypocalcemia. [Article in Italian] Ann Ital Chir. 2004
Nov-Dec;75(6):623-7; discussion 627-8.
Costanzo M, Marziani A, Condorelli F, Migliore M, Cannizzaro MA. Postthyroidectomy hypocalcemic syndrome: predictive value of early PTH.
Preliminary results. Ann Ital Chir. 2010 Jul-Aug;81(4):301-5.
De Andrade Sousa A, Salles JM, Soares JM, de Moraes GM, Carvalho JR,
Rocha PR. Course of ionized calcium after thyroidectomy. World J Surg. 2010
May;34(5):987-92.
29
De Toma G, Campli M, Gabriele R, Sgarzini G, Letizia C. Identification and
preservation of the parathyroid glands in thyroidectomy using methylene
blue.[Article in Italian] Minerva Chir. 1993 Mar 15;48(5):183-7.
Demeester-Mirkine N, Hooghe L, Van Geertruyden J, De Maertelaer V.
Hypocalcemia after thyroidectomy. Arch Surg. 1992 Jul;127(7):854-8.
De Pasquale L, Schubert L, Bastagli A. Post-thyroidectomy hypocalcemia and
feasibility of short-stay thyroid surgery. Chir Ital. 2000 Sep-Oct;52(5):549-54.
Del Rio P, Arcuri MF, Cataldo S, Palladino S, Sianesi M. Can we use ionized
calcium in the evaluation of post-thyroidectomy hypocalcemia? Minerva
Endocrinol. 2009 Dec;34(4):289-93.
Di Fabio F, Casella C, Bugari G, Iacobello C, Salerni B. Identification of
patients at low risk for thyroidectomy-related hypocalcemia by intraoperative
quick PTH. World J Surg. 2006 Aug;30(8):1428-33.
Dionigi G, Bacuzzi A, Bertocchi V, Carrafiello G, Boni L, Rovera F, Dionigi
R. Prospectives and surgical usefulness of perioperative parathyroid hormone
assay in thyroid surgery. Expert Rev Med Devices. 2008 Nov;5(6):699-704.
Erbil Y, Barbaros U, Temel B, Turkoglu U, Işsever H, Bozbora A, Ozarmağan
S, Tezelman S. The impact of age, vitamin D(3) level, and incidental
parathyroidectomy on postoperative hypocalcemia after total or near total
thyroidectomy. Am J Surg. 2009 Apr;197(4):439-46.
Fahad Al-Dhahri S, Al-Ghonaim YA, Sulieman Terkawi A. Accuracy of
postthyroidectomy parathyroid hormone and corrected calcium levels as early
predictors of clinical hypocalcemia. J Otolaryngol Head Neck Surg. 2010
Aug;39(4):342-8.
Fahmy FF, Gillett D, Lolen Y, Shotton JC. Management of serum calcium
levels in post-thyroidectomy patients. Clin Otolaryngol Allied Sci. 2004
Dec;29(6):735-9.
Giovannini C, Cristaldi M, Pirozzi R, Pronio A, Santella S, Montesani C.
[Total thyroidectomy with identification of parathyroid glands. Functional
30
implications]. [Article in Italian] Ann Ital Chir. 1999 May-Jun;70(3):393-6,
commentary 397-8.
Glinoer D, Andry G, Chantrain G, Samil N. Clinical aspects of early and late
hypocalcaemia afterthyroid surgery. Eur J Surg Oncol. 2000 Sep;26(6):571-7.
Graff AT, Miller FR, Roehm CE, Prihoda TJ. Predicting hypocalcemia after
total thyroidectomy: parathyroid hormone level vs. serial calcium levels. Ear
Nose Throat J. 2010 Sep;89(9):462-5.
Grodski S, Serpell J. Evidence for the role of perioperative PTH measurement
after total thyroidectomy as a predictor of hypocalcemia. World J Surg. 2008
Jul;32(7):1367-73.
Husein M, Hier MP, Al-Abdulhadi K, Black M. Predicting calcium status post
thyroidectomy with early calcium levels. Otolaryngol Head Neck Surg. 2002
Oct;127(4):289-93.
Ignjatović M, Cuk V, Ozegović A, Cerović S, Kostić Z, Romić P. [Early
complications in surgical treatment of thyroid diseases: analysis of 2100
patients]. [Article in Serbian] Acta Chir Iugosl. 2003;50(3):155-75.
Khairy GA, Al-Saif A. Incidental parathyroidectomy during thyroid resection:
incidence, risk factors, and outcome. Ann Saudi Med. 2011 MayJun;31(3):274-8.
Khan MI, Waguespack SG, Hu MI. Medical Management of Postsurgical
Hypoparathyroidism. Endocr Pract. 2010 Dec 6:1-19.
Lindblom P, Westerdahl J, Bergenfelz A. Low parathyroid hormone levels
after thyroid surgery: a feasible predictor of hypocalcemia. Surgery. 2002
May;131(5):515-20.
Lo CY, Lam KY. Postoperative hypocalcemia in patients who did or did not
undergo parathyroid autotransplantation during thyroidectomy: a comparative
study. Surgery. 1998 Dec;124(6):1081-6; discussion 1086-7.
Lo CY, Luk JM, Tam SC. Applicability of intraoperative parathyroid hormone
assay during thyroidectomy. Ann Surg. 2002 Nov;236(5):564-9.
31
Lombardi CP, Raffaelli M, De Crea C, Traini E, Oragano L, Sollazzi L,
Bellantone R. Complications in thyroid surgery. [Article in Italian] Minerva
Chir. 2007 Oct;62(5):395-408.
Manouras A, Markogiannakis H, Lagoudianakis E, Antonakis P, Genetzakis
M, Papadima A, Konstantoulaki E, Papanikolaou D, Kekis P. Unintentional
parathyroidectomy during total thyroidectomy. Head Neck. 2008
Apr;30(4):497-502.
Mehanna HM, Jain A, Randeva H, Watkinson J, Shaha A. Postoperative
hypocalcemia--the difference a definition makes.
Head Neck. 2010
Mar;32(3):279-83.
Miccoli P, Minuto MN, Panicucci E, Cetani F, D'Agostino J, Vignali E, Picone
A, Marcocci C, Berti P. The impact of thyroidectomy on parathyroid glands: a
biochemical and clinical profile. J Endocrinol Invest. 2007 Sep;30(8):666-71.
Moulton-Barrett R, Crumley R, Jalilie S, Segina D, Allison G, Marshak D,
Chan E. Complications of thyroid surgery. Int Surg. 1997 Jan-Mar;82(1):63-6.
Napolitano L, Francomano F, Francione T, Costantini R. Clinical study on
transient hypocalcemia subsequent to thyroid excision interventions. [Article in
Italian] G Chir. 2000 Nov-Dec;21(11-12):438-40.
Ondik MP, McGinn J, Ruggiero F, Goldenberg D. Unintentional
parathyroidectomy and hypoparathyroidism in secondary central compartment
surgery for thyroid cancer. Head Neck. 2010 Apr;32(4):462-6.
Pattou F, Combemale F, Fabre S, Carnaille B, Decoulx M, Wemeau JL,
Racadot A, Proye C. Hypocalcemia following thyroid surgery: incidence and
prediction of outcome. World J Surg. 1998 Jul;22(7):718-24.
Pelizzo MR, Toniato A, Grigoletto R, Piotto A, Bernante P. Postthyroidectomy hypocalcemia and ligation of the inferior thyroid artery trunk.
[Article in Italian] Minerva Chir. 1995 Mar;50(3):215-8.
Pfleiderer AG, Ahmad N, Draper MR, Vrotsou K, Smith WK. The timing of
calcium measurements in helping to predict temporary and permanent
32
hypocalcaemia in patients having completion and total thyroidectomies. Ann R
Coll Surg Engl. 2009 Mar;91(2):140-6.
Piazza L, Liardo G, De Maria A, Troiano L, Terminella A, Cannizzaro MA.
Hypocalcemia after total thyroidectomy. Therapeutic considerations. [Article
in Italian] Minerva Chir. 1990 Sep 30;45(18):1161-3.
Promberger R, Ott J, Kober F, Karik M, Freissmuth M, Hermann M. Normal
parathyroid hormone levels do not exclude permanent hypoparathyroidism
after thyroidectomy. Thyroid. 2011 Feb;21(2):145-50. Epub 2010 Dec 29.
Quiros RM, Pesce CE, Wilhelm SM, Djuricin G, Prinz RA. Intraoperative
parathyroid hormone levels in thyroid surgery are predictive of postoperative
hypoparathyroidism and need for vitamin D supplementation. Am J Surg. 2005
Mar;189(3):306-9.
Rix TE, Sinha P. Inadvertent parathyroid excision during thyroid surgery.
Surgeon. 2006 Dec;4(6):339-42.
Rosato L, Avenia N, Bernante P, De Palma M, Gulino G, Nasi PG, Pelizzo
MR, Pezzullo L. Complications of thyroid surgery: analysis of a multicentric
study on 14,934 patients operated on in Italy over 5 years. World J Surg. 2004
Mar;28(3):271-6. Epub 2004 Feb 17.
Rosato L, Avenia N, De Palma M, Gulino G, Nasi PG, Pezzullo L.
Complications of total thyroidectomy: incidence, prevention and
treatment.[Article in Italian] Chir Ital. 2002 Sep-Oct;54(5):635-42.
Rosato L, Mondini G, Ginardi A, Clerico G, Pozzo M, Raviola P. Incidence of
complications of thyroid surgery. [Article in Italian] Minerva Chir. 2000
Oct;55(10):693-702.
Sam AH, Dhillo WS, Donaldson M, Moolla A, Meeran K, Tolley NS, Palazzo
FF. Serum phosphate predicts temporary hypocalcaemia following
thyroidectomy. Clin Endocrinol (Oxf). 2011 Mar;74(3):388-93. doi:
10.1111/j.1365-2265.2010.03949.x.
33
Sakorafas GH, Stafyla V, Bramis C, Kotsifopoulos N, Kolettis T, Kassaras G.
Incidental parathyroidectomy during thyroid surgery: an underappreciated
complication of thyroidectomy. World J Surg. 2005 Dec;29(12):1539-43.
Sanabria A, et al. Routine postoperative administration of vitamin D and
calcium after total thyroidectomy: a meta-analysis. Int J Surg 2011, 9: 46-51.
Sciumè C, Geraci G, Pisello F, Facella T, Li Volsi F, Licata A, Modica G.
Complications
in
thyroid
surgery:
symptomatic
post-operative
hypoparathyroidism incidence, surgical technique, and treatment. [Article in
Italian] Ann Ital Chir. 2006 Mar-Apr;77(2):115-22.
Shaha AR, Jaffe BM. Parathyroid preservation during thyroid surgery. Am J
Otolaryngol. 1998 Mar-Apr;19(2):113-7.
Shemen LJ, Strong EW. Complications after total thyroidectomy. Otolaryngol
Head Neck Surg. 1989 Oct;101(4):472-5.
Sippel RS, Ozgül O, Hartig GK, Mack EA, Chen H. Risks and consequences
of incidental parathyroidectomy during thyroid resection. ANZ J Surg. 2007
Jan-Feb;77(1-2):33-6.
Sortino N, Puccini M, Iacconi P, Pierallini S, Miccoli P. Transient
hypocalcemia after thyroidectomy.[Article in Italian] Minerva Chir. 1994
Apr;49(4):303-7.
Sousa Ade A, Salles JM, Soares JM, Moraes GM, Carvalho JR, Savassi-Rocha
PR. Evolution of blood magnesium and phosphorus ion levels following
thyroidectomy and correlation with total calcium values. Sao Paulo Med J.
2010;128(5):268-71.
Sturniolo G, Lo Schiavo MG, Tonante A, D'Alia C, Bonanno L. Hypocalcemia
and hypoparathyroidism after total thyroidectomy: a clinical biological study
and surgical considerations. Int J Surg Investig. 2000;2(2):99-105.
Sussi PL. Postoperative hypothyroidism. [Article in Italian] Chir Ital. 1987
Apr;39(2):119-39.
34
Szubin L, Kacker A, Kakani R, Komisar A, Blaugrund S. The management of
post-thyroidectomy hypocalcemia. Ear Nose Throat J. 1996 Sep;75(9):612-4,
616.
Tartaglia F, Giuliani A, Sgueglia M, Biancari F, Juvonen T, Campana FP.
Randomized study on oral administration of calcitriol to prevent symptomatic
hypocalcemia after total thyroidectomy. Am J Surg. 2005 Sep;190(3):424-9.
Testini M, Gurrado A, Lissidini G, Nacchiero M. Hypoparathyroidism after
total thyroidectomy. Minerva Chir. 2007 Oct;62(5):409-15.
Toniato A, Boschin IM, Piotto A, Pelizzo M, Sartori P. Thyroidectomy and
parathyroid hormone: tracing hypocalcemia-prone patients. Am J Surg. 2008
Aug;196(2):285-8. Epub 2008 May 7.
Walsh SR, Kumar B, Coveney EC.
Serum calcium slope predicts
hypocalcaemia following thyroid surgery. Int J Surg. 2007 Feb;5(1):41-4. Epub
2006 May 23.
Wingert DJ, Friesen SR, Iliopoulos JI, Pierce GE, Thomas JH, Hermreck AS
Post-thyroidectomy hypocalcemia. Incidence and risk factors. Am J Surg. 1986
Dec;152(6):606-10.
Youngwirth L, Benavidez J, Sippel R, Chen H. Parathyroid hormone
deficiency after total thyroidectomy: incidence and time. J Surg Res. 2010
Sep;163(1):69-71. Epub 2010 Apr 21.
Youngwirth L, et al. Postoperative parathyroid hormone testing decreases
Symptomatic hypocalcemia and associated emergency room visits after total
thyroidectomy. Surgery 2010, 148: 841-4.
35