Maschio di 65 aa.
Soggetto affetto da sindrome di klinefelter.
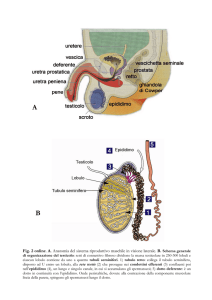
ANATOMIA DEL TESTICOLO: I testicoli, sono di forma ovale, misurano 5 centimetri circa di
lunghezza, 3 centimetri circa di larghezza e 3 centimetri circa trasversalmente. Il peso dei testicoli
di un adulto è di circa 30 grammi l'uno, anche se uno dei testicoli può essere un po' più pesante e
più grande dell'altro, e in genere pende un po' più in basso. La ragione di questo fatto non è certa,
ma potrebbe ragionevolmente essere quella di impedire ai testicoli di urtare l'uno contro l'altro.
Il testicolo è costituito dalla tunica albuginea e dalle sue dipendenze, da un parenchima costituito
dai tubuli seminiferi, e dallo stroma che circonda i tubuli seminiferi e contenente quest'ultimo le
cellule di Leydig a funzione endocrina. La tonaca albuginea è la tonaca più intima del testicolo,
costituita da tessuto connettivo fibroso denso con fasci di fibre di collagene ad andamento parallelo;
è resistente e inestensibile, spessa tra lo 0,5 e 1 mm, e all'esterno continua con l'epiorchio. Negli
strati più superficiali troviamo fibrocellule muscolari lisce mentre negli strati più profondi troviamo
fibre elastiche. Dalla faccia profonda dell'albuginea, detta tonaca vascolosa perché riccamente
vascolarizzata, si dipartono dei setti convergenti verso il mediastino testicolare che si approfondano
all'interno del testicolo delimitando circa 300 logge. Ciascuna loggia ha forma piramidale, con la
base volta verso la superficie del testicolo e l'apice in corrispondenza del mediastino testicolare (dà
passaggio alla rete testis).
Il parenchima, di colorito roseo giallastro, riempe le logge, all'interno delle quali si organizza in
lobuli. Ciascun lobulo contiene tubuli seminiferi contorti, le cui estremità si uniscono a formare i
tubuli retti che sboccano nella rete testis, posta a livello del mediastino testicolare, una serie di
tubuli riccamente anastomizzati. Dalla rete testis si dipartono circa 15-20 condottini efferenti che
confluiscono a formare l'epididimo. I tubuli seminiferi contorti sono lunghi da 30 cm a 70 cm e
occupano il poco spazio a loro disposizione grazie al loro andamento convoluto.
La parete dei tubuli seminiferi è costituita da epitelio pluriseriato detto epitelio germinativo che
poggia su una lamina propria. L'epitelio germinativo comprende accanto alle cellule germinali in
diverso stato differenziativo le cellule del Sertoli, che sono cellule di sostegno Le cellule del Sertoli
sono cellule di derivazione mesodermica non spermatogeniche che oltre a sostenere e a nutrire gli
spermatozoi svolgono importanti funzioni endocrine (producono fattore anti mülleriano che det
regressione dotto di Müller determinando la differenziazione in sesso maschile in età fetale e dopo
la pubertà producono inibina, che inibisce la secrezione di FSH, e attivina). Si estendono per tutto lo
spessore dell'epitelio con la base che poggia sulla membrana basale e l'apice verso il lume; l'apice
presenta delle infossature entro cui sono contenute le teste degli spermatidi in via di sviluppo. Sono
riconoscibili per il nucleo triangolare con nucleolo evidente e cromatina dispersa. Le cellule del
Sertoli sono unite da complessi giunzionali, tight junctions, che suddividono l'epitelio germinativo
in due compartimenti conosciuti come basale e come luminale. Le cellule del Sertoli mediano
quindi gli scambi metabolici tra il compartimento luminale degli spermatidi quello sistemico
costituendo una barriera ematotesticolare che isola gli spermatidi dal resto dell'organismo,
proteggendoli dal sistema immunitario.
Il citoplasma è acidofilo, con gocciole lipidiche, scarso RER e abbondante REL. Sono talora visibili
aggregati proteici noti come corpi di charcot bottcher. Troviamo anche lisosomi primari e
secondari. Le cellule del Sertoli mediano la spermatogenesi e la spermiazione, riassorbono i corpi
residui tramite fagocitosi. Svolgono anche funzione endocrina: producono ABP (Androgen Binding
Protein), sotto lo stimolo dell'FSH ipofisario che trasporta il testosterone favorendo la
spermatogenesi; secernono inibina che agisce con feedback negativo a livello ipotalamo ipofisario
inibendo la secrezione di FSH
Le cellule germinali sono cellule in vario stadio differenziativo. Quelle in stadio precoce di sviluppo
si trovano perifericamente mentre quelle negli stadi tardivi prospettano verso il lume. Il processo
attraverso il quale gli elementi cellulari passano dalla periferia al lume prende il nome di
spermatogenesi. Dura 74 giorni circa e comprende la spermatogoniogenesi (proliferazione per
mitosi delle cellule germinali primitive,da cui originano gli spermatociti primari), la
spermatocitogenesi (divisione meiotica degli spermatociti primari a formare spermatociti secondari
e da questi gli spermatidi) e la spermiogenesi (differenziazione degli spermatidi in spermatozoi
maturi,non si hanno fenomeni moltiplicativi). Nello stroma vi sono le cellule di Leydig che
producono sotto lo stimolo dell'ormone ipofisario LH o ICSH ormoni come testosterone e il
deidroepiandrosterone
SINDROME DI KLINEFELTER: questa sindrome è definita come ipogonadismo maschile
quando ci sono almeno due cromosomi x ed uno o più cromosomi y. È una malattia genetica con
quadro di cariotipo 47 xxy. Questo cariotipo deriva dalla mancata disgiunzione dei cromosomi
sessuali durante la meiosi. Il cromosoma x extra può avere origine paterna o materna. L’età
avanzata della madre e una eventuale irradiazione dei due genitori può portare a questa condizione.
Il 15% dei pazienti presenta quadri di mosaicismo come 46 xy, 47 xxy, 48 xxxy. La presenza nel
mosaico di una linea 46 xy in genere è associata ad una condizione clinica più lieve. Solo in alcuni
casi il difetto cromosomico può essere causato da non disgiunzione mitotica dello zigote, ciò
avviene nei mosaicismi
Clinica: i soggetti con questa sindrome hanno fenotipo maschile ma dopo la pubertà assumono
aspetto eunucoide. La secrezione di gonadotropine ipofisarie è aumentata e ciò attesta la completa
integrità dell’ipofisi anteriore. L’estradiolo circolante è in genere aumentato. In alcuni pazienti c’è
solo ipogonadismo mentre in altri c’è uno specifico habitus corporeo allungato con aumento della
distanza tra la punta dei piedi e l’asse del pube, riduzione della lunghezza del pene, caratteristico
l’habitus eunucoide. Frequente la riduzione dei peli del viso e ascellari, del corpo del pube e la
ginecomastia e vene varicose. La funzione sessuale è normale. I testicoli sono di dimensioni ridotte
a volte di solamente 2 cm di diametro causando livelli di testosterone più bassi del normale.
Principale manifestazione della malattia è la sterilità, quelli fertili sono quelli con alta proporzione
di cellule 46 xy. La sterilità è causata da difetto della spermatogenesi che può portare fino ad
azoospermia completa
La sindrome di klinifelter può essere associata a ritardo intellettuale che a volte e in apparente. La
riduzione dell’intelligenza è lega al numero di cromosomi x soprannumerari
Le alterazione ANATOMOPATOLOGICHE del testicolo sono più o meno gravi a seconda dei casi.
Il volume del testicolo è ridotto e la consistenza è aumentata. Microscopicamente si vede scomparsa
delle cellule dell’epitelio germinativo e poi delle cellule del sertoli accanto a un progressivo
ispessimento della tunica propria tubulare. I tubuli si trasformano in cordoni sclero ialini e nelle
sezioni istologiche appaiono come strutture fantasmi. Le lesioni sono simultanee in tutti i tubuli. Le
cellule di Leydig aumentano di numero, spesso in modo cospicuo formando ammassi
pseudoadenomatosi e creando una perdita dei tubuli. Nonostante ciò queste cellule hanno una
capacità funzionale ridotta, infatti i livelli plasmatici di testosterone sono bassi.
FSH e LH sono aumentati in molti pz con cariotipo 47 XXY e il testosterone plasmatico è ridotto a
dimostrazione di un'insufficienza gonadica primitiva. L'estradiolo è aumentato per la stimolazione
cronica delle cell di Leydig da parte di LH e per l'aromatizzazione dell'androstenedione da parte del
tessuto adiposo. Il rapp estradiolo/testosterone aumenta ed è responsabile della ginecomastia
Da ricordare che il paziente con questa sindrome va incontro con maggior frequenza a malattie
autoimmuni, linfomi e diabete mellito. Aumenta anche la frequenza di tumori germinali non
seminomatosi a localizzazione extragonadica come mediastino.
Tumori testicolo:
germinali
o seminomatosi:
tipico
spermatocitico (sopra i 55 anni)
con sinciziotrofoblasti
anaplastico
o non seminomatosi
k embrionale (tipo adulto)
K embrionale di tipo infantile o del senso endodermico (tum sacco vitellino
producente alfa feto proteina)
teratoma (=commistione di tex atipici ben differenziati o no)
maturo completamente differenziato
maturo con aree di trasf maligna
maturo e immaturo
immaturo
corioncarcinoma che produce HCG
non germinali
o delle cellule interstiziali (Leydig)
o delle cellule del Sertoli
o Stromali
o Linfomi (anziano)
Misti
I tumori germinali che derivano dal testicolo hanno un’alta curabilità (80% - 90%), in quanto le
cellule germinali (gameti) sono normalmente radiosensibili e chemiosensibili. Nel 70% dei casi non
metastatizzano. I tumori non-seminomatosi invece nel 70% hanno già mts alla diagnosi e
presentano markers tumorali elevati.
Il seminoma è il 60% di tutti i tumori del testicolo. I markers tumorali sono negativi tranne un
piccolo aumento sierico della beta-HCG. Il seminoma è positivo alla fosfatasi alcalina placentare
ALP ed al CD117 (c-kit).
Il seminoma spermatocitico è quello meno aggressivo.
Il carcinoma embrionale è il 40% dei tumori non seminomatosi.
Il teratoma è il 5 - 10% ed è classificato in maturo ed immaturo.
Il teratocarcinoma è un tumore misto germinale costituito da teratoma e da carcinoma embrionale.
Diffusione e sedi di mts
Diffusione linfatica -> seminoma, teratoma, carcinoma embrionario.
Diffusione venosa-ematica -> coriocarcinoma
Mts a distanza: polmone, fegato, osso, encefalo.
Testicolo dx -> linfonodi intra-aorto-cavali, paraortici sx, pre-cavali.
Testicolo sx -> linfonodi paraortici sx, pre-aortici.
Segni e sintomi:
Tumefazione scrotale asintomatica (90%) o dolorosa (10%)
Sanguinamento in caso di coriocarcinoma (d.d. con torsione testicolare)
Ginecomastia
Manifestazioni dovute a mts a distanza (dispnea, dolori dorso-lombari (mts retroperitoneali
massive))
Esami diagnostici:
ecografia testicolare
markers sierici: alfa-fetoproteina AFP (prodotta dal sacco vitellino (coriocarcinoma,
teratocarcinoma)) e gonadotropina corionica beta-HCG (prodotta dalle cellule del
sinciziotrofoblasto
(coriocarcinoma,
carcinoma
embrionario))
Rx torace (per escludere mts polmonari)
Intervento chirurgico esplorativo testicolare (al fine di poter eseguire un esame istologico
estemporaneo sul pezzo. operatorio). Mai fare la biopsia!!! I tumori del testicolo non vengono mai
diagnosticati prima dell’intervento, ma durante: il chirurgo può chiedere un esame estemporaneo su
frammento di neoplasia per sapere se un tumore è un seminoma oppure è un tumore non
seminomatoso; nel primo caso si limita ad asportare il testicolo senza effettuare la
linfoadenectomia; nel secondo caso effettua un’orchiectomia e linfoadenectomia.
stadiazione
orchifunicolectomia radicale con impianto di protesi in silicone per scopi estetici.
La stadiazione si esegue mediante l’esame istologico del pezzo operatorio, E.O. dei linfonodi
sovraclaveari, di masse addominali, valutazione dei markers tumorali e del loro tempo di
dimezzamento (AFP 5-HCG 24 -36 h), Rx torace e TC addome superiore ed inferiore
con mdc per valutare la presenza di mts.
Stadio I: confinati al testicolo e nessuna evidenza di mts
A: tumore limitato al testicolo e/o epididimo
B: tumore infiltrante il funicolo
C: tumore infiltrante lo scroto
Stadio II: presenza di mts linfonodali retroperitoneali
A: mts </= 2 cm
B: mts compresa tra 2 e 5 cm
C: mts >/= 5 cm
D: “bulky desease” (massa tumorale rilevante)
Stadio III: mts ai linfonodi sovra diaframmatici e/o ematocele (versamento emorragico nella tonaca
vaginale)
Mts linfonodo mediastinici e/o sovraclaveari
Mts polmonari
Mts ematogene in organi diversi dal polmone
TERAPIA: l’ipogonadismo primitivo va corretto con testosterone per via parenterale im, con
cerotto o per os ( meno efficace per passaggio epatico). Effetto collaterale è la ginacomastia che si
tratta chirurgicamente
Cause di ipogonadismo ipogonadrotopo:
Tumori (adenomi, craniofaringioma) -> iperprolattinemia, eccesso di corticosteroidi, ipotiroidismo.
Ipoplessia
Genetiche (S. di Klinefelter: nella sindrome di Klinefelter si ha una ialinizzazione dei tubuli
seminiferi con iperplasia delle cellule di Leydig) -> S. di Down, ermafroiditismo vero (sono
presenti cellule alcune con genotipo XX e altre con genotipo XY. Questi soggetti hanno un fenotipo
maschile, ma internamente presentano un testicolo ed un epididimo da un lato e dall’altro ovaio,
tuba ed utero).
Irradiazione RT ipofisi.
Malattie sistemiche (parotite virale -> si ha una orchiepididimite virale bilaterale, parotite bilaterale
e pancreatite acuta catarrale)
Condizioni iatrogene (chemioterapia, terapia radiante)
I soggetti con sindrome di Klinefelter possono presentare inoltre anomalie dell’apparato urinario e
della discesa testicolare:
Anomalie del basso apparto urinario
Epispadia: anomalo sbocco dell’uretra sul versante dorsale del pene o del glande.
Ipospadia: sviluppo incompleto dell’uretra, in modo tale che lo sbocco dell’uretra si apra
prossimalmente rispetto all’apice del glande (ipospadia glandolare), nella parte inferiore del pene
(ipospadia peninea) o penoscrotale.
Anomalia della discesa testicolare
È un processo androgeno-dipendente che porta a criptorchidismo.
Normalmente nella 8° settimana degenera la plica peritoneale che lo fissa alla parete posteriore
addominale ed il legamento genitale caudale legato al gubernaculum in sede inguinale lo fa
scendere.
Al 3° mese si ha erniazione della cavità celomatica (tonache vaginali) attraverso il canale inguinale.
È importantissimo sapere se il pz. ha avuto una discesa normale del testicolo in quanto un testicolo
ex-criptorchide è ad alto rischio di tumorale: il rischio è tanto maggiore quanto più era alto e quanto
maggiore è il tempo in cui è stato criptorchide.
Il testicolo ritenuto è palpabile a livello del canale inguinale.
Inoltre possono presentare varicocele:
Il varicocele è una dilatazione delle vene spermatiche interne che si riscontra nel 40% dei soggetti
indagati per infertilità e nel 15% della popolazione generale di sesso maschile. La causa principale
risiede in un difetto delle valvole che normalmente impediscono il retroflusso di sangue venoso
dall’addome al testicolo; ciò causa un ristagno di sangue a livello del testicolo che determina un
ambiente non favorevole alla spermatogenesi per aumento della temperatura del testicolo per un
tempo prolungato, aumento e ristagno di prodotti di scarto testicolari ma anche renali e surrenali,
riduzione di O2 e nutrienti ed alterazione della concentrazione di testosterone.
Nell’85% dei casi avviene a sx perché la vena testicolare sx sbocca nella vena renale sx ed è quindi
più lunga di quella dx che sbocca nella vena cava inferiore in un imbocco al di sotto della vena
renale dx. inoltre la vena renale sx passa sotto la “pinza aorto-mesenterica, punto in cui ci può
essere una compressione estrinseca con ostacolo al deflusso venoso.
Il varicocele può non essere primitivo e quindi devono essere escluse tutte le altre cause di
varicocele 2°, quali ostacoli del deflusso a monte (presenza di un trombo nella vena cava inferiore).
Non vi è una vera e propria associazione tra entità del danno alla spermatogenesi ed entità del
varicocele: infatti il varicocele può non essere sintomatico, ma subclinico, e anche se di grande
entità non causare danni alla fertilità; così come non essere visibile se non radiologicamente ed aver
apportato danno alla spermatogenesi.
Manifestazioni di varicocele:
infertilità documentata con patter seminali alterati.
Dolore o fastidio scrotale
Ipotrofia testicolare significativa
La diagnosi di varicocele prevede un’ispezione in orto e clinostatismo per valutare il volume
testicolare prima e dopo la manovra di Valsalva che determina un inturgidimento delle vene e del
plesso pampiniforme.
Tipi di varicocele:
subclinico: evidenziabile solo all’ecocolordoppler
I° grado: evocabile e palpabile solo dopo aver fatto manovra di Valsalva
II° grado: palpabile anche senza manovra di Valsalva
III° grado: varicocele evidenziabile già all’ispezione
Esami da effettuare:
esami del liquido seminali
ecografia scrotale per vedere il volume testicolare
flussimetria ecocolordoppler
Biopsia testicolare: frammento di tessuto testicolare con sclerosi interstiziale, atrofia tubulare, (con
mancanza di fibre elastiche) e iperplasia di cellule di Leydig.
Punti da approfondire:
La biopsia testicolare viene eseguita soprattutto in presenza di infertilità.
indicare le modalità di esecuzione e di trattamento del materiale
BIOPSIA TESTICOLARE: è un trattamento poco utilizzato nella diagnosi di sindrome di
klinefelter dopo l’introduzione dell’analisi del cariotipo.
Le indicazioni sono lievemente cambiate negli ultimi anni per l'avvento della MESA (Microsurgical
Epididymal Sperm Aspiration) e della TESE (Testicular Sperm Extraction) + ICSI. Da ricordare
che ancora oggi in buona parte dei casi di azoospermia la diagnosi differenziale definitiva tra
azoospemia ostruttiva e secretoria è possibile solo con la biopsia testicolare. Da ricordare anche che
la ICSI non rappresenta l'unica terapia per l'azoospermia (vi sono anche le ricanalizzazioni
microchirurgiche, le disostruzioni dei dotti eiaculatori, l’ipogonadismo ipogonadotropo trattabile,
etc.). Da qui l'importanza di una precisa diagnosi eziologica, sia ai fini della scelta della terapia
appropriata, sia, nel caso della ICSI, della scelta della migliore tecnica di recupero di spermatozoi,
sia, infine, per poter formulare una predizione delle possibilità di successo dell'ICSI.
L'ipoplasia testicolare bilaterale associata a notevole elevazione dei valori dell'FSH non rappresenta
più una controindicazione alla biopsia testicolare (spermatozoi presenti nel parenchima testicolare
nel 45% di questi casi)(Tournaye et al., 1996). Sulla base del dato clinico che oltre il 95% dei
pazienti con agenesia dei deferenti ha una normale spermatogenesi, e che l'unica terapia efficace
dell'affezione è rappresentata dalla ICSI, è giustificato, in caso di deferenti non palpabili, omettere
la biopsia ed effettuare direttamente il recupero di spermatozoi per ICSI. La biopsia può altresì
essere omessa sia nelle azoospermie da ostruzione distale nelle quali un recupero transcutaneo od
un wash-out di spermatozoi del tratto deferento-ampullo-vescicolare chiariscano la causa
dell'azoospermia e rendono immediatamente possibile la terapia, sia in altre azoospermie ostruttive
da causa certa (vasectomizzati). Da una revisione della letteratura è possibile individuare tre
principali posizioni nei confronti della biopsia testicolare diagnostica.
a) Autori che non ritengono opportuno praticare di routine uno studio diagnostico istologico o
citologico testicolare e che eseguono direttamente una TESE o PESA o TESA + ICSI (Tournaye,
1996)
b) Autori che eseguono sempre (tranne nei casi sopra citati) una biopsia testicolare chirurgica
diagnostica prima di intraprendere il trattamento (Silber, 1996).
c) Autori che eseguono sempre un agoaspirato per esame citologico diagnostico (Foresta, 1992).
Per quanto riguarda questo ultimo punto, esistono solo pochi lavori in letteratura che hanno
comparato i risultati dell'agoaspirato testicolare con un esame istologico tradizionale (Foresta,
1992). In linea di massima riteniamo che l'agoaspirato sia sufficientemente attendibile in caso di
ritrovamento di spermatozoi o elementi maturi (spermatogenesi normale) ma non lo sia in caso di
assenza di elementi maturi (arresto maturativo, Sindrome a sole cellule del Sertoli,
ipospermatogenesi?).
Per quanto riguarda la biopsia chirurgica riteniamo che, al momento attuale, essa vada ancora
eseguita nello studio diagnostico (tranne che nei casi sopra menzionati) non essendo sempre
giustificato un impiego "a tappeto" della ICSI nelle azoospermie, per poter dare ai pazienti
un'indicazione sulla prognosi della loro infertiliti e per stabilire eventualmente l'indicazione ad
effettuare altri esami diagnostici (microdelezioni cromosomiche, FISH etc). In dipendenza dalle
motivazioni del paziente, dalla spesa economica, dalla possibilità di back-up con seme di donatore,
riteniamo che solo in alcuni casi di azoospermia di certa natura secretoria (marcata ipoplasia
testicolare, FSH notevolmente elevato) sia giustificabile effettuare direttamente un tentative di
TESE + ICSI senza avere una precedente istologia testicolare diagnostica.
Note di tecnica
Ai fini diagnostici è consigliabile una biopsia singola su ciascun testicolo. La biopsia multipla,
anche se (forse) più accurata, è sicuramente troppo invasiva al solo scopo diagnostico. Riteniamo
più adeguata la biopsia chirurgica tradizionale, possibilmente con tecnica a "finestra", senza
esteriorizzazione del testicolo, rispetto alle tecniche percutanee con ago tru-cut o di altro tipo.
Queste ultime, infatti, spesso non permettono di ottenere un adeguato frammento per l'istologia
(tessuto testicolare scarsamente compatto) ed in definitiva non sono meno invasive (puntura alla
cieca, rischio di ematocele, di ematomi intratesticolari, di danno epididimario, necessità comunque
di anestesia locale). Inoltre è consigliabile:
Manipolare il meno possibile il pezzo da asportare e da analizzare.
Utilizzare fissativo adeguato (Bouin, Zenker).
Esaminare almeno 20 tubuli.
Associare quando possibile una preparazione a fresco (wet prep) o, meglio ancora, un
frammento per TESE diagnostica e/o eventualmente terapeutica tramite congelamento del
pezzo o degli spermatozoi.
Controllare la presenza di altri elementi maturi (spermatidi rotondi e allungati) per eventuale
successive ROSI, ROSNI ed ELSI.
Tecniche di recupero degli spermatozoi
In questi anni, l’attenzione si è spostata in modo imponente sulla possibilità di risolvere le gravi
forme di infertilità maschile. L’azoospermia, patologia caratterizzata dalla completa assenza di
spermatozoi nell’eiaculato, è presente nel 5% delle coppie desiderose di gravidanza e nel 10-20%
nei soggetti infertili che effettuano un’analisi del liquido seminale. Viene solitamente suddivisa, in
base alla natura dell’alterazione, in:
1. azoospermia secretiva o non-ostruttiva, caratterizzata dalla completa assenza di spermatozoi;
solitamente causata da insufficienza ipofisaria o testicolare primitiva
2. azoospermia ostruttiva da ostruzione del sistema di escrezione Si parla di azoospermia nonostruttiva o di insufficienza testicolare primitiva, quando si realizzano tre criteri diagnostici
fondamentali: azoospermia, atrofia testicolare ed elevati livelli di FSH. In queste forme gli
spermatozoi sono assenti anche a livello dell’epididimo e sono rinvenibili sono sparsi focolai di
spermatogenesi a livello testicolare. Un fallimento nel recupero degli spermatozoi è un’evenienza
possibile in pazienti con tale patologia.
Un’azoospermia ostruttiva si evidenzia per l’assenza di cellule seminali nell’eiaculato, normale
trofismo testicolare ed FSH nei limiti della norma. La spermatogenesi è regolare ed i pazienti
presentano una normale virilizzazione con fisiologici livelli di testosterone.
La forma congenita principale di azoospermia ostruttiva è l’assenza bilaterale dei dotti deferenti
(CBAVD: Congenital Bilateral Absence Vas Deferens), che ha un’incidenza del 1.4% fra gli
azoospermici.
Tecniche più comuni di recupero degli spermatozoi dall'epididimo e dal testicolo
1. MESA, Microsurgical epididymal sperm aspiration
2. PESA, Percutaneous epididymal sperm aspiration
3. TESE, Testicular sperm extraction
4. TESA, Percutaneous testicular sperm aspiration
In seguito a prelievo degli spermatozoi, dall’epididimo o dal testicolo, la successiva fecondazione
viene effettuata mediante ICSI.
Indicazioni e controindicazioni di una ICSI
INDICAZIONI
1. Azoospermia ostruttiva
2. Ostruzione del sistema di riproduzione non curabile
3. Ostruzione del sistema di riproduzione ricostruibile
con recupero degli spermatozoi rispetto alla chirurgia
CONTROINDICAZIONI
1. Mutazioni genetiche
2. HIV
3. Epatite
4. Età materna maggiore di 42 anni
Il recupero degli spermatozoi, in pazienti con azoospermia di tipo ostruttivo, può essere effettuato a
livello dell’epididimo, mediante una via microchirurgica (MESA) o transcutanea (PESA)
Tecniche di recupero degli spermatozoi dall’epididimo
Le possibili metodiche di recupero degli spermatozoi dall’epididimo sono due:
1. con metodica microchirugica (MESA)
2. transcutanea, in caso di assenza congenita dei deferenti o di un’ostruzione non risolvibile
(PESA).
MESA
Microsurgical Epididymal Sperm Aspiration
La MESA può essere effettuata sotto anestesia generale o locale. Dopo avere individuato e
sezionato la tunica vaginalis, con il microscopio, mediante un ingrandimento 10x-40x, si seleziona
l’epididimo più dilatato, si esegue una microincisione a livello della sierosa epididimale,
evidenziando inizialmente i tubuli a livello del corpo e poi, via via, più prossimamente, sino alla
testa. Si seleziona un tubulo sufficientemente dilatato, e si procede alla sua apertura. Gli
spermatozoi presenti all’interno vengono così aspirati da un apposito capillare di vetro a punta
smussa. Il materiale prelevato viene immediatamente esaminato per valutare la presenza degli
spermatozoi, e la loro motilità e qualità di progressione. Solitamente è necessario prelevare solo
pochi ml, in quanto gli spermatozoi sono altamente concentrati a livello dell’epididimo.
Se la motilità spermatica non è eccellente si procede ad una nuova aspirazione modificando la
propria posizione in senso caudo-craniale. Infatti, a livello della testa dell’epididimo, solitamente, si
ritrovano gli spermatozoi dotati di maggiore motilità. I gameti prelevati chirurgicamente vengono
trattati in maniera analoga al materiale ottenuto dall’eiaculato. La completa assenza di spermatozoi,
dopo ripetuti tentativi, è un’indicazione all’esecuzione del prelievo dal testicolo. Il tubulo viene poi
suturato. La tecnica offre il vantaggio di poter eseguire il prelievo intratubulare sotto diretto
controllo visivo, di attuare una corretta emostasi e prelevare gli spermatozoi da più siti. Principale
effetto collaterale legato alle caratteristiche strutturali dell’epididimo, regione altamente
vascolarizzata, è una possibile contaminazione del prelievo con cellule ematiche.
PESA
Percutaneous Epididymal Sperm Aspiration
La PESA presenta il vantaggio di riuscire ad effettuare il prelievo dall’epididimo evitando
l’esplorazione chirurgica. Eseguita una semplice anestesia locale, ed immobilizzato il testicolo,
mantenendo l’epididimo fra pollice ed indice, l’operatore procede al prelievo, mediante
l’inserimento di un ago. Si esegue una delicata aspirazione fino alla comparsa del contenuto
epididimale. Il prelievo viene ripetuto fino alla comparsa di spermatozoi. Il prelievo di spermatozoi
dall’epididimo, con metodica MESA o PESA, permette in entrambi i casi la possibilità, quando
sono presenti, di ottenere un ampio numero di spermatozoi, che possono essere sia utilizzati al
momento che congelati per tentativi successivi di fecondazione assistita.
Tecniche di recupero degli spermatozoi dal testicolo
Nei pazienti con azoospermia ostruttiva in cui il prelievo epididimale ha dato esito negative, o in
quelli con azoospermia non ostruttiva, in cui a livello dell’epididimo è pressocchè impossibile
ritrovare spermatozoi, il recupero dei gameti può essere effettuato direttamente dal testicolo. Anche
in questo caso, le metodiche di prelievo possibili sono due:
1. Una via transcutanea o FNA (Fine Needle Aspiration)
2. Una via chirurgica o micro-chirurgica o TESE (Testicular Sperm Extraction)
TESA/FNA
Testicular Percutaneous Sperm Aspiration/Fine Neddle Aspiration
La tecnica è molto simile alla PESA. Viene eseguita sotto anestesia generale o locale. Il chirurgo
mantiene fermo il testicolo fra pollice e indice, ponendo l’epididimo posteriormente. Si inserisce un
ago da 22 o 23 G, collegato ad una siringa di 20 ml contenente 0.1 ml di terreno di coltura, lungo
l’asse maggiore del testicolo. L’ago viene poi orientato in diverse direzioni in modo da prelevare
spermatozoi da differenti tubuli seminiferi. Il materiale aspirato è osservato al microscopio per
verificare la presenza degli spermatozoi. Il prelievo viene ripetuto fino ad avere un adeguato
numero di spermatozoi. La tecnica consente nel 95% dei casi di azoospermia ostruttiva un recupero
dei gameti. Nel caso in cui non si dovessero recuperare spermatozoi, è indicato un tentativo
mediante TESE.
TESE
Testicular Sperm Extraction
I pazienti per cui è indicato un prelievo di spermatozoi mediante TESE possono dividersi in due
categorie:
1. soggetti in cui non è possibile effettuare il recupero dall’epididimo per pregressi trattamenti
epididimali o ostruzione congenita dei dotti efferenti;
2. soggetti con diagnosi istologica di sindrome da sole cellule Sertoli, con arresto della maturazione
o ipospermatogenesi severa;
Un pazienti con azoospermia non-ostruttiva il recupero degli spermatozoi dal testicolo è attuabile
secondo due possibili metodiche:
1. mediante una serie di piccole biopsie testicolari multiple eseguite in maniera random (TESE)
2. mediante un recupero microchirurgico degli spermatozoi.
In entrambi i casi si ricorre ad una semplice anestesia locale eseguita a livello del funicolo
spermatico.
Un pazienti con azoospermia non-ostruttiva il recupero degli spermatozoi dal testicolo è attuabile
secondo due possibili metodiche:
Nella TESE, il testicolo è ruotato in modo da posizionare l’epididimo ed il vaso deferente
posteriormente. La biopsia testicolare viene effettuata a carico della porzione mediale o laterale del
polo superiore del testicolo.
Si procede ad incidere il parenchima testicolare visualizzato. Il materiale prelevato viene posto su
terreno di coltura, e valutato al microscopio. La presenza di spermatozoi in numero sufficiente è
indice di intervento riuscito e da non ripetere. In caso contrario, è necessario ripetere il prelievo in
un punto differente del testicolo.
Solitamente, un prelievo testicolare viene anche valutato da un punto di vista istologico, come
screening per le neoplasie del testicolo. La TESE eseguita in microchirurgia si basa anch’essa su
l’esecuzione di un’anestesia locale come indicato in precedenza.
Si esteriorizza il testicolo e si visualizza al microscopio i tubuli seminiferi. Individuati i tubuli ben
dilatati si procede ad un piccolo prelievo, senza oltre modo danneggiare il restante tessuto,
riducendo così i possibili effetti collaterali menzionati prima.
Biopsia:
Il testicolo viene posizionato con l’epididimo posteriormente rispetto alla superficie di incisione. La
cute dello scroto ed il Dartos (=La fascia di Dartos è uno strato di fibra muscolare liscia libero
da grasso, situato esteriormente alla fascia spermatica esterna ma sotto la pelle. È una prosecuzione
della fascia di Scarpa, che è uno strato membranoso del tessuto sottocutaneo nella parete
addominale. L'apparenza rugosa dello scrotoè dovuta a questo strato.
La fascia di Dartos agisce nel regolare la temperatura dei testicoli, fattore che promuove/inibisce
la spermatogenesi. Questo è reso possibile dalla sua contrazione o estensione, che causa il maggiore
o minore raggrinzimento dello scroto. La contrazione riduce l'area di superficie disponibile
perdissipare il calore, riscaldando i testicoli. L'estensione, al contrario, aumenta l'area superficiale,
promuovendo il rilascio di calore e raffreddando di conseguenza i testicoli.)
vanno incisi trasversalmente in posizione tale da permettere, una volta evidenziata la tunica
albuginea (dopo l’apertura della vaginale), l’incisione della stessa sulla sua faccia mediale o
laterale, che sarebbe la più “avascolare”. Anche grazie ad una leggera pressione effettuata dall’aiuto
sul testicolo (il prof diceva che il testicolo è sottopressione e che dal taglio fuoriesce
spontaneamente del materiale), dall’incisione fuoriesce una pezzetto di tessuto testicolare, che va
escisso con un bisturi di piccole dimensioni. Il frammento va direttamente poste in un’apposita
soluzione fissativa (fissativo complesso [ formalina + alcool + acido]: viene generalmente
preferito il liquido di Bouin, che non dà distorsione o raggrinzimento dei tubuli). Per facilitare il
prelievo e lo scivolamento del pezzo prelevato, il bisturi va precedentemente immerse in soluzione
salina : questi accorgimenti permettono di escindere e trasferire il tessuto senza manipolarlo troppo
con i ferri chirurgici, riducendone le alterazioni. Si esegue quindi un’accurata emostasi con
albugineorrafia , chiusura della vaginale e degli strati della parete scrotale.
indicare i principali quadri morfologici che si osservano in caso di infertilità
INFERTILITA’
Perché un uomo sia considerato fertile, è indispensabile che abbia una normale vita sessuale (circa
due rapporti la settimana nel periodo fertile della partner) che non abbia malformazioni del pene
(ipospadia, e/o incurvamenti gravi), che nel suo seme gli spermatozoi siano in numero sufficiente e
abbiano sia una vita media sufficiente sia una forma ben strutturata per poter arrivare in tempo a
fecondare l’uovo. In un millilitro di sperma, abitualmente ci sono dai venti ai centocinquanta
milioni di spermatozoi, normali come forma e motilità. Se però sono in quantità molto basse (sotto i
5 milioni per millilitro) non riescono a fecondare la cellula uovo. Può anche darsi il caso che gli
spermatozoi siano molti ma immaturi, o di forma anomala e quindi incapaci di muoversi bene.
I fattori maschili sono causa di sicura infertilità in almeno 30 coppie su cento, sono invece una
concausa in 20 coppie su cento.
Gli esami:
1.
2.
3.
4.
Anamnesi accurata con valutazione anche del fattore femminile
Esame obiettivo
Spermiogramma
Ecocolordoppler scrotale
5. Ecografia transrettale di prostata, vescicole seminali e dotti eiaculatori.
In relazione ai risultati di queste indagini, proporzionatamente alla gravità ed al tipo di infertilità, si
passerà eventualmente ad una diagnostica di 2° livello rappresentata da :
1.
2.
3.
4.
5.
Diagnostica ormonale
Diagnostica genetica (Cariotipo, studio delle microdelezioni dell’Y – DAZ)
Test seminali di 2°-3° livello
Esami citologici / colturali su secreto prostatico (EPS)
Diagnostica invasiva
•
Spermiogramma: per valutare numero, qualità e motilità degli spermatozoi, e per accertare,
tra gli altri dati, un’eventuale infezione seminale (spermiocoltura).
Esame liquido seminale: VALORI NORMALI (WHO):
Volume: > 2 ml
Concentrazione spermatica: > 20 milioni spermatozoi/ml Conta spermatica totale: >40
milioni per eiaculato
Motilità: >50% in progressione rettilinea o >25% con rapida progressione entro 60 min dalla
raccolta
Morfologia: >30% di forme normali
Vitalità: >75% vivi
Aspermia: assenza eiaculato
Azoospermia: assenza di spermatozoi nell’eiaculato
Oligospermia: concentrazione spermatica <20 milioni
Astenospermia: <50% di spermatozoi con progressione rettiilinea o < 25% con rapida
progressione
Teratospermia: <30% di spermatozoi con morfologia normale
Ecografia scrotale (testicolare) con valutazione volumetrica e morfologica della sede dei testicoli,
epididimi e dotti deferenti: fornisce informazioni sulla struttura dei testicoli e su eventuali patologie
non rilevabili con la visita specialistica agli annessi testicolari, Nella diagnostica dell’infertilità
maschile, l’ES ha lo scopo di:
confermare o documentare patologie il cui trattamento medico o chirurgico può migliorare
la qualità del seme (Varicocele, Anomalie epididimarie compatibili con ostruzione parziale
o completa dell’organo, Idrocele, Malposizionamenti delle gonadi);
riconoscere patologie responsabili di dispermia, non correggibili e nelle quali l'unica
soluzione può rimanere la
fecondazione medicalmente assistita: Orchiopatia secretoria,
Microlitiasi testicolare, Ectasia della rete testis;
riconoscere patologie interferenti con la salute generale del paziente come il Carcinoma in
situ del testicolo o una neoplasia comunque non palpabile (reperti ecografici occasionali) .
Eco-color-doppler scrotale: mostra i vasi sanguigni dei testicoli ed è indispensabile per
rilevare problemi venosi o un varicocele allo stadio iniziale, va fatto da coricati e soprattutto
in piedi dopo opportuna manovra da sforzo (manovra di Valsalva).
Ecografia prostatico-vescicolare transrettale: permette di svelare formazioni patologiche
(tumori, cisti, calcoli), o segnale di infiammazioni croniche della prostata e/o delle vescicole
seminali. L’esame è indicato quando all’anamnesi patologica prossima o remota il paziente
infertile riferisce emospermia, ejaculazione dolorosa, uretriti/prostatiti, sintomi ostruttivi o
irritativi delle vie urinarie, promiscuità sessuale, pregressi interventi sull’apparato
urogenitale, o modificazioni quali-quantitative dell’ejaculato
Quadri di infertilità
A. Sertoli cell only syndrome Si distinguono 5 varianti della Sertoli cell only syndrome:
a) Sertoli cell only syndrome con cellule di Sertoli immature caratterizzata da tubuli piccoli
senza lume, assenza di fibre elastiche e assenza di cellule di Leydig.
E’ dovuta a
deficit di FSH e LH
b) Sertoli cell only syndrome con cellule di Sertoli disgenetiche caratterizzata da deviazioni
della normale maturazione e associazione di aspetti maturi e immaturi. Le cellule sono
positive oltre che alla vimentina anche all’ormone anti-mulleriano e a CK 18 (segno di
immaturità). I tubuli hanno scarso lume per poca secrezione fluida delle cellule. Sono
presenti cellule di Leydig anche se con aspetti di polimorfismo. Presenza di elevati livelli di
FSH e LH.
c) Sertoli cell only syndrome con cellule di Sertoli mature . La sindrome è legata a mancata
migrazione delle cellule germinali primordiali dal sacco vitellino alla cresta gonadica e si
associa ad elevati livelli di FSH e LH.
d) Sertoli cell only syndrome con cellule di Sertoli in involuzione L’involuzione comprende
anche le cellule di Leydig. Il quadro è secondario (ad es.: dopo chemioterapia)
e) Sertoli cell only syndrome con cellule di Sertoli dedifferenziate spesso di aspetto immaturo
e con dedifferenziazione anche delle cellule di Leydig. Anche questo quadro è secondario a
somministrazioni ormonali.
B. Ialinizzazione tubulare
a) Ialinizzazione disgenetica Un tipo corrisponde al testicolo Klinefelteriano già descritto e
prevede la coesistenza di qualche tubulo ancora cellulato (cellule di Sertoli e cellule
germinali) e tubuli ialinizzati senza fibre elastiche. Le cellule di Leydig possono assumere
aspetto adenomatoso ma sono in preda a regressione con ipertestosteronismo. Un secondo
tipo è presente nel testicolo criptorchide.
b) Ialinizzazione da deficit ormonale (testicolo ipogonadotropinico) con ialinosi come evento
finale del quadro.
c) Ialinizzazione ischemica (da torsione)
d) Ialinizzazione post-ostruttiva
e) Ialinizzazione post-infiammatoria
f) Ialinizzazione da agenti fisici e chimici
C. Alterazioni diffuse della spermatogenesi
a) Lesioni del comparto paraluminale dei tubuli corrisponde a:
a. Blocco della spematogenesi a livello di spermatidi rotondi Sa e Sb
b. Blocco della spermatogenesi a livello degli spermatociti primari pre-meiotici o a
livello meiotico (pachitene o diplotene)
c. Blocco della spermatogenesi a livello dei primissimi spermatidi formatisi
In tutti questi casi il blocco è parziale. Generalmente i quadri sono conseguenza di
ostruzione intra- o extra-testicolare primitiva o secondaria, compreso il varicocele e le forme
post-orchitiche
b) Lesioni del comparto basale dei tubuli
Ipospematogenesi pura con riduzione quantitativa di spermatogoni e spermatociti e
delle altre cellule germinali generalmente bloccate agli spermatidi allungati (Sc e Sd)
Ipospermatogenesi con alterazioni regressive degli spermatociti
Si tratta di forme disendocrine da deficit congenito funzionale delle cellule germinali o da
disfunzione delle cellule di Sertoli o di Leydig, oppure da insensibilità agli androgeni. Anche in
questo caso sono comprese forme primitive e secondarie
D. Lesioni focali della spermatogenesi (Atrofia tubulare mista)
Associazione di tubuli contenenti solo cellule di Sertoli e tubuli con spermatogenesi
generalmente incompleta o raramente completa. E’ una forma primitiva con
distribuzione lobulare delle lesioni.
GAMETOGENESI MASCHILE: La spermatogenesi è il processo di creazione degli spermatozoi
ed avviene nelle gonadi maschili. E' un processo complesso nel quale avvengono differenziazioni e
mitosi di un gruppo di cellule staminali di partenza. La cellula staminale ha il nome di
spermatogonio e per mitosi si divide in due cellule. La prima è uno spermatocita differenziato
mentre la seconda, per garantire il ricambio della base cellulare staminale, mantiene i caratteri di
spermatogonio. Si sono avanzate altre ipotesi sulla differenziazione cellulare alcune delle quali
propongono che la cellula staminale si divide, con dei meccanismi ancora da spiegare, o in due
spermatogoni o in due cellule staminali. La sinergia tra un tipo ed un altro di divisioni dovrebbe
mantenere più o meno costante il quantitativo di cellule staminali. Questa teoria, che vale anche per
altri sistemi dove c'è la divisione cellulare di cellule staminali, non è molto accreditata e necessita di
ulteriori riscontri scientifici.
Lo spermatocita primario è differente dallo spermatogonio ed entra nel processo di meiosi. La
prima fase è di tipo riduzionale e pertanto lo sparmatocita primario, che è diploide, si divide in due
spermatociti secondari aploidi che, in altre parole, contengono metà del patrimonio genetico dello
spermatocita primario. Lo spermatocita secondario appena formato è ancora in fase di meiosi e con
la seconda riduzione, che non è riduzionale dal punto di vista del patrimonio genetico, si divide in
due spermatidi. Riassumento quanto appena detto: la meiosi dello spermatocita primario genera
due spermatociti secondari aploidi i quali, a loro volta, si dividono per formare due spermatidi
secondari ed in tutto alla fine della meiosi si contano quattro spermatidi.
Ogni spermatidio viene poi "raffinato" all'interno della gonade poiché non è ancora capace di
sostenere gli eventi della fecondazione. La raffinazione è da intendersi come un processo più o
meno lungo, a seconda della specie, volto a costruire e consolidare la struttura del futuro
spermatozoo che, per poter compiere il proprio lavoro, necessita di particolari elementi non presenti
negli spermatidi.
Allo stadio finale lo spermatozoo presenta una struttura particolare. Dal punto di vista morfologico
lo spermatozoo dei vertebrati e' formato da una testa, da un corpo e da una coda flagellare. La testa
possiede una vescicola ricca di sostanze utili a digerire il breve tratto della parete dell'ovulo e
prende il nome di acrosoma. Il corpo appare privo di citoplasma e presenta un nucleo molto
evidente con dei filamenti di RNA che hanno il compito di operare la sintesi delle proteine una
volta formato lo zigote. La coda è attaccata al corpo ed ha il compito di flettersi per generare il
movimento che serve allo spermatozoo a compiere piccoli cammini all'interno delle vie genitali
femminili o, in altri casi, nel microambiente dove viene espulso. Per potersi muovere lo
spermatozoo ha bisogno di energia che ricava dai mitocondri sparsi nel corpo e nella coda.
Gli spermatozoi degli invertebrati possono assumere forme molto diverse e, in alcuni casi, si
discostano visibilmente rispetto allo schema testa-corpo.coda poichè appaiono con forme particolari
come quelle tentacolate.
Sei mesi prima del decesso comparsa di sintomatologia disfagia. All’EGDS riscontro di lesione
ulcerata del terzo medio dell’esofago. Diagnosi di carcinoma squamoso dell’esofago. Sottoposto a
che mio/radioterapia pre-operatoria. Sottoposto a gastrectomia parziale, esofagectomia (2/3
inferiori) e colecistectomia. Una settimana dopo l’intervento comparsa di febbre e insufficienza
respiratoria con evoluzione infausta.
Biopsia esofagea:
a) (terzo medio) carcinoma esofageo di epitelio squamoso, infiltrante il corion.
CORION: Porzione non epiteliale della mucosa (lamina propria), si trova al di sopra della
muscolaris mucosae; è costituita da connettivo lasso, e contiene strutture vascolari, cellule
infiammatorie sparse e ghiandole mucosecernenti. Proiezioni digitiformi della lamina propria,
denominate “papille”, si estendono all’interno dello strato epiteliale. Strato che aumenta nelle
esofagiti da reflusso
b) (giunzione esofago gastrica) lembi di muscosa esofagea con focolai di metaplasma
intestinale (quadro morfologico di esofago di Barret)
Esame istologico del pezzo intraoperatorio
Materiale inviato:
a) linfonodi sub-carinali
b) linfonodi intracarinali
c) linfonodi del mediastino superiore
d) colecisti
e) esofago medio e distale
Reperto macroscopico
e) pezzo operatorio riferibile a gastrectomia parziale in continuità con tratto di
esofago lungo 15 cm. Quest’ultimo presenta mucosa per lo più liscia, rosea, con
area lievemente irregolare, e a limiti indistinti, del diametro di 2 cm, situata a
circa 5 cm dall’estremo di resezione prossimale. Perifericamente all’esofago,
nell’avventizia, sono presenti dei nodi di consistenza soda, in parte nerastri. La
mucosa gastrica appare regolarmente placata.
Reperi
1) area irregolare III distale esofageo x4
2) random esofago x2
3) margine esofageo x1
4) random stomaco x1
5) margine gastrico x2
6) linfonodi periesofagei x1
7) linfonodi piccola curva x1
Reperto microscopico e diagnosi
a) nove linfonodi antracotici reattivi
b) due linfonodi antracotici reattivi
c) un piccolo linfonodo
d) colecistite cronica
e) 1,2,3 tratto di parete esofagea. In corrispondenza del repere E2 si osservano
fenomeni di atrofia dell’epitelio, di sclerosi (post attinica), della parete e, nel
connettivo sottoepiteliale, microfocolaio residuo di carcinoma squamoso.
4,5 tratto di parete gastrica fundica senza evidenti alterazioni
6 metastasi di carcinoma dell’epitelio pavimentoso in 1 su 3 linfonodi, con
estese aree di sclerosi e di infiammazione cronica granulomatosa
7 quattro linfonodi reattivi, 2 dei quali con importante reazione lipofagica ed
infiammatoria gigantocellulare (=Reazione lipofagica: lesione flogistica granulomatosa reattiva
a necrosi traumatica del tessuto evolvente in sclerosi e talora calcificazione)
STADIAZIONE: ypT1 N1 Mx
yp significa che la neoplasia è stata ristadiata dopo chemio/radioterapia neo adiuvante
Punti da approfondire
1) individuare i tipi istologici di carcinoma esofageo e collegarli ad eventuali condizioni
precancerose.
2) Identificare i quadri morfologici del carcinoma esofageo che è stato sottoposto a terapia neo
adiuvante pre-operatoria.
Vedi sopra EVIDENZIATO
3) Identificare eventuali tecniche che facilitano l’identificazione della neoplasia residua
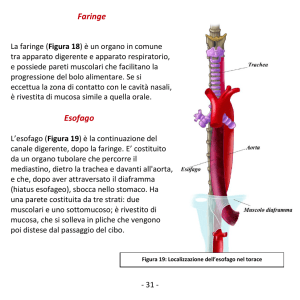
ESOFAGO: è formato dai seguenti strati:
- mucosa: superficie liscia formata da strato epiteliale squamoso stratificato non
cheratinizzante, lamina propria e muscolaris mucosae
- sottomucosa: composta da tessuto connettivo lasso contenente vasi ematici e linfatici, fibre
nervose e ghiandole sottomucose
- tonaca muscolare propria: muscolatura liscia circolare interna e longitudinale esterno con
interposizione di plesso mioenterico
- sierosa: ricopre solo l’esofago addominale. Nel mediastino l’esofago è circondato da una
fascia che si addensa intorno al viscere e agli organo adiacenti come trachea e grossi vasi
La vascolarizzazione dell’esofago è scarsa e segmentaria (contrariamente allo stomaco). Le arterie
esofagee provenienti dall’aorta terminano con una rete capillare prima di penetrare nello strato
muscolare, per poi decorrere longitudinalmente nella sottomucosa.
Arterie:
tiroideee inferiori
intercostali
bronchiali
freniche
gastrica sx
Vene:
ipofaringeee
azigos
emiazygos
emiazygos accessoria
intercostali
gastriche
vie linfatiche
linfonodi:
periesofagei
latero-cervicali
celiaci
della piccola curvatura gastrica
Per la ricca rete linfatica della sottomucosa, nelle neoplasie i margini di resezione sono molto ampi
(6 - 7 cm).
DRENAGGIO LINFATICO ESOFAGO:
•cervicale linf nell’area compresa tra cartilagine cricoidea e clavicola
•intratoracico linf paraesofagei, linf sottocarenali, linf parabronchiali dx e sx, linf ricorenziali, linf
apicali
•addominale iato esofageo superiore, pancreas, ilo splenico, legamento epatoduodenale
Drenaggio linf. in senso longitudinale:
linf. periesofagei verso l’alto ai linfonodi del collo, verso il basso ai linf. del plesso celiaco e
della piccola curvatura gastrica.
Esofagite: si parla di esofagite quando il processo infiammatorio è dimostrabile istologicamente. In
linea generale i quadri istologici sono del tutto aspecifici e nella maggior parte dei casi non
consentono di risalire al movente etiologico. La causa più importante è il reflusso del contenuto
acido peptico, minore importanza rivestono gli agenti infettivi batterici virali e micotici. Altre
cause: ingestione di sostanze irritanti, caustiche, di alcuni farmaci, di alcool, di cibi troppo caldi o
troppo freddi, di corpi estranei; irradiazione; uremia; intubazione prolungata; manovre strumentali
non correttamente eseguite; morbo di Chron.
Esofagite da reflusso: determinata dal reflusso acido-peptico del contenuto gastrico nella parte
distale dell’esofago, più raramente dal reflusso alcalino della bile duodenale(in pz. acloridrici con
anemia perniciosa e in gastrectomizzati totali o subtotali). La mucosa esofagea è scarsamente
resistente all’azione del secreto acido peptico dello stomaco, soprattutto se sono presenti Sali biliari.
Principali cause: vomito ripetuto, stenosi pilorica, diabete (in cui sono presenti disturbi neurologici
che alterano la normale motilità esofagea), la gravidanza (nella quale gli alti livelli di progesterone
provocano una ipotensione dello sfintere esofageo inferiore), sclerodermia (nella quale è alterata sia
la funzione sfinteriale che la normale motilità esofagea), l’ernia iatale. Macro: iperemia, poi
erosioni ed ulcerazioni. Mucosa ha un aspetto granuleggiante, friabile, e facilmente sanguinante.
Micro: iperplasia degli strati basali dell’epitelio, aumento in altezza delle papille del corion,
infiltrazione di neutrofili nella lamina propria ove in condizioni di normalità non sono reperibili.
Nella maggior parte dei casi le alterazioni flogistiche sono limitate alla tonaca propria.. Quando è
interessata la sottomucosa la guarigione avviene con formazione di tessuto fibroso che va incontro a
retrazione cicatriziale con esito in stenosi. Tutte le stenosi esofagee costituiscono una condizione
predisponente all’insorgenza di un carcinoma(esofagite da raggi, esofagite da caustici in
particolare da soda caustica). La gravità dei sintomi non è legata al quadro istologico e può
complicarsi con emorragia, stenosi, ulcerazioni ed esofago di Barret.
Esofagite da raggi(o attinica):in seguito a irradiazioni del mediastino per neoplasie del polmone,
della mammella o dei linfonodi paratracheali, l’esofago può subire delle lesioni di varia gravità in
rapporto alla dose. Lesioni acute: iperemia, edema della mucosa, nei casi più gravi compaiono
ulcerazioni della mucosa. In fase ripartiva la mucosa appare pallida, grigiastra e granulosa e la
necrosi è sostituita da tessuto di granulazione. Quando dosaggio è elevato anche la tonaca
muscolare risulta danneggiata e l’esito è rappresentato dalla fibrosi e dalla stenosi.
Acalasia: alterazione del normale meccanismo di rilasciamento dello sfintere esofageo inferiore
associato a perdita del normale ritmo peristaltico nei 2/3 inferiori dell’esofago che appare allungato
e dilatato fino ad acquistare un diametro enorme(megaesofago acalasico). La parete è spessa per
ipertrofia della muscolare. La mucosa è edematosa, iperemica ed ulcerata, tappezzata da chiazze di
leucoplachia per un processo di esofagite cronica da ristagno di materiale alimentare. Disfagia
progressiva, rischio di polmonite ab ingestis. In una piccola percentuale(2-7%) sviluppo di un
carcinoma epidermoidale nella porzione ectasica dell’esofago.
Etiologia è sconosciuta, tranne che nella malattia di Chagas( causata da Trypanosoma Cruzi, un
protozoo che produce una grave miocardite, e determina lesioni della innervazione intrinseca del
tubo digestivo che sono causa di megaesofago, megaduodeno e megacolon).
Patogenesi: non ben conosciuta, sicuramente c’è un’alterazione del controllo nervoso sulla
peristalsi (distruzione delle cellule gangliari dei plessi mioenterici, alterazioni delle fibre nervose
del vago e dei neuroni del nucleo motore dorsale del vago, diminuzione delle fibre nervose
contenenti VIP (che normalmente determina il rilasciamento dello sfintere inferiore)
Malattia di Chagas
ACUTA: È una miocardite acuta che è clinicamente evidente in meno del 5% dei casi, di solito nei
casi pediatrici in aree endemiche. La maggior parte delle volte è lieve e reversibile. Si
hanno tachicardia e turbe della ripolarizzazione ventricolare, basso voltaggio del
complesso QRS, ischemia sub-epicardica, blocchi atrio ventricolari di vario grado. Si possono avere
anche altre manifestazioni cardiache, conseguenza di una vera e propria pancardite (epicardite,
miocardite ed endocardite), che può evolvere in insufficienza cardiaca congestizia; la morte può
anche sopravvenire in pieno benessere per fibrillazione ventricolare o tromboembolia acuta. Le più
comuni anomalie elettrocardiografiche nella fase acuta sono la tachicardia sinusale, l’allungamento
del tratto P-R, il sottoslivellamento del tratto S-T e l’inversione dell’onda T, il basso voltaggio del
complesso QRS, e l’allungamento del tratto Q-T (segni di miocardite acuta).
CRONICA:La più comune delle forme determinate insorge nel 30% circa degli individui infetti,
soprattutto maschi. È la forma con la maggiore morbidità e mortalità ed è quella che influisce più
pesantemente sulla qualità della vita del paziente. Si ha un progressivo deterioramento del
tessuto miocardico, con evoluzione inesorabile verso l’insufficienza di pompa, a volte anticipata
dalla morte cardiaca improvvisa del paziente per l’insorgenza di un’aritmia fatale. In Brasile la
cardiopatia cronica colpisce il 25-30% degli individui infetti, 1/5 dei quali (il 5% del totale) sono
destinati a morirne.
L’insufficienza cardiaca congestizia, quando si manifesta, è solitamente difficile da trattare e da
controllare. Prevalgono le manifestazioni congestizie (cuore destro) su quelle da insufficienza di
pompa (cuore sinistro). Si hanno dispnea da sforzo, edema periferico, ascite, fegato da stasi, dolore
toracico, e palpitazioni. Di solito non evolve in edema polmonare acuto. Le complicazioni più
frequenti sono l’embolizzazione sistemica e polmonare e la morte cardiaca improvvisa, per aritmie
fatali. Pertanto rispetto ai pazienti affetti da cardiomiopatia dilatativa di altra natura (ipertensiva,
ischemica, idiopatica), quelli affetti dalla forma chagasica hanno una prognosi peggiore.
Le più comuni anomalie elettrocardiografiche nella fase cronica sono i blocchi intraventricolari
(blocco di branca destra e emiblocco anteriore sinistro), bradicardia sinusale, blocchi atrioventricolari di vario grado, blocco seno-atriale, fibrillazione atriale, aritmie ventricolari
(extrasistoli polimorfe, tachicardia ventricolare fino alla fibrillazione ventricolare), conseguenze del
danno al tessuto di conduzione.
Patogenesi [modifica]
Durante la fase acuta della malattia si ha un’imponente moltiplicazione del tripanosoma nelle fibre
muscolari cardiache, soprattutto nelle fibre del sistema di conduzione atrio-ventricolare a formare
nidi di cellule amastigoti. Le alterazioni comprendono ispessimento delle pareti ventricolari,
dilatazione biventricolare, aneurismi apicali e trombi murali. La patogenesi della
conseguente miocardite acuta è da attribuire alla reazione cellulo-mediata nei confronti delle fibre
muscolari cardiache, sia contro quelle parassitate sia contro quelle sane, contro le cellule
degli endoteli capillari del miocardio e contro le fibre del sistema nervoso autonomo intracardiaco.
La localizzazione degli amastigoti nel miocardio e la liberazione in questa sede di antigeni
protozoari, che si legano alle cellule vicine e diventano bersaglio della risposta immunitaria umorale
e cellulare contro T.cruzi, provocano una miocardite interstiziale autoimmune. L'organismo diventa
incapace di controllare le risposte antiself e i danni che ne derivano sono proporzionali alla
concentrazione di autoanticorpi prodotti (tachicardia, insufficienza cardiaca, che può portare all'
arresto cardiaco in poche settimane o mesi dall'infezione). Inizia anche un processo di distruzione
dei gangli del SNA e, talvolta, di quello centrale, responsabile delle sindromi che si possono
osservare successivamente, durante la fase cronica. La flogosi regredisce quasi del tutto quando il
sistema immunitario giunge a controllare la replicazione del protozoo e a ridurne drasticamente la
carica.
Nella fase di malattia cronica, anche asintomatica, persiste uno stato di minima infiammazione con
foci di flogosi miocardica che poi regrediscono, ma che sono seguiti dalla comparsa di nuovi altri
focolai. Si mantiene un equilibrio dinamico tra il sistema immunitario dell’ospite ed il parassita, in
virtuale assenza di segni e sintomi. Tuttavia persiste una miocardite diffusa con un danno
progressivo, più o meno rapido, ma sostanzialmente inarrestabile, che può precipitare in qualsiasi
momento in una forma clinicamente sintomatica, che evolve verso la cardiomiopatia dilatativa e
l’insufficienza cardiaca.
È stato anche ipotizzato un meccanismo patogenetico di tipo autoimmune umorale con produzione
di anticorpi diretti contro antigeni del tessuto cardiaco: T.cruzi condividerebbe antigeni con il
miocardio. Il fatto spiegherebbe il continuo danno alle fibre muscolari del miocardio anche nella
fase cronica quando i nidi di amastigoti sono pochissimi. L’entità del danno miocardico rende conto
dei disturbi della conduzione atrio-ventricolare e intra-ventricolare e delle aritmie
atriali e ventricolari.
Anatomia patologica [modifica]
Si ha il reperto istopatologico di miocardite cronica e attiva, con necrosi microfocale e disseminata,
con densi focolai di fibrosi interstiziale confluente che tende a disorganizzare la struttura delle fibre
muscolari cardiache e a coinvolgere il sistema contrattile e di conduzione. Nello spazio interstiziale
è presente un infiltrato cellulare infiammatorio misto
di granulociti, linfociti, monociti, macrofagi,mastocellule e plasmacellule. Durante la fase cronica le
cellule ganglionari del sistema di conduzione e le fibre miocardiche vengono progressivamente
distrutte; la funzionalità cardiaca comincia a essere compromessa quando il 20% circa dei neuroni
vengono distrutti, mentre la funzionalità esofagea è sufficiente anche con l’80% dei neuroni non
funzionanti.
Nelle fasi precoci della cardiopatia cronica, il cuore può essere di dimensioni normali o solo
lievemente aumentate, ma successivamente si può raggiungere una notevole cardiomegalia.
Macroscopicamente il cuore chagasico cronico è ipotonico con pareti assottigliate, soprattutto a
livello dell’atrio destro. In più della metà dei casi si forma un aneurisma del segmento apicale
delventricolo sinistro (aneurisma vorticoso della punta), oppure del setto interventricolare, che
raramente si rompe: è un reperto patognomonico e un segno prognostico sfavorevole di malattia di
Chagas nelle zone endemiche. Non è responsabile dell’insorgenza dell’insufficienza ventricolare,
ma può provocare aritmie e fenomeni tromboembolici anche fatali. Si formano trombi murali nelle
camere cardiache soprattutto in presenza di fibrillazione atriale e si possono avere embolie
cerebrali, spleniche, renali, e polmonari.
DIAGNOSI MALATTIA DI CHAGAS
Esami bioumorali : Nella forma acuta si possono avere leucocitosi con linfocitosi relativa.
La transaminasemia è spesso elevata. La rachicentesi mostra pleocitosi con una prevalenza
di linfociti, aumento dellaprotidorrachia e spesso si può incontrare il T.cruzi.
Esami microbiologici: Nelle prime 6-12 settimane (fase acuta), si possono vedere
i tripomastigoti nell’esame a fresco della goccia di sangue (ingrandimento x400): si vedono i rapidi
movimenti dei tripomastigoti. Al microscopio si devono valutare almeno 100 campi prima di dare
per negativo l’esame. Lo striscio sottile e la goccia spessa di sangue periferico colorati (Giemsa)
hanno minore sensibilità, ma permettono una migliore distinzione tra T.cruzi e T.rangeli, infatti
quest'ultimo è più lungo (25-35 mm) ed ha un cinetoplasto più piccolo. L’esame del QBC dopo
concentrazione con centrifugazione dopo lisi deglieritrociti o defibrinizzazione aumenta la
sensibilità fino al 90-100%.
Nella fase cronica la parassitemia è bassissima, perciò gli esami emoscopici risultano quasi sempre
negativi. Per confermare la diagnosi si esegue laxenodiagnosi oppure l’emocoltura. I parassiti nel
sangue vanno coltivati su un terreno speciale (liver infusion tryptose, LIT) mantenuto a 28 °C ed
osservato mensilmente per 4-6 mesi. Le emocolture hanno una sensibilità del 100% nella fase acuta
ma solo del 20-70% nelle fasi croniche.
Xenodiagnosi : è il miglior sistema di diagnosi parassitologica nelle fasi indeterminata e cronica. Si
lascia che una quarantina di ninfe di triatomine al III-IV stadio, allevate in laboratorio e pertanto
sane, chiuse in 4 scatole (10 per scatola), succhino il sangue dal braccio del paziente. Ultimamente
si è adottata la xenodiagnosi artificiale: 10ml di sangue nel paziente in un contenitore coperto da
una membrana attraverso la quale viene succhiato dalle ninfe. Le feci e l’intestino delle ninfe
vengono sacrificate ed esaminate 30-45-60 giorni dopo, per la ricerca dei tripomastigoti metaciclici.
Il test ha una sensibilità del 50%.
Diagnosi sierologica: I test sierologici che ricercano IgM anti–T.cruzi sono attualmente di impiego
limitato nella diagnosi perché non sono facilmente disponibili e non sono standardizzati. Nelle
infezioni recenti, le IgM compaiono in circolo 15 giorni dopo l’infezione, con un picco dopo 17-45
giorni e persistono per anni. Le IgM prevalgono nella fase acuta. Nelle fasi indeterminata e cronica
prevalgono le IgG e le IgA.
Tra gli esami disponibili, il test di fissazione del complemento (CF) di Machado-Guerreiro è
considerato il più fattibile. L’immunofluorescenza indiretta (IFA) è rapida e facile da eseguire,
molto sensibile e può distinguere IgM da IgG: è la più precoce nell’evidenziare la positività per
IgM dopo l’infezione iniziale seguita dall’emagglutinazione diretta (DA). Questi test hanno una
sensibilità superiore al 95%. Per la diagnosi delle forme congenite è stato introdotto un test di
immunofluorescenza indiretta per la ricerca delle IgM.
L’Enzyme-linked immunosorbent assay (ELISA) è come l’IFA molto sensibile e può distinguere
IgM da IgG. I test di agglutinazione sono l’emagglutinazione indiretta (IHA), l’emagglutinazione
diretta (DA), la latex agglutination (LA) ed il test di flocculazione.
Un problema notevole è quello dei falsi positivi, che possono aversi in caso
di leishmaniosi, malaria, sifilide, mononucleosi infettiva, tubercolosi, lebbra, collagenopatie e vascu
liti o in caso di infezione da T.rangeli.
È sempre consigliato l’impiego di almeno due tecniche sierologiche differenti per la conferma della
diagnosi di infezione.
Biologia molecolare : il test di ricerca del DNA dal cinetoplasto di T.cruzi con l’amplificazione
mediante reazione a catena della polimerasi (polymerase chain reaction o PCR), può evidenziare la
presenza di 1 tripanosoma in 20 mL di sangue con una sensibilità del 96-100%.
Diagnosi delle forme congenite [modifica]
La madre deve essere sieropositiva per T. cruzi. Deve essere reperibile il T. cruzi nel sangue
del cordone ombelicale. Presenza di IgM specifiche nel siero subito dopo la nascita, o di IgG dopo 6
mesi, in assenza di trasmissione vettoriale, trasfusionale od orale.
Pliche mucose dell’esofago: sono rare, formate da protrusioni mucosali nel lume dell’esofago.
Hanno forma semilunare sono eccentriche e coinvolgono spt l’esofago superiore. La membrana
mucosa di rivestimento è di epitelio squamoso, stroma sottomucoso vascolarizzato. Possono essere
congenite o post esofagite da reflusso di lunga durata, graft versus hst disease e dermatite bollosa.
Nella sindrome di Plummer Vinson si associano ad anemia sideropenica, glossite e cheilosi e hanno
rischio aumentato di sviluppo di k esofago cervicale.
ESOFAGO DI BARRET: complicanza del reflusso gastro esofageo. Fattore di rischio per
adenocarcinoma. Condizione in cui l’epitelio squamoso distale dell’esofago è sostituito da epitelio
cilindrico metaplastico in risposta a prolungati stimoli lesivi, si ha metaplasia perché l’epitelio non
riesce a sopportare il ph basso dell’esofago. Sono presenti anche cellule cilindriche che presentano
caratteristiche ultrastrutturali sia secretoria che di assorbimento. Presenza di ghiandole mucose
Criteri diagnostici:
- evidenza endoscopica di epitelio cilindrico di rivestimento sopra la giunzione gastroesofagea
- evidenza istologica di metaplasma intestinale nei campioni boptici
Può presentarsi a segmento corto a o segmento lungo (cut off 3 cm)
Microscopia: mucosa dell’esofago di Barret è vellutata di colore rosso, si tova immediatamente
sopra la giunzione gastroesofagea. La presenza di cellule calciformi intestinali rende certa la
diagnosi
Si può classificare:
tipo I o metaplasia intestinale completa, contenente cellule di Paneth, caliciformi e cellule
assorbenti (è un tipo raro);
tipo II, quadro ghiandolare misto con cellule foveolari gastriche e cellule caliciformi mucipare;
tipo III, fatto da sole cellule caliciformi. L'epitelio cilindrico così originatosi è più resistente al
danno indotto dalla pepsina e dall'acido di quanto lo sia quello squamoso
Displasia: anomalie citologiche con nuclei grandi ipercromici, fitti e pluristratificati, con scomparsa
dello stroma fra ghiandole adiacenti. La displasia di grado elevato ha alto rischio di trasformazione
in adenocarcinoma circa di 30 volte rispetto alla popolazione generale
EB con epitelio colonnare di tipo gastrico cardiale (giunzionale), caratterizzato da un'architettura
similfoveolare gastrica con epitelio superficiale colonnare e ghiandole mucose di tipo cardiale,
talora dilatate. Vi possono essere rare, sparse cellule caliciformi.
n.b. L' esofago di Barrett di tipo cardiale differisce di solito dalla mucosa gastrica cardiale per la
presenza di distorsione ghiandolare, edema ed infiltrati infiammatori cronici.
2 - EB con epitelio colonnare di tipo gastrico fundico, caratterizzato da architettura analoga alla
mucosa ossintica, a superficie foveolare con epitelio superficiale mucosecernente e ghiandole
costituite da cellule principali e parietali; sono presenti rare cellule endocrine. Le ghiandole sono
separate da abbondante tessuto connettivo della lamina propria che conferisce un aspetto atrofico
alla mucosa. Assenza di differenziazione intestinale (reperto di mucosa fundica, non atrofica è
suggestivo di ernia iatale).
3 - EB con epitelio colonnare di tipo intestinale (specializzato) caratterizzato da una superficie
villiforme con epitelio costituito da cellule caliciformi (goblet cells) e da cellule colonnari; in
profondita' sono presenti ghiandole simili alle cripte rivestite da cellule cuboidali siero-mucose, 5
con cellule enterocromaffini. Rare le cellule endocrine, le cellule di Paneth e di tipo assorbente
con orletto a spazzola.
n.b. Le ghiandole sono spesso contigue alla muscularis mucosae e poggiano su di essa con
fibrocellule muscolari che sfioccano nella lamina propria. (reperto suggestivo di pregressa
lesione ulcerativa con rigenerazione epiteliale sullo strato muscolare).
4 - EB di tipo misto (combinazione dei vari tipi fra di loro con i piu' vari mosaicismi (cardiale +
fundico; cardiale + specializzato; fundico + specializzato; cardiale + fundico+ specializzato
Differenza metaplasia-displasia
La displasia è la proliferazione anormale di tessuto, e, se di alto grado, può evolversi in Carcinoma
in situ, cioè un gruppo di cellule che hanno perso le caratteristiche tipiche del tessuto a cui
appartengono, ritornando alla forma più primitiva e riproducendosi rapidamente; tuttavia questa
forma è ancora localizzata. La trasformazione finale in carcinoma invasivo si ha quando le cellule
tumorali si staccano dal tessuto originale e si spostano in altre parti del corpo diffondendo il tumore.
Il tessuto displastico presenta cambiamenti nella velocità di riproduzione dei suoi elementi cellulari,
la quale sfugge a sistemi di controllo. Non si tratta di celluletumorali, siano esse benigne o maligne,
ma di cellule che hanno subito un cambiamento, in seguito ad esposizione ad un agente, sia esso
fisico (radiazioni), chimico (idrocarburi aromatici e altre sostanze) o biologico (virus oncogeno).
Il processo displastico può essere reversibile; le cellule displastiche possono tornare alla loro
condizione di cellule normali, mentre una cellula tumorale trasformata non può farlo più; si dice
infatti che essa è ormai una cellula "iniziata" che attende soltanto un agente promovente o cocancerogeno per la comparsa della malattia neoplastica vera e propria.
Le cellule displastiche sono cellule uguali alle altre cellule normali sotto l'aspetto differenziativo,
pur cambiando qualcosa a livello morfologico; un esempio è la perdita della distinzione tra i poli
della cellula (polo basale e polo apicale).
Quando la cellula perde le sue peculiarità morfologiche del tessuto da cui deriva e risulta
trasformata irreversibilmente, allora si ha una cellula neoplastica a tutti gli effetti. In un certo senso
si può dire che la cellula neoplastica maligna riassume le peculiarità della cellula displastica
(proliferante) e della cellula anaplastica (indifferenziata).
La metaplasia è la trasformazione di una cellula di un tipo in una cellula di un altro tipo, causata da
un qualche stimolo anormale. Ad esempio il fumo di sigaretta causa la metaplasia squamosa nelle
vie respiratorie. Può PRECEDERE la displasia perciò richiede monitorizzazione delle zone in
metaplasia.
La metaplasia è, sostanzialmente, la trasformazione di una cellula di un tipo (ad es. esofagea) in una
cellula di un altro tipo (ad es. intestinale).
La displasia è la proliferazione anomala di un gruppo di cellule che hanno perso le caratteristiche
tipiche del tessuto a cui appartengono, ritornando alla forma più primitiva e riproducendosi
rapidamente; si tratta di una proliferazione localizzata che, specie quando di alto grado, può
evolversi in carcinoma in situ.
L'iperplasia può anche essere causa di tumori benigni, ma si CONTRAPPONE alla neoplasia,
perché, anche se le cellule in iperplasia proliferano in quantità anormale, rimangono regolate come
cellule sane. La si considera dipendente da causa psicologiche. Un esempio di risposta
iperplastica,normale, è il naturale ingrossamendo delle ghiandole mammarie in risposta alla
gravidanza.
K ESOFAGO: benigni
Leiomioma è un tumore di origine muscolare ed è il più frequente, origina nel terzo distale
dell’esofago, si presenta con nodosità rilevata ricoperta da muscolatura liscia. Ci possono anche
essere fibromi, lipomi, emangiomi, linfangiomi e neurofibromi. In particolare i lipomi sono anche
definito come polipi fibrovascolari
I conditomi sono polipi associati a infezione da HPV
QUADRO ISTOPATOLOGICO
Concetto di neoplasia multistep:
Epitelio normaleiperplasia basocellularedisplasia a basso gradodisplasia ad alto
gradocarcinoma in situcarcinoma invasivo
Evento precoce: mutazione gene p53. Quindi accumulo mutazioni successive: quali amplificazione
ciclina D1, LOH di geni onosoppressori e amplificazione di oncogeni (EGFR, MYC etc)
•
•
•
•
•
Carcinoma spinocellulare (circa 93%) a vari gradi di differenziazione. Crescita infiltrativa o
espansiva, con o senza reazione desmoplastica (forma scirrosa). Tendenza precoce ad
embolizzazione vascolare
Carcinoma verrucoso
Carcinoma fusocellulare)
Carcinoma basaloide
Carcinoma adenosquamoso
ADENOCARCINOMA: tumore maligno epiteliale con differenziazione ghiandolare che origina
da esofago di Barret. Altri fattori di rischio sono fumo e obesità (infezione da HP è fattore
favorente). Più frequente nei maschi. Causa sintomi come disfagia, calo ponderale, sanguinamento
progressivo, dolore toracico e vomito.
La displasia è una tappa fondamentale per lo sviluppo del tumore, si riscontra anche iperespressione
di p53 e aumento delle cellule proliferanti
Sintomi: disfagia progressiva, odinofagia, pirosi, dolore, polmonite ab ingestis
Morfologia: l’adenok si localizza nell’esofago distale e può invadere il cardias. Inizialmente si
presenta come chiazza piatta o rilevata e può in seguito formare masse nodulari fino a 5 cm o
formare profonde ulcere. Istologicamente il tumore ha un’architettura ghiandolare, è muco
secernente e ha caratteri di tipo intestinale, raramente è costituito da cellule ad anello con castone.
Frequenti le aree di displasia nella mucosa adiacente al tumore.
Deriva dall’epitelio colonnare dell’esofago di Barrett.
Caratteristicamente originario da una mucosa di Barrett nel 3° distale con infiltrazione del cardias
Istologia adenocarcinoma
L’architettura è ghiandolare con alcune cellule muco-secernenti caratteristiche della mucosa
intestinale. Più raramente essi sono costituiti da cellule ad anello con castone di tipo gastrico.
Oppure ancora hanno i caratteri del tumore a piccole cellule scarsamente differenziato.
K SQUAMOCELLULARE:
frequente negli uomini sopra 50 anni, 6% delle neoplasie del
tubo digerente. Fattori di rischio sono alcool, fumo, infezione da HPV, assunzione di cibi caldi e
ricchi di nitriti, acalasia esofagea, contaminanti fungini, deficit di vitamina A e stenosi da reflusso.
Inoltre l’esofagite cronica può essere il risultato di un’aumentata esposizione alle sostanze
cancerogene. Sede più frequente è il terzo medio e inferiore dell’esofago. Aspetto macroscopico:
placca ulcerata profondamente infiltrante e stenosante il lume, meno comune aspetto polipoide o
esofitico, e forma piatta che che crescita intramurale.
Fenomeno frequente è l’invasione della sottomucosa al di là dei margini macroscopici del tumore. Il
tumore avanzato è quello che infiltra la tonaca muscolare
Spesso ci sono dei carcinomo in situ metacroni ( neoplasie insorte in tempi diversi)
Superfiacial esophageal cancer: cancro fino a sottomucosa con o senza mts linfonodali
Early esophageal cancer: cancro fino a sottomucosa senza mts linfonodali
Aspetto istologico: classico carcinoma squamoso con lamine di nidi di cellule poligonali con
tendenza alla cheratinizzazione; talvolta presenza di aree abbastanza estese con aspetti ghiandolari:
carcinoma adenosquamoso.
Rappresenta l’istotipo più frequente.
20% 3° superiore dell’esofago -> mts linfonodi latero-cervicali -> infiltrazione pars membranacea
della trachea e bronco sx, aorta, nervo laringeo ricorrente sx.
50% 3° medio dell’esofago -> mts linfonodi mediastinici, para-tracheobronchiali -> infiltrazione
pars membranacea della trachea e bronco sx, aorta, nervo laringeo ricorrente sx.
30% 3° inferiore dell’esofago -> mts linfonodi perigastrici e celiaci -> infiltrazione diaframma,
pericardio, stomaco
la mancanza di sierosa a rivestimento dell’esofago tende a favorire un’estensione neoplastica locale
per contiguità.
le lesioni si riconoscono all’endoscopia perché inizialmente sono grigio-biancastre con diversa
possibile forma:
- esofitica con lesione polipoide
- piatto (all’endoscopia si riconosce anche per rigidità della parete)
- ulcerata
Sedi di metastasi: per via ematica colpiscono polmone, fegato e surreni
Per contiguità: bronchi, trachea, pleura mediastinica, polmone, cuore, pericardio, aorta, colonna
vertebrale, cardias e stomaco. Ciò avviene per mancanza della sierosa
Metastasi linfonodali:
- tumore cervicale: mts a linfonodi giugulo carotidei, sopraclaveari e paratracheali
- tumore toracico superiore e medio: linfonodi della carina e paratracheali
- tumore toracico inferiore: linfonodi carinali, cardiali e celiaci
tumore addominale: linfonodi cardiali, carinali e del legamento polmonare
TUMORI BENIGNI: 0,5% -1% dei tumori esofagei
proliferazioni tumorali (leiomioma, fibroma)
proliferazioni non tumorali (papilloma, polipi)
il leiomioma è il più frequente si presenta con una neoformazione ovalare che aggetta nel lume
esofageo rivestito da mucosa intatta. Le dimensioni sono varie fino al mioma gigante che avvolge
“a cravatta” l’esofago (2/3 della circonferenza)
VIE DI DIFFUSIONE K ESOFAGO:
LOCALE
•T1/3 superiore/medio albero tracheo-bronchiale, aorta, n. laringeo-ricorrente sx
•T1/3 inferiore diaframma, pericardio, stomaco
EMATICA
•Fegato
•Ossa
LINFATICA
•A livello addominale
iato esofageo superiore
pancreas
ilo splenico
legamento epatoduodenale
•A livello intratoracico
linf paraesofagei
linf sottocarenali
linf parabronchiali dx e sx
linf ricorenziali
linf apicali
•A livello cervicale
linf nell’area compresa tra cartilagine cricoidea e clavicola
La rete linfatica sottomucosa facilita l’estesa diffusione circumferenziale e longitudinale del tumore
e spesso si osservano ammassi di cellule tumorali a diversi cm dalla massa principale.
DIAGNOSI: endoscopia con prelievo bioptico in pz a rischio e brushing (spazzolamento), a volte
si associa la cromoendoscopia: si inietta nel lume esofageo blu di toluidina che si fissa al Dna delle
cellule esofagee, in blu invece appaiono le aree di k in situ, di metaplasia e di esofagite
TC e PET per determinare i rapporti del tumore con le strutture circostanti
TERAPIA: nei casi avanzati si fa un trattamento multimodale con radio chemio prima
dell’intervento. L’exeresi chirurgica va fatta prima che insorga la fibrosi post attinica cioè 30 40
giorni dopo la terapia. La sterilizzazione del pezzo operatorio si verifica circa nel 20-25% dei casi. I
farmaci più testati sono 5-fluorouracile e cisplatino. Le radioterapia conformazionale a fasci esterni
è ora affiancata alla brachiterapia.
Intervento: esofagogastroplastica: acceso toracomico e laparotomico. Resezione della neoplasia con
terzo distale e medio dell’esofago con piccola curva dello stomaco. Tubulizzazione dello stomaco
per sostituire l’esofago oppure trasposizione del colon con suo peduncolo vascolare fino all’esofago
rimanente. Si toglie anche la piccola curva per mantenere i margini dalla neoplasia che devono
essere almeno di 5 cm.
Nei casi inoperabili si fa trattamento palliativo con endoprotesi per dilatare l’esofaago
TERAPIA CHIRURGICA:
3° medio -> esofagectomia totale + linfoadenectomia
3° inferiore -> esofagectomia parziale
lo stomaco, il colon, ed il digiuno sono organi ampiamente utilizzati con successo come sostituti
esofagei, ma lo stomaco è sicuramente il migliore per la facilità nella mobilizzazione e per la sua
ampia vascolarizzazione. Si esegue una esofago-gastro-plastica. La massa tumorale richiede ampi
margini di resezione (6cm).
Dopo la terapia neoadiuvante si riducono le dimensioni del tumore. Ci sono aree di necrosi e
fibrosi con nidi di cellule neoplastiche reattive. Difficile operare perché ci sono aderenze e
materiale cheratinico. Per identificare la neoplasia residua si fa prelievo bioptico e si colorano
le cellule con citocheratina (marcatore per cellule tumorali) per vedere le
cellule sparse nel connettivo fibroso
IMMUNOISTOCHIMICA ricerca di marcatori dei carcinomi provenienti dalle cellule
epiteliali (citocheratine)…
Nel nostro caso (carcinoma squamoso dell’epitelio) è negativo a CK7, CK20, CK8, CK18, CK13,
positivo a survivina CK 14 CK19.
BIOLOGIA MOLECOLARE p63 p53
MARKER TUMORALE CEA
ESAME ISTOLOGICO INTRAOPERATORIO
INDICAZIONI
• Quando l’accertamento istologico della lesione durante l’intervento chirurgico può
modificare la condotta del chirurgo o il tipo di intervento
• Conferma della natura benigna o maligna di una neoplasia
• Conferma dell’operabilità di una neoplasia maligna. Diagnosi di metastasi a distanza, non
note in precedenza ed evidenziate durante l’intervento chirurgico
• Conferma della radicalità dell’intervento chirurgico. Valutazione dei margini di resezione
• NON ANTICIPA LA DIAGNOSI DEFINITIVA il pezzo operatorio viene in parte
usato per l’esame estemporaneo intraoperatorio (per definire come agire sul momento
durante l’intervento) e in parte viene congelato per poi essere usato successivamente (esame
definitivo per definire con precisione la malattia ed il tipo di terapia…)
Esempio: carcinoma mammarioil chirurgo asporta il nodulo, lo manda in AP per l’esame
estemporaneo: se il margine è libero, si ferma, altrimenti prosegue allargando il margine di
resezione.
MODALITA’ di ESECUZIONE
Invio del frammento di tessuto a fresco avvolto in una garza
N.B. NON fissazione NON seccare!
Il patologo: esame del materiale ed esecuzione di uno o più prelievi nelle aree significative.
Esecuzione di apposizioni per esame citologico
Il tecnico di laboratorio: 1) congelamento del frammento di tessuto prelevato, taglio con il criostato
e colorazione delle sezioni istologiche con ematossilina-eosina e/o Giemsa; 2) colorazione delle
apposizioni
Il patologo: esame delle sezioni al microscopio, diagnosi e comunicazione in sala operatoria
Il tutto in circa 25 minuti!!
Fissazione del tessuto congelato in formalina per la valutazione definitiva si scongela il
materiale residuo e lo si esamina con le procedure dell’istologia convenzionale per la conferma
diagnostica; non è però una risposta del tutto affidabile “perché il materiale congelato-decongelato
si può deteriorare”.
RT ESOFAGO:
I volumi di trattamento sono: tumore, esofago a 5cm a monte e a valle dell’esofago, drenaggio
linfatico che è rappresentato dal mediastino posteriore e, a seconda della localizzazione, anche alla
regione cervicale/sovraclaveare o dal tripode celiaco.
Margine di sicurezza dei campi di irradiazione 5-6 cm.
•Radiogrammi frontali e laterali, con esofago
contrastato, in posizione di trattamento per la
definizione dei campi.
•Alcuni autori raccomandano la posizione prona
per allontanare l’esofago dal midollo spinale. •Le scansioni TC devono essere realizzate in
posizione di trattamento. Le lesioni dell’esofago cervicale devono essere trattate fino alla carena
Nelle localizzazioni cervicali la tecnica di trattamento prevede due campi laterali contrapposti o due
campi antero-laterali con cunei. Devono essere irradiati i linfonodi sovraclaveari e del mediastino
superiore (un campo anteriore).
•Nelle localizzazioni dei due terzi inferiori il trattamento viene realizzato con due campi
contrapposti o tre campi.
•Nelle localizzazioni del terzo medio dell’esofago può essere indicata una tecnica rotatoria.Lesioni
limitate 50 Gy, lesioni estese 60-70 Gy. Brachiterapia con I192 può essere fatta a scopo palliativo.
Complicanze: emorragia massiva, fistola tracheo-bronchiale, mediastinite e fibrosi attinica.
Valutazione neoplasia residua:
Immunoistochimica sulle cellule neoplastiche residue nelle aree di sclerosi
In realtà alcuni studi hanno evidenziato come tra gli esami un ruolo imp viene svolto dalla
PET. L’accuratezza della EUS (endoscopia ad ultrasuoni) nell’identificare la neoplasia
residua è del 27-82 % a seconda delle casistiche.
La TC è considerata il gold standard nel monitoraggio dei tumori solidi che non possono
essere operati. Questo perché usare la TC per valutare la risposta alla terapia è difficile per il
limite della tecnica nell’individuare aree di edema e tessuto di riparazione.
COLECISTITE CRONICA:
le colecistiti croniche possono manifestarsi come complicanza di una colecistite acuta oppure
nell'apparente assenza di precedenti episodi acuti. Molto frequente è l'associazione con la calcolosi.
FORME SCLERO-ATROFICHE: spesso la colecisti sede dell'infiammazione cronica è
rimpicciolita, con parete sottile per sclerosi e atrofia della mucosa; infiltrato infiammatorio non è
molto pronunciato.
FORME PRODUTTIVE: altre volte la colecisti è ispessita, raggiungendo spessori di un centimetro
o più. Tale ispessimento è dovuto non tanto ad ipertrofia dei fasci muscolari quanto a
neoformazione di tessuto connettivo fibroso. L'infiltrazione cellulare è rappresentata da linfociti,
plasmacellule e granulociti per lo più eosinofili. I polinucleati neutrofili sono abitualmente poco
abbondanti, ma possono aumentare durante fasi di riacutizzazione.
EMPIEMA CRONICO: è la raccolta di pus cronicizzata, in esito di una colecistitite purulenta, con
ispessimento della parete.
COLECISTITE GHIANDOLARE: forma in cui l'ipertrofia della mucosa infiammata porta a
formazione e parziale fusione di pliche così che ne residuano cavità e fessure pseudoghiandolari;
abitualmente sono anche più sviluppati i seni di Rokitansky-Aschoff. La mancanza di atipie
citologiche deve porre in guardia verso eventuali errori diagnostici nel senso di una proliferazione
tumorale.
COLECISTI DI PORCELLANA: colecisti ispessita e sclerotica, esito di colecistite cronica con
deposizione di sali di calcio.
Macroscopicamente la sierosa si presenta spesso opaca per la presenza di una fibrosi sottostante. Si
possono anche presentare aderenze piuttosto forti come esito di processi flogistici acuti passati. La
parete della colecisti è aumentata di spessore, è rigida ed ha un colore tra il bianco ed il grigiastro.
L'interno della colecisti contiene normale bile e spesso dei calcoli.
Microscopicamente si può evidenziare una reazione flogistica. Si vai dalla presenza d'un infiltrato
sparso (qualche linfocita, macrofagi e plasmacellule) fino ad una marcata invasione di cellule
mononucleate con associata una fibrosi sottoepiteliale e sottosierosa. L'epitelio della colecisti può
andare incontro ad iperplasia ed erniare attraverso lo strato fibromuscolare formando i cosiddetti
seni di Rokitansy-Ashoff.
Un quadro particolare è quello della colecistite granulomatosa caratterizzato dalla presenza di
noduli, presenza di calcoli e d'un infiltrato infiammatorio cronico ed istiociti ricchi di lipidi immersi
in abbondante tessuto fibroso. Il tutto, macroscopicamente, può assomigliare ad una lesione
neoplastica maligna.
Talvolta la presenza di calcificazioni massive può dare origine ad un quadro di colecisti a
porcellana.
TUMORI DELLA COLECISTI
Tum benigni( si vedono alla colecistografia e possono essere scambiati per tum maligni ma nessuno
evolve)--->papillomi <1 cm, escrescenze arborescenti nella mucosa, spesso peduncolati. Micro
hanno degli assi connettivali che costituiscono lo stroma e sono rivestiti da ep cilindrico tipico.
Singole papille possono staccarsi e diventare parte costituente di un calcolo.
Adenomi: rilievo emisferico sodo <1cm. Micro:ghiandole tappezzate da ep cilindrico tipico
addossate a stroma fibroso
Adenomioma nello stroma ha fibrocellule muscolari lisce. Considerato un amartoma
CARCINOMA DELLA COLECISTI---> non molto frequente, donne colpite con frequenza doppia.
80-90% dei casi sono presenti calcolosi e colecistite ma il num di pz con calcolosi che sviluppa tum
è basso. Interessa il collo e il fondo dell'organo, forma infiltrante o vegetante. Nella forma
infiltrante possono esserci difficoltà macroscopiche nel distinguerlo da una colecistite cronica
produttiva(quella con formaz di connettivo fibroso). Istotipo + comune è l'adenok, seguito dallo
scarsamente differenziato, + rari aspetti papillari, squamosi e adenosquamosi. Raram è trattabile alla
diagnosi, diffonde ai lnf ilo epatico e per contiguità al letto epatico e a volte al duodeno e al
pancreas.
Nel nostro caso la parete era sclerotica e probabilmente la colecisti è stata tolta per questo, infatti la
colecistectomia non fa parte dell'intervento necessario per il tum del terzo medio dell'esofago.
LINFONODI CON PIGMENTO ANTRACOTICO: sono linfonodi che drenano dal polmone o
dall’esofago e il pigmento deriva da smog e fumo
Antracosi:deposito di pigmenti di carbone inalati e fagocitati dai macrofagi alveolari o interstiziali
che,successivamente, si accumulano nel tessuto connettivo presente intorno ai vasi linfatici.
All’esame autoptico il pigmento antracotico distribuito in strie lineari ed in aggregati consente di
identificare con facilità la rete linfatica ed i linfonodi polmonari
Riscontro autoptico
Esame esterno e fenomeni post mortali
Cadavere di sesso maschile dell’età apparente di 60 aa, in scadenti condizioni di nutrizione, con
abito eunucoide.
ABITO EUNUCOIDE
Col termine eunuco ("letto" e "custodisco") sono indicati quegli uomini che erano sottoposti, in età
prepuberale o puberale, a interventi più o meno estesi di mutilazione dell'apparato genitale, tali da
condurli a impotentia generandi o a una più radicale impotentia coeundi.
impotentia generandi - Caratterizzata dall'impossibilità di generare prole, ovvero causata da
un'azoospermia o da un'anomalia degli spermatozoi; quindi incapaci di dar vita ad un embrione
vitale
impotentia coeundi - impossibilità fisica di eiaculare, ma con una normale capacità erettiva. Spesso
è causata da un'incapacità di formare lo sperma (aspermia), oppure a causa di un'interruzione dei
dotti deferenti, impedendo così l'emissione all'esterno del seme.
impotentia erigendi - È la più grave ed è caratterizzata dall'impossibilità fisica dell'organo di
compiere l'erezione; quindi l'atto sessuale. In taluni casi potrebbe essere causata o accentuata, specie
nei soggetti giovani, dalla presenza di un blocco psichico (come nel caso dell'ansia da prestazione).
Questi soggetti presentano solitamente alta statura ed alto rapporto arti/tronco
Macchie ipostatiche di II grado alle regioni declivi esenti da compressione. Rigidità cadaverica in
parte risolta al cingolo scapolo omerale e alla nuca.
Apparato tegumentario
Ferite chirurgiche suturate in sede laterocervicale e laparotomica addominale mediana
SNC
Nulla di patologico
Apparato cardiovascolare
Versamento pericardio sieroso (100 cc.). Cuore di 430 gr. (nel maschio tra 280 e 340 grammi, nell’adulto
di sesso femminile è compreso fra 230 e 280 grammi) Con lieve ipertrofia ventricolare sx. nulla alle
valvole. Coronarosclerosi e aterosclerosi aortica di grado lieve. Arteria polmonare pervia.
VERSAMENTO PERICARDICO: normalmente nel pericardio sono presenti 30-50 ml di un liquido
chiaro, trasparente, di colore paglierino. Il pericardio può accogliere in condizioni patologiche (es
pericardite) anche fino a 500ml. Il versamento però deve accumularsi gradualmente e nn superare
tale volume e sarà visibile la classica immagine globoide dell'ombra cardiaca, riscontrabile anche
all'RX torace. In caso di accumulo improvviso di un volume anche minore (200-300 mL) come in
caso di dissezione aortica e rottura di cuore per IMA, trauma o endocardite, si può arrivare al
tamponamento cardiaco anche fatale per ostacolo al ritorno venoso e conseguentemente del
riempim ventricolare da compressione degli atri e vene cave.
La principale causa di versamento pericardico è la pericardite:
PERICARDITI
agenti infettivi: virus, batteri piogeni, TBC, funghi e altri parassiti
immunomediata: LES, febbre reumatica, sclerodermia, post-cardiotomia, post IMA (sdr Dressler,
alcune sett dopo), ipersens da FC
altre: IMA, uremia, dopo interv CCH, neoplasia, trauma, irradiazione
PERICARDITE ACUTA:
SIEROSA: essudato sieroso è tipico dei processi infiamm nn infettivi come la mal reumatica, il
LES, la sclerodermia, i tumori e l'uremia. Un'infezione dei tess contigui al pericardio (es pleurite
batterica) può dare irritazione del pericardio parietale dando versam sieroso sterile che può evolvere
in pericardite siero-fibrinosa o addirittura in franca reaz suppurativa. Infez virale in altra sede, infez
vie aeree sup, polmonite, parotite precede la pericardite e funge da focolaio primario dell'infez.
Il liquido che si forma in queste forme deriva dall'aumentata permeabilità dei vasi e dalla
dilatazione ed è caratterizzato da elevato peso specifico e molte proteine.
FIBRINOSA E SIERO-FIBRINOSA: sdr Dressler, uremia, irradiazione torace, mal reumatica, LES
traumi e CCH.
PURULENTE E SUPPURATICA
EMORRAGICA
CASEOSA sempre TBC
Nel nostro caso il lieve versamento pericardico potrebbe essere causato da un lieve scompenso
cardiaco. Anche se non è fibrinosa può essere in parte associata all'irradiazione del torace
neoadiuvante all'intervento.
IPETROFIA VENTRICOLARE SX
ipertrofia concentrica--->sovraccarico di pressione (IPERTENSIONE ARTERIOSA O
POLMONARE, STENOSI OSTIO VALVOLARE AORTICO O POLMONARE)
ipertrofia eccentrica--->sovraccarico di volume ---> INSUFFICIENZA VALVOLARE AORTICA
O MITRALICA, TRICUSPIDALE O POLMONARE. ANEMIA GRAVE, IPERTIROIDISMO,
FISTOLE AV, GRAVIDANZA ecc (questo porta alla dilatazione con aumento del diametro
ventricolare. Lo spessore parietale e la massa muscolare sono aumentate in maniera proporzionale
al diametro della camera. A causa della dilatazione però lo spessore parietale può risultare normale
o inferiore alla norma.)
Data l'assenza di reperti patologici sulle valvole è possibile pensare che l'ipertrofia sx sia in questo
caso da imputare all'ipertensione arteriosa.
Apparato respiratorio Macro:versamento pleurico sieroso (200 cc.) e placche pleuriche ialine
bilaterali (dimensioni complessive 130 cm2). Polmone dx di gr 880 e sx di gr 840 con gravissimo
edema polmonare e focolai basali di addensamento, a tratti confluenti.
BRONCOPOLMONITE Le infezioni delle vie respiratorie sono causate prevalemtemente da
virus, ma le infez batteriche virali, da micoplasma e infez fungine del polmone hanno ancora un alto
grado di morbilità e mortalità nella popolazione.
Le polmoniti vengono suddivise in:
1. Broncopolmoniti
2. Polmoniti lobari
3. Polmoniti interstiziali
Broncopolmoniti: si tratta di polmonite batterica che presenta distribuzione anatomica caratteristica,
ovvero addensamento parcellare del polmone
La polmonite lobare invece èuna forma di infezione batterica che determina un addensamento
fibrinoso suppurativo di gran parte di un lobo o di un intero lobo polmonare.
Questa distinzione è spesso difficile da applicare.
I focolai di broncopolmonite sono aree addensate di infiammazione suppurativa acuta.
L'addensamento può essere a chiazze in un lobo, ma è in genere multilobare e spesso bilaterale e
per lo più basale.
Leisoni ben sviluppate hanno spessso un diametro compreso tra 3 e 4 cm, livemente rilevate,
asciutte, granulari, di colore dal grigio-rossastro al giallo, con margini poco delimitati.
Istologicamente, la reazione in genere evolve formando un essudato purulento, ricco di neutrofili
che riempie i bronchi, i bronchioli e gli spazi alveolari adiacenti.
Complicanze di una polmonite:
danno e necrosi tissutale con formazione di ascessi (partic freq con infezioni da
Pneumococco tipo 3 o Klebsiella)
diffusione dell'infezione alla cavità pleurica
organizzazione dell'essudato, con trasformazione di un aporzione del polmone in tessuto
solido
disseminazione batteriemica a valvole cardiache, peicardio, cervello, reni, milza o
articolazioni, causando ascessi metastatici, endocardite, meningite o artrite suppurativa.
Caratteristico aspettoradiologico di broncopolmonite: opacità focali.
PLACCHE PLEURICHE Micro: pleura parietale con marcata scleroialinosi (cfr placca pleurica).
Multipli focolai di broncopolmonite con aspetti di iniziale escavazione asessuale.
: Macro: placche pleuriche cartilaginoidi, di color avorio, lievemente rilevate e con margini netti. Si
possono trovare in corrispondenza delle zone anteriori e posterolaterali della pleura parietale e sulla
cupola diaframmatica. Hanno forma variabile e sono abitualmente multiple, spesso bilaterali
(superficie complessiva anche di 100 cm^2).
La calcificazione è assai comune (denominate anche placche calcifiche) e le rende ben visibili
all'esame radiologico con visualizzazione di ispessimenti pleurici radiopachi e calcifici.
Micro: sono bande di connettivo ialino intrecciate con rare cellule e scarsi vasi sanguigni. Non
contengono corpi asbestosici. Non si riscontra alcun elemento cellulare in base al quale si possa
sospettare un'elevata moltiplicazione cellulare e tanto meno la possibilità di trasformazione
meligna.
Eziopatogenesi: rapporto tra presenza di queste lesioni e pregressa esposizione all'asbesto
(professionale e ambientale). La grandezza e il numero delle placche pleuriche non sono correlati al
livello di atogenesiesposizione all'amianto o con il tempo di esposizione.
Solo di rado si presentano in individui che non hanno nessuna storia o evidenza di esposizione
all'asbesto.
I meccanismi patogenetici rimangono ancora piuttosto oscuri
Raramente l'esposizione all'asbesto causa versamenti pleurici, che sono di solito sierosi ma possono
anche essere ematici.
Di rado anche fibrosi pleurica viscerale diffusa che, in casi avanzati, fa aderire tenacemente il
polmone alla parete della cavità toracica.
Epidemiologia: in generale M colpito più della F, più frequente tra coloro esposti professionalmente
rispetto alla popolazione generale
Per motivi non ancora ben chiariti si presenta netta asssociazione tra presenza di placche pleuriche e
abitudine fumo di sigaretta.
Assunzione che i portatori di placche pleuriche sembrano a maggiore ricshio di sviluppare tumori
maligni anche in sedi diverse dalla pleura.
La valutazione della presenza e della caratteristica delle placche pleuriche ialine può può essere
utile al fine di stabilire la probabilità che i soggetti siano stati esposti all'asbesto e quindi il loro
rischio di sviluppare patologia come:
fibrosi polmonare
tumori maligni (pleurici e polmonari).
Corpi asbestosici: hanno l’aspetto di corpi di colore marrone dorato, fusiformi o bastoncellari con
un centro traslucido e consistono in fibre di asbesto ricoperte da un materiale proteinaceo
contenente ferro. Si formano quando i macrofagi tentano di fagocitare le fibre di amianto.
Le placche pleuriche, le più frequenti manifestazioni dell’esposizione all’asbesto, sono placche ben
circoscritte di collagene denso. Si sviluppano in genere sulle zone anteriori o posterolaterali della
pleura parietale e sulla cupola diaframmatica. Non contengono corpi asbestosici e solo di rado si
presentano in soggetti che non sono entrati in contatto con l’amianto.
La diagnosi differenziale va fatta nei confronti dei depositi di grasso negli obesi, degli esiti di
traumi e degli altri esiti di flogosi pleuriche. La loro bilateralità e la tendenza alla simmetria sono
fattori importanti in favore della origine asbestosica.
Le placche pleuriche sono nettamente demarcate e hanno superficie liscia o irregolare e di colorito
bianco-perlaceo.
Mesotelioma pleurico: Lesione diffusa che si estende ampiamente nella cavità pleurica e si
associa a cospicui versamenti pleurici e invasione diretta delle strutture toraciche. Il polmone
interessato è avvolto da uno spesso strato tumorale soffice gelatinoso di colorito grigiastro.
Se ne riconoscono diversi istotipi:
Epitelioide: cellule cuboidi, colonnari o appiattite formanti strutture tubulari o papillari
simili all’adenok. Può essere difficile da distinguere da un adenok polmonare. Ciò che mi
indirizza verso il mesotelioma è:
o Colorazione positiva per il mucopolisaccaride acido
o Mancata colorazione per CEA e altri antigeni glicoproteici epiteliali, generalmente
espressi dal k
o Forte colorazione per le proteine di cheratina con accentuazione colorazione
perinucleare piuttosto che periferica
o Colorazione positiva per calretinina, per il prodotto del gene di suscettibilità Wilms
tumor 1, citocheratina 5/6, mesotelina e trombomodulina.
o Alla ME presenza di lunghi microvilli e abbondanti tonofilamenti, ma assenza di
microvilli corti e corpi lamellari.
Tipo sarcomatoide: questo tipo mesenchimale assume l’aspetto di un sarcoma a cellule
fusate, simile al fibrosarcoma.
Misto: sia aspetti epiteliodi che sarcomatoidi
MALATTIE POLMONARI INDOTTE DA FARMACI I farmaci possono causare alterazioni
sia acute che croniche della struttura e della funzione respiratoria (broncospasmo, edema
polmonare, danno alveolare diffuso, polmonite cronica, fibrosi interstiziale, bronchiolite obliterante,
polmonite eosinofila).
Farmaci citotossici:
Bleomicina (polmonite e fibrosi)
Methotrexate (polmonite da ipersensibilità)
Provocano lesioni polmonari e fibrosi per diretta tossicità del farmaco e per richiamo di cellule
infiammatorie negli alveoli.
Altri farmaci:
Amiodarone (polmonite e fibrosi)
Nitrofurantoina (polmonite da ipersensibilità)
Aspirina (broncospasmo)
Beta – antagonisti (broncospasmo)
MALATTIE POLMONARI INDOTTE DA RADIAZIONI La polmonite da radiazioni è una
nota complicanza della radioterapia delle neoplasie polmonari e toraciche (esofago, mammella,
mediastino).
In genere il polmone è interessato entro il campo di irraggiamento ma occasionalmente può
estendersi ad aree dello stesso polmone o del controlaterale.
Si manifesta in forma acuta e cronica.
Dopo radiazione si manifesta una pneumopatia acuta da radiazioni 1-6 mesi dopo il termine della
terapia.
L'irradiazione ai polmoni causa inizialmente una alveolite linfocitaria o una polmonite da
ipersensibilità che può portare a fibrosi polmonare (pneumopatia cronica da radiazioni).
Quest'ultima è conseguenza del processo di riparazione, stimolato dal danno diretto alle cellule
endoteliali ed epiteliali della zona irradiata.
Le modificazioni morfologiche sono quelle del danno aveolare diffuso, comprese gravi atipie delle
cellule di tipo II e dei fibroblasti.
Anche caratteristica delle lesioni da radiazioni la presenza di cellule epiteliali atipiche e di cellule
schiumose entro le pareti dei vasi.
Apparato gastroenterico
Regolari anastomosi chirurgiche tra esofago prossimale e stomaco residuo tubulizzato in
mediastino.
Fegato e vie biliari
Fegato di gr 1960, da stasi cronica e acuta. Esiti di colecistectomia. Micro: parenchima epatico con
quadri da stasi ematica
Pancreas Nulla di patologico
FEGATO DA STASI
Fa parte delle IPEREMIE PASSIVE. Le iperemie si dividono in:
Attive (per incremento apporto sanguigno): - fisiologicamente nella digestione
- patologicamente nei processi infiammatori
Passive (per stasi: difficoltoso scarico venoso)
IPEREMIA PASSIVA: FEGATO DA STASI
E' l'ingorgo sanguigno epatico per insufficienza cardiaca retrograda (congestizia).
Frequente riscontro autoptico in quanto in ogni morte vi è un elemento pre-terminale di
insufficienza cardiaca.
Il fegato è il primo organo a risentire della difficoltà di deflusso del cuore destro (congestione
passiva del fegato); situazioni analoghe si creano in conseguenza di pericarditi croniche costrittive
che coinvolgono lo sbocco della vana cava inferiore nell'atrio destro.
Se l'insufficienza cardiaca è sinistra, o in caso di shock invece, si ha ipoperfusione epatica e ipossia.
Congestione passiva acuta
Macro: fegato aumentato di volume, teso e cianotico con bordi arrotondati. Presenta intensa
sfumatura rosso-cupa diffusa, abbondante tessuto ematico che sgorga spontaneamente alla sezione.
Micro: dilatazione dei sinusoidi zeppi di elementi del sangue soprattutto a livello centrolobulare.
Con il prolungarsi della stasi: ipotrofia epatocitaria da compressione fino ad atrofia da cui risultano
cordoni di cellule epatiche fortemente assottigliati, ipossia.
2. Congestione passiva cronica
Generalmente è dovuta ad una combinazione di ipoperfusione e congestione retrograda che agendo
sinergicamente determinano una necrosi centrolobulare emorragica.
Macro: in stadio iniziale compare sulla superficie di sezione una variegatura dovuta all'accentuarsi
della stasi centrolobulare con punteggiatura rosso-cupa resa evidente dal contrasto con la steatosi
interessante le aree periferiche dei lobuli (fegato a noce moscata). [La steatosi è il quadro
macroscopico riscontrabile in caso di ipossia. Microscopicamente si ha necrosi centrolobulare il
corrispondenza della zona 3 dell'acino,maggiormente sofferente dell'insufficienza circolatoria.]
Negli stadi più avanzati si sviluppano fenomeni di fibrosi (soprattutto centrolobulari) che fanno
seguito a processi regressivi e da ultimo necrotici causati adlla insufficienza circolatoria.
Il quadro d'insieme è stato anche denominato cirrosi o pseudocirrosi cardiaca.
Il fegato mostra tendenza alla retrazione con granulosità superficiale dovuta a fenomeni
microcicatriziali, aumento di consistenza, capsula ispessita.
Micro: fibrosi soprattutto centrolobulare. Presenza di rigenerazione nodulare da luogo a quadri che
per il loro disordine strutturale sono simili alla vera e propria cirrosi.
In caso di pericardite costrittiva si possono manifstare quadri di “pseudocirrosi pericarditica”.
In stesse evenienze anche abbastanza comune l'ispessimento della glissoniana forse per l'ostacolo
recato anche alla circolazione linfatica: il viscere appare come avvolto da una glassatura : fegato a
zucchero candito
Evidenza clinica: la sola evidenza clinica di necrosi centrolobulare o di una sua variante è una lieve
o moderata elevazione transitoria dei livelli sierici di aminotransferasi.
Il danno parenchimale può essere sufficiente a indurre un lieve o moderato ittero.
Peritoneo
Mesentere con focolai di steatonecrosi. Micro: tessuto adiposo con marcata steatonecrosi
MESENTEREè una parte del peritoneo che connette l'intestino mesenteriale (digiuno ed ileo), con
la parete addominale posteriore.
Come tutti i mesi o ligamenti peritoneali, il mesentere è formato dall'accollamento di due foglietti
(o lamine) mesenteriali: uno destro (che guarda in alto e a destra) e uno sinistro (che guarda in basso
e a sinistra), nei quali passano i vasi sanguiferi, linfatici e i nervi propri dell'intestino mesenteriale.
In corrispondenza dell'attacco all'intestino i due foglietti si separano, andando a costituire le lamine
viscerali che accoglieranno il digiuno e l'ileo (che pertanto sono quindi organi intraperitoneali).
Punti da approfondire
1)definire la steatonecrosi peritoneale e identificare i contesti clinici in cui si può
sviluppare
2) Identificare la causa più probabile nel caso specifico
3)Identificare altre lesioni che possono simulare la steatonecrosi ed entrano in diagnosi
differenziale
STEATONECROSI PERITONEALE: necrosi del tessuto adiposo endoperitoneale
Macro: la lesione può consistere in emorragia nelle prime fasi, e più tardi in necrosi colliquativa
centrale del grasso. Procedendo nell'evoluzione del processo patologico esso si può presentare come
un nodulo solido poco definito di colore bianco-grigiastro in cui si possono riscontrare
calcificazioni.
Micro: distruzione enzimatica delle cellule adipose. Gli acidi grassi liberati da queste reazioni si
complessano con il Ca2+ per formare sali insolubili che precipitano “in situ”: si tratta del fenomeno
di saponificazione che può portare a ipocalcemia.
Cause di staeatonecrosi:
Precedenti interventi chirurgici
Pancreatite acuta
Storia di traumi pregressi (steatonecrosi mammaria)--->tumefazione della mammella spesso
dolente, dovuta a trauma. Le dimensioni non cambiano nel tempo. Difficile DD con il
carcinoma,possibile solo con la biopsia.
A questo punto visto che esiste sulla mammella, non può essere da trauma anche sul
peritoneo in seguito all'intervento chirurgico???
Lesioni che entrano in diagnosi differenziale
Carcinosi peritoneale: si tratta di una permeazione della sierosa o una disseminazione
metastatica peritoneale che può verificarsi in qualunque tipo di neoplasia in fase avanzata. I
tumori che più spesso causano la formazione di impianti sierosi sono i carcinomi di ovaio e
pancres.
Può manifestarsi clinicamente con ascite e può portare a ostruzione renale o intestinale e
cachessia.
TBC peritoneale: localizzazione extrapolmonare della TBC. Insorge in seguito a rottura di
linfonodi o organi intraddominali infetti o nella disseminazione ematogena. Dolore
addominale, febbre e ascite. In caso di contemporanea presenza di cirrosi la diagnosi è più
difficile. Alla paracentesi:liquido essudatizio con elevato contenuto proteico e leucocitosi
(linfociti). La coltuta difficilmente è diagnostica e spesso è necessaria la biopsia peritoneale
per via laparotomica.
PANCREATITE ACUTA: in corso di pancreatite acuta emorragica si ha digestione enzimatica sia
del tess adiposo properitoneale sia del foglietto parietale della sierosa che ne risulta scontinuato. Si
hanno chiazze opache bianco-giallastre sptt in corrispondenza del grande omento e della parete
posteriore dell'addome. Tale aspetto è dato da enzimi lipolitici che mediante la liberaz di acidi
grassi favoriscono la formazione di saponi. Inoltre si liberano gocce di grasso visibili nel liquido
peritoneale nelle fasi iniziali dando l'aspetto a brodo di pollo. Poi si sovrainfetta e l'essudato
peritoneale diventa purulento.
Cause: 1) Ostruzione duttale: - colelitiasi
- ostruzione dell'ampolla
- alcolismo cronico
- concrezioni duttali
Meccanismi: Edema interstiziale, conseguente apporto enmatico alterato,
ischemia.
2. Danno acinare: - alcool
- farmaci
- traumi
- ischemia
- virus
Meccanismi: rilascio proenzimi intracellulari e idrolasi lisosomiali; attivazione degli enzimi (intra o
extracellulare).
3) Trasporto intracellulare alterato: - danno metabolico
- alcool
- ostruzione duttale
Meccanismi: rilascio proenzimi in compartimento lisosomiale e successiva attivazione intracellulare
degli stessi.
Tutto questo va a determinare un danno acinare con attivazione enzimatica.
Lesioni: a) Infiammazione interstiziale + edema
b) Proteolisi (dovuta a proteasi attivate)
c) STEATONECROSI (per azione di lipasi e fosfolipasi)
d) Emorragia (elastasi)
Quadro conclamato di pancreatite acuta.
Forma lieve: edema interstiziale e focali aree di steatonecrosi a carico di parenchima
ghiandolare e tessuto adiposo peripancreatico.
Focolai di staeatonecrosi possono essere riscontrati anche nei depositi adiposi extrapancreatici:
come omento e mesentere intestinale, oppure tessuto sottocutaneo.
Milza ed apparato emopoietico
Milza di 240 gr con polpa diffluente (ok per sepsi)
MILZA CON POLPA DIFFLUENTE
La polpa sarà molliccia, si disgregherà facilmente al taglio con il coltello in autopsia, sarà congesta,
iperemica con cellule del sistema immunitario captate dalla polpa bianca della milza. Si ha
maggiore afflusso di sangue con attivazione del sistema immunitario.
La milza ha funzione emocateretica, in condizioni patologiche si ha anche cateresi dei neutrofili che
vanno a morire nella milza, soprattutto a livello dei cordoni della polpa rossa che sono tappezzati da
elementi ad attività macrofagica.. Polpa bianca è costituita da elementi linfoidi. Polpa rossa è
costituita da sistema dei seni ( letto capillare tappezzato da elementi ad attività macrofagica)
Sì è segnalato lo scarso rilievo che, in condizioni normali, lo splene assume come serbatoio di
sangue e, per quanto attiene al venir meno delle azioni di sequestro, può al massimo succeder che
rinvenga in circolo una parte di quelle emazie malformate che la milza provvede ad eliminare.
Infatti, l’azione emocateretica può svolgersi senza apprezzabili modificazioni ad opera portale
oppure in ambito epatico o sovra epatico. L’ entità della stasi infatti, è tanto minore quanto più
distante è la sede dell’ostacolo circolatorio. Va anche considerato, a questo proposito, che nel caso
di impegno a livello delle vene sovra epatiche e del cuor destro, il fegato funge da bacino di riserva
e attenua le conseguenze della stasi sulla milza accogliendo,almeno per un certo tempo, buona parte
del sangue in eccesso. Ed invero, nella sindrome cardiaca da scompenso destro, la stasi splenica è di
regola assai modesta. Cospicua invece, è la splenomegalia congestizia da ipertensione portale e
ancor più in caso in presenza di occlusione della vena porta o della vena splenica.
La milza appare di volume nettamente aumentato oscillante tra i 600 e i 1200 grammi, fino a
superare in alcuni casi i 2000 grammi. La capsula è ispessita e irregolare,al taglio la consistenza è
variabile: molle nelle forme recenti, aumentata in quelle inveterate; il colore è grigio-rossastro con
evidenza delle trabecole e riduzione di volume dei corpuscoli di Malpighi, i quali appaiono privi di
centro germinativo con ialinosi delle arteriole centro follicolari; si possono evidenziare aderenze
con gli organi circostanti.
Istologicamente si rilevano emorragie periarteriolari e perifollicolari nelle cosiddette aree
sclerosiderotiche ( noduli siderotici di Gandy-Gamma) di oltre 0,5 mm di diametro, costituiti da
tessuto fibroso concentricamente stratificato, in parte ialinizzato con inclusione di pigmenti
contenenti ferro, nonché fenomeni di ipertrofia sclerotica della polpa rossa. I cordoni splenici sono
ispessiti per la proliferazione dei fibroblasti e di macrofagi. I seni venosi sono congesti e dilatati; i
vasi venosi a livello del peduncolo splenico disteso presentano lesioni intimali.
Reni ed apparato uropoietico
Reni di gr 220 ciascuno, con fine granulia nel parenchima sottocapsulare. Micro: nefroangiosclerosi
e pielonefrite cronica
Punti da approfondire
La diagnosi di danno renale è opinabile. Identificare e discutere le eventuali “contraddizioni
Apparato genitale
Genitali esterni di ridotte dimensioni. Ipotrofia testicolare.
Apparato endocrino
Nulla ai surreni e alla tiroide.
Rene normale pesa in genere 150 g
PIELONEFRITE CRONICA
L’uso del termine pielonefrite cronica ancora oggi è oggetto con controversie. Inizialmente si
identificava con pielonefrite cronica qualsiasi forma di malattia tubulo-interstiziale cronica. In realtà
qualsiasi nefropatia in fase terminale può complicarsi con una sovra infezione. In seguito al suo
andamento progressivo la pielonefrite cronica ha spesso una prognosi sfavorevole e, dopo la
glomerulo nefrite cronica, rappresenta la seconda causa di uremia. Il quadro conclamato è la
conseguenza del persistere nel tempo dello stato infettivo a carico del rene o, più frequentemente, di
episodi successivi di colonizzazione batterica sostenuti di volta in volta diversi.
Attualmente si riconoscono due forme di pielonefrite cronica
Una legata al reflusso vescico- ureterake e intrarenale è la forma + comune. Il
coinvolgimento renale si verifica già nell’infanzia come risultato della sovrapposizione di
una infezione urinaria su un reflusso vescicoureterale e intrarenale congenito (quest’ultimo a
sua volta condizionato dal numero di papille potenzialmente refluenti.
Gli effetti dell’ostruzione contribuiscono all’atrofia del parenchima.
L’altra a ostruzione legata a diverse patologie
o
o
o
o
o
o
o
o
Malformazioni vie escretrici
Stenosi dell’uretra
Iperplasia o k prostata
K vescica
K ureteri
Calcolosi pervi e ureteri
Fibrosi retro peritoneale
Gravidanza.
Peculiare della pielonefrite cronica è la distribuzione disomogenea delle lesioni nell’ambito del
singolo rene o dei 2 viscere. Nel caso in cui il reflusso o l’ostruzione siano monolaterali un solo
rene è colpito. Nelle fasi avanzate il rene è fortemente ridotto di volume (tra tutte le riduzioni di
volume quella legata alla pielonefrite cronica raggiunge i valori più bassi soprattutto nelle forme
unilaterali.
L’aspetto caratteristico è una retrazione cicatriziale cortico midollare grossolana, ben distinta che
sovrasta calici dilatati, tozzi o deformati.
La superficie esterna è solcata da irregolari cicatrici che incidono profondamente il parenchima che
sulla sup di taglio risulta fortemente assottigliato ma in maniera disuguale da punto a punto. La
papilla corrispondente alla cicatrice cortico-midollare è deformata e retratta e il calice più o meno
dilatato.
La distribuzione del danno cicatriziale è diversa nelle 2 forme:
Ostruttiva: le cicatrici, irregolarmente distribuite, sono estese a maggior quote di
parenchima che appare diffusamente assottigliato con dilatazione di tutti i calici
Da reflusso: le lesioni tendono ad essere più circoscritte e di norma a localizzazione polare.
Nel caso di localizzazione monolaterale l’altro rene va incontro a ipertrofia compensatoria.
Microscopicamente si conferma il carattere focale delle lesioni: aree di parenchima danneggiato con
affianco aree di aspetto pressoché normale.
In corrispondenza delle cicatrici abbiamo tubuli ora con spessa membrana basale ed epitelio
atrofico, ora con lume dilatato tappezzato da epitelio appiattito contenenti cilindri eosinofici
(aspetto pseudo tiroideo) immersi in abbondante stroma fibroso. Nelle cicatrici di + recente
formazione abbiamo un infiltrato infiammatorio parvirotondocellulare. L’associazione di un
analogo infiltrato nella tonaca propria dei calici e della pelvi e nella parete dell’uretere è indicativo
di una perdurante attività dell’infezione. Le lesioni glomerulari sono tardive e secondarie alla fibrosi
interstiziale e al danno vascolare e si manifestano come fibrosa concentrica periglomerulare o di
sclerosi globale di tipo ischemico del flocculo. Nelle fasi avanzate caratteristico è il reperto di
corpuscoli del Malpighi ialini fra loro ravvicinati in seguito alla retrazione cicatriziale dello stroma
interposto. Nel caso di pz iperteso le lesioni vascolari è esteso a tutto il parenchima e nel caso delle
pielonefriti unilaterali anche nell’altro rene.
Evoluzione: La forma ostruttiva può avere esordio insidioso o presentarsi con dolore dorsale,
febbre, piuria e batteriuria. La forma da reflusso spesso è asintomatica; in questo caso i pz giungono
all’osservazione in fase relativamente avanzata della malattia per il riscontro di IR o ipertensione o
piuria/batteri uria all’esame delle urine. Lo studio radiologico mostra reni con una asimmetrica
riduzione di volume con caratteristiche cicatrici grossolane e accorciamento e deformità dei calici.
Alcuni pz possono sviluppare una glomerulo sclerosi focale e segmentaria con notevole proteinuria
(prob per alterazione glomerulari adattative secondarie alla perdita di massa renale determinata
dalla cicatrizzazione pielonefritica).
NEFROANGIOSCLEROSI
Ne esiste una forma benigna e una maligna.
1. Benigna:
Dal punto di vista clinico abbiamo un innalzamento dei valori pressori diastolici e in questi soggetti
la funzione renale non si deteriora al punto di causarne il decesso (spesso muoiono per problemi
cardiaci o cerebrali). I reperti sono di diversa gravità a seconda della durata dell’ipertensione,
ma in forme croniche i reni sono diminuiti di volume. I reni sono simmetricamente colpiti e
hanno capsula aderente alla superficie che appare finemente granulare in seguito alle lesioni
delle diramazioni arteriolari più fini. La corticale è assottigliata spt in corrispondenza degli
infossamenti di maggiori dimensioni dove si riscontrano vere e proprie cicatrici. Talora ci
possono essere cisti da ritenzione.
I vasi arteriosi di maggiore calibro comprese le arterie arciformi e interlobulari presentano un danno
arteriosclerotico in cui la componente ateroma sica è minima. Prevalgono l’ispessimento fibroso
intimale che causa la riduzione del calibro e la frammentazione della lamina elastica interna. Le
arteriole mostrano ispessimento in toto per la presenza di materiale ialino Pas positivo (queste
condizioni note come arteriolosclerosi ialina, non sono tipiche solo degli ipertesi. Posso trovarle
come espressione di processi di invecchiamento e molto di frequente nei diabetici)I glomeruli
appaiono normali oppure possono essere ischemici: la massa glomerulare è ipocellulare con
membrane basali ispessite e ripiegate, spazio urinifero è occupato da materiale pas positivo
riferibile a collagene nel cui contesto ci sono rare cellule fusate di tipo fibroblastico. I tubuli sono
atrofici.
2. Maligna
Clinicamente si ha ipertensione arteriosa con valori diastolici superiori a 130. Il decorso della
malattia è tumultuoso con declino della funzione renale e in molti casi anemia emolitica, nel
sedimento comparsa di ematuria e proteinuria. Un quadro sovrapponibile a quello della fase
maligna dell’ipertensione si può osservare in corso di altre malattie vascolari del rene come la
sclerodermia, la sindrome emolitico-uremica e la pan arterite.
I reni sono aumentati di volume. Sulla sup esterna si riconoscono diffuse emorragie di tipo
petecchiale e occasionalmente piccoli infarti ischemici subcorticali. La necrosi fibrinoide della
parete delle arteriole è costante e distintiva dell’ipertensione maligna.(necrosi fibrinoide =
lesione granulare eosinofila della parete dei vasi che si colora positivamente per la fibrina.
Questo cambiamento rappresenta un evento acuto e può essere accompagnato da infiltrato
infiammatorio all’interno della parete, in genere cmq modesto) La parete delle arteriole non è +
riconoscibile ed è sostenuta da materia granulare che appare eosinofila. La parete necrotica talvolta
è permeata da emazie e elementi infiammatori. Le arterie interlobulari presentano un’alterazione
caratteristica definita endoarterite fibrosa che è la principale responsabile dell’ischemia renale. (si
caratterizza per spiccato ispessimento concentrico dell’intima nel cui contesto compaiono cellule
muscolari lisce e fibre collagene).
La caratteristica + tipica dei glomeruli è la necrosi fibrinoide che nelle fasi + tardive viene sostituita
da scleroialinosi. La fibrosi interstiziale è più modesta che nella forma benigna ma è rilevante
l’atrofia tubulare.
EPICRISI
C. iniziale: k squamocellulare del terzo medio dell’esofago
C. intermedia: pz cachettico post chemio – rt
C. finale: broncopolmonite con quadro di shock settico
Stati patologici associati:
-
sindrome di Klinefelter
ipertrofia ventricolare sx e coronarosclerosi
placche pleuriche
nefroangisclerosi e pielonefrite cronica.